Se determinó la frecuencia de L. monocytogenes en tomates y cilantro, de tres diferentes supermercados, ubicados en el Municipio Valencia, Estado Carabobo, durante ocho semanas. Se evaluaron 192 muestras: 96 de tomates y 96 de cilantro. Procesamiento y análisis microbiológico, según Normas Industriales COVENIN 3718:2001. Paquete estadístico SPSS versión 12.0. Se aplicó prueba de Kolmogorov Smirnov, test de U Mann Whitney y Kruskal Wallis y correlación de Spearman. Nivel de significancia (p<0,05). No se encontraron diferencias significativas entre los valores medios y desviación estándar en el número del Numero Mas Probable (NMP) de Listeria spp para tomates y cilantro, durante las ocho semanas de recolección en los tres supermercados; ni tampoco entre las distribuciones de NMP en tomates y cilantro de los tres supermercados (Chi2=5,233 p<0,073; Chi2=1,624 p<0,444 respectivamente); ni entre las muestras por semana (Chi2=6,547 p<0,477; Chi2=2,667 p<0,914 respectivamente). Se encontró diferencia significativa (p<0,0001), en las diferencias de distribución de NMP entre tomate y cilantro y en el número de NMP entre tomates y cilantro (p<0,001). La presencia de Listeria spp en tomate fue 41,66% (25,0% L. monocytogenes y 16,7% L. ivanovii); en cilantro 77,08% (36,5% L. monocytogenes, 33,3% L. ivanovii, 7,3% L. seeligeri). Se concluye que el elevado porcentaje encontrado de L. monocytogenes en tomates y cilantro, es independiente del supermercado de expendio; se evidencia la necesidad de un control microbiológico a nivel del sistema de riego, recolección y distribución, para asegurar la calidad del producto.
Palabras clave: Listeria monocytogenes, vegetales frescos tomates, cilantro, control microbiológico.
The incidence of L. monocytogenes in tomatoes and coriander obtained from three different markets, during eight weeks were determined. 192 samples were evaluated: 96 of tomatoes, and 96 of coriander. The isolation of L. monocytogenes was performed using COVENIN 3718:2001. The data were analyzed by SPSS version 12.0. Kolmogorov Smirnov, Mann Whitney U, Kruskal Wallis U test; Spearman’s correlation were applied, and p<0.05 significance level was aplied. It was not found significant differences between the medias values and standard deviations of Most Probable Number (MPN) of Listeria spp to tomatoes and coriander during the eight weeks of recollection in the markets; neither between the distributions of MPN of tomatoes and coriander from the markets (Chi2=5,233 p<0,073; Chi2=1,624 p<0,444 respectively) neither the samples per weeks (Chi2=6,547 p<0,477; Chi2=2,667 p<0,914 respectively). In the number of MPN between tomatoes and coriander both distributions were significant different according to test U Mann Whitney U=3040,5 (Z=-4,216 p<0,0001). It was found statistical significance (p<0,001) between the number of MPN of tomatoes and coriander. The presence of Listeria spp in tomatoes was 41,66% (25,0% L. monocytogenes and 16,7% L. ivanovii); in coriander 77,08% (36,5% L. monocytogenes, 33,3% L. ivanovii and 7,3% L. seelige.). We concluded that the high level of L. monocytogenes in tomatoes and coriander is independent of the markets store; we see the necessity of a microbiological control on the irrigation system, collection and distribution to ensure the quality of the product.
Key words: Listeria monocytogenes, fresh vegetables tomatoes, coriander, microbiological control
Universidad de Carabobo, Valencia y Facultad de Ingeniería de Alimentos, Canoabo, Universidad Simón Rodríguez. Venezuela
La mayoría de los vegetales de consumo habitual pueden presentar contaminación bacteriana y por ende ser vehículos de enfermedades y portadores de agentes infecciosos como Listeria monocytogenes (1). Entre los alimentos de origen vegetal involucrados están: tomates, cilantro, célery, coliflor, espárragos, brócoli, repollo y lechuga, existiendo dentro de la demanda de vegetales mínimamente procesados, incrementada por el auge de los servicios de comida rápida como lo son las ensaladas (“salad bar”), aumentando así el riesgo asociado a enfermedades causadas por L. monocytogenes (2-4), y/o portadores del patógeno (5,6). La listeriosis es una enfermedad de transmisión alimentaria causada principalmente por L. monocytogenes, productora de una toxina citolítica y hemolítica, llamada listeriolisina O, la cual se secreta a pH bajo y baja concentración de hierro y actúa como un importante factor de virulencia. Aunque se presenta como casos esporádicos o en brotes a nivel mundial con una tasa de mortalidad cercana al 30%, principalmente entre personas inmunocomprometidas, infantes o mujeres grávidas que son la población de más alto riesgo (7-11); investigadores reflejan porcentajes de hasta 25% de presencia de L. monocytogenes en vegetales (12).
En Venezuela se han reportado datos discretos (13-15), más por falta de estudios epidemiológicos, que por ausencia del patógeno. L. monocytogenes es un patógeno difícil de controlar en los alimentos vegetales gracias a su capacidad de resistir amplios rango de temperatura, pH y cloruro de sodio (sal). La erradicación completa y definitiva de L. monocytogenes en los ambientes de producción de alimentos se considera poco probable, ya que la investigación microbiológica, requiere de períodos de pre-incubación y de incubación, que además de alargar el proceso, no dan una idea de la contaminación inicial. Estudios de los efectos de los diferentes parámetros de procesamiento en la industria, han permitido indagar sobre los factores que contribuyen al desarrollo, supervivencia e inactivación de L. monocytogenes (11,16). En el presente trabajo se determinó la prevalencia de L. monocytogenes en tomates y cilantro frescos, adquiridos en tres supermercados diferentes ubicados en el Municipio Valencia, durante ocho semanas.
Se adquirieron muestras de los dos tipos de vegetales frescos: tomates (grupo 1) y cilantro (grupo 2), de tres cadenas diferentes de supermercados (A, B, C) de Valencia, Venezuela. La recolección se realizó adquiriendo 12 muestras al azar de cada grupo y de cada supermercado por semana, durante ocho semanas, para un total de 96 muestras por grupo. Durante cada semana, las muestras se colocaban en bolsas plásticas estériles, selladas y transportadas en una cava refrigerada al laboratorio de microbiología, para su procesamiento y análisis por duplicado empleando las Normas Industriales COVENIN (17). El aislamiento de L. monocytogenes se realizó empleando el método recomendado por la Norma Venezolana (18). Se utilizó Agar PALCAM como medio tradicional selectivo para aislar al microorganismo.
Preparación de las muestras. Cada paquete de muestra de tomate y de cilantro frescos fue macerado por trituración y mezclado; de cada uno se pesó 1 g y se mezcló con 9 mL de caldo soya tripticasa al 0,6% de extracto de levadura, para obtener una dilución 1:10. De la dilución 1 en 10, se realizaron diluciones en serie hasta alcanzar la dilución de 10-9. Cada una de las diluciones se incubó a 37°C en estufa por espacio de 6 horas. Luego se tomó 0,1 mL de cada dilución y se sembró en Agar PALCAM por la técnica de difusión en agar con la espátula de Drigalski, se incubó a 37°C y se observó a las 24, 48 y 72 horas para evidenciar el crecimiento del microorganismo, y se procedió a realizar las pruebas de aislamiento e identificación (17, 18).
Identificación y confirmación de las cepas. Usando la identificación morfológica de las colonias que crecieron en agar PALCAM, se inocularon aquellas colonias típicas del microorganismo, por estriación con asa de platino en placas de Agar Tripticasa Soya con 0,6% de extracto de levadura, incubándose a 37°C por 48 horas, a partir de este cultivo se realizaron: coloración de gram, prueba de movilidad en medio SIM, motilidad en lámina escavada, prueba de hemólisis en agar sangre, prueba de CAMP, prueba de catalasa y el esquema de identificación bioquímica con las pruebas de fermentación de ramnosa, manitol, TSI (lactosa, sacarosa, glucosa) y la prueba de bilis esculina, para la identificación y confirmación de Listeria spp (18).
Análisis estadístico. Los datos fueron analizados con el paquete estadístico SPSS versión 12.0 para ambiente Windows. La información se presenta en cuadros de asociación, con frecuencias absolutas, porcentajes, promedios y desviaciones estándar del número de Número Más Probable (NMP) de Listeria spp.
La Prueba de Kolmogorov Smirnov realizada a las variables investigadas, no mostró distribución normal. Por tal motivo, las comparaciones de los valores medios entre grupos (supermercados, vegetales, semanas de recolección de las muestras y cepas de Listeria spp) se utilizaron para el análisis de los valores del NMP para métodos no paramétricos; test U Mann Whitney y el de Kruskal Wallis, para dos y tres grupos respectivamente. Estas pruebas permiten la comparación de los órdenes que ocupan los valores de las variables en cada grupo investigado. Se aplicó la correlación de Spearman para establecer la asociación ordinal entre el número de los NMP en muestras de los dos vegetales. Criterio de significancia utilizado p<0,05.
En la Tabla 1 se presentan los valores medios y de desviación estándar del número del NMP de Listeria spp, de las muestras de tomate y cilantro de los tres supermercados, durante las ocho semanas que duró la recolección. No se encontraron diferencias significativas de los valores promedios entre los supermercados y/o semanas y entre los mismos. No se observaron diferencias significativas entre las distribuciones de NMP en los tomates de los tres supermercados (Chi2=5,233 p<0,073) ni entre las muestras de tomate por semana (Chi2=6,547 p<0,477); igual que para el caso de las muestras de cilantro, los resultados tampoco dieron diferencias significativas entre las distribuciones del NMP de los tres supermercados (Chi2=1,624 p<0,444), ni para el período de recolección muestral (Chi2=2,667 p<0,914).
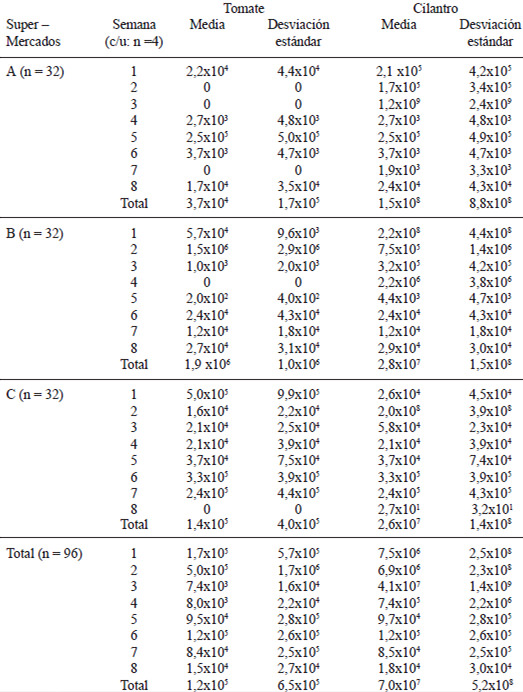
Con respecto a las diferencias del NMP de Listeria spp entre las muestras de tomate y cilantro, se halló que ambas distribuciones difieren significativamente según el test U Mann Whitney, U=3040,5 (Z= - 4,216 p<0,0001), lo que implica que las distribuciones del NMP fueron diferentes. Al observar los valores promedios, se puede apreciar que hubo mayor número del NMP de Listeria spp en las muestras de cilantro que en el tomate.
La correlación de Spearman entre el número de NMP de Listeria spp en las muestras de tomates y de cilantro, dio como resultado un coeficiente igual a 0,448 que determina una significación estadística de p<0,001, demostrando que la presencia de Listeria spp en tomate se correlaciona significativamente con la existencia de la misma en el cilantro en el estudio realizado.
La Tabla 2 presenta la presencia de cepas de Listeria spp en el total de las muestras de tomates y de cilantros analizadas. Se puede observar que no hubo crecimiento del patógeno en el 58,3% de los tomates y 22,9% del cilantro. De las muestras de tomate donde hubo crecimiento se encontró 25,0% de L. monocytogenes y 16,7% de L. ivanovii; mientras que en las muestras de cilantro se encontró 36,5% de L. monocytogenes, 33,3% de L. ivanovii y 7,3% de L. seeligeri.
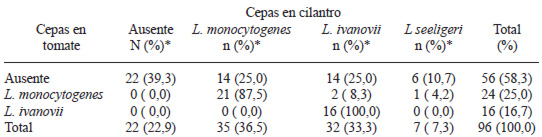
Los valores medios que se muestran en la Tabla 3, sólo corresponden al número del NMP de los cultivos que dieron positivos. Al establecer la comparación ordinal entre la presencia de L. monocytogenes en tomate y en cilantro, dio un resultado no significativo (U = 392,500; Z = -0,425 p<0,671).
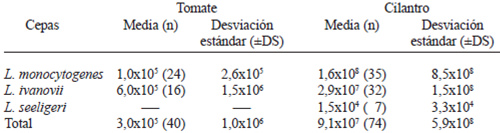
Con respecto a L. ivanovii entre ambos vegetales, tampoco dio diferencia entre las dos distribuciones (U = 252,500; Z = -0,077 p<0,939).
Si se compara dentro de los tomates, la distribución del L. monocytogenes con la presencia de L. ivanovii, las distribuciones de los valores del NMP no fueron significativamente diferentes (U=169,00; Z = -525 p< 0,539); mientras que en el caso de las muestras de cilantro, donde se compara la distribución de la data en sentido ordinal de los valores, según las tres especies en los cultivos de Listeria spp, se obtuvo un valor de Chi2 = 3,987 p<0,136.
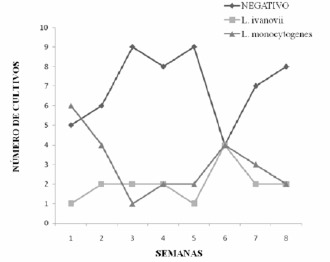
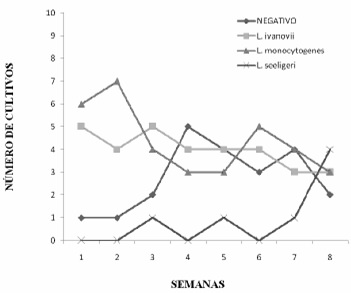
La Figura 1 presenta la distribución de las muestras de tomate (n=96) según el resultado de los cultivos de Listeria spp por semana de recolección. Se puede observar que durante las cinco primeras semanas no hubo crecimiento del patógeno, en comparación con la sexta semana donde hubo un crecimiento considerable del mismo para luego disminuir a los niveles cercanos en la cuarta semana. Por otro lado, la positividad de L. ivanovii fue menos variable que la de L. monocytogenes, L. monocytogenes, partió de seis muestras positivas en la primera semana, disminuyendo hasta la tercera semana y volviéndose a elevar en número para las siguientes semanas, esto sin alcanzar el nivel máximo de la primera semana y coincidiendo con el nivel de L. ivanovii para la última semana, donde fue de dos resultados de cultivos positivos para cada especia de Listeria.
En la Figura 2 se presenta el período de recolección de las muestras de cilantro; L. ivanovii y L. monocytogenes tuvieron un crecimiento positivo similar durante las dos primeras semanas, para luego seguir sin grandes alteraciones en las semanas subsiguientes, variando alternativamente la posición predominante de uno u otro. En cuanto a L. seeligeri el número de cultivos positivos fue entre cero y uno hasta la séptima semana, para aumentar a cuatro cultivos positivos en la octava semana. La negatividad en los cultivos también tuvo un ascenso en las últimas semanas. Igualmente sucedió que la última semana las tres especies tuvieron casi el mismo número de cultivos positivos, es decir entre tres y cuatro.
En la Figura 3 se presenta la distribución de todas las muestras de tomates y cilantro según el crecimiento de Listeria spp por supermercado. Se puede observar que la negatividad de Listeria spp., fue siempre superior en las muestras de tomates con respecto a las de cilantro en el mismo supermercado. En tomates, el supermercado A presentó menor número de cultivos positivos para L. monocytogenes, mientras que en los supermercados B y C, hubo igual número de casos de L. monocytogenes; hubo además una positividad en igual número de L. ivanovii.
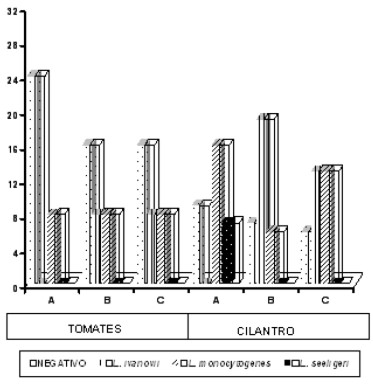
Para el caso de las muestras de cilantro, el supermercado A tuvo el mayor número de cultivos positivos de L. monocytogenes; en el supermercado B predominaron los cultivos positivos de L. ivanovii. La presencia de L. seeligeri sólo se evidenció en el supermercado A.
La vía de entrada de L. monocytogenes en el organismo, en la mayoría de las formas naturales de listeriosis, es la vía oral. La ingestión de alimentos con cantidades suficientemente altas de L. monocytogenes provoca, en un gran número de casos, una infección subclínica, a veces sólo apreciable por una ligera elevación de la temperatura corporal. La infección conduce inevitablemente a una bacteriemia con diseminación de la bacteria a órganos linfoides y a otros órganos parenquimatosos, con una elevación de la tasa circulante de anticuerpos (19).
Los vegetales tomates y cilantro, no tratados por métodos de esterilización han sido uno de los vehículos de entrada de L. monocytogenes al organismo humano (20-22). La identificación de L. monocytogenes se realiza por métodos convencionales que requieren mínimo de 5 días para declarar si un alimento está libre de Listeria y 10 días adicionales para reconocer la especie monocytogenes (23).
En el presente trabajo durante las ocho semanas que duró la recolección de las muestras de tomate y cilantro, en los tres supermercados, se pudo observar que hubo un crecimiento del patógeno en las muestras de cilantro en 36,5%, mientras que en los tomates fue del 25,0%. Pingulkar y col. (5), al evaluar vegetales frescos encontraron 11,2% de Listeria monocytogenes en tomates, resultados estos muy por debajo de lo encontrado en este trabajo. Por su parte De curtís y col. (13) reportaron valores más bajos a los encontrados por nosotros, y Miranda (14) no reportó Listeria monocytogenes aunque si encontró otras especies de Listeria spp. Esta discrepancia de resultados, pudiera deberse a que en muchos establecimientos, mientras los vegetales se encuentran en los anaqueles, son regados con agua para hacerlos más frescos a la vista del consumidor, pudiendo el agua estar contaminada con el patógeno y ser el vehículo mediante el cual llegue al vegetal, como lo indican Sepúlveda y col. (12) y Sánchez y col. (15). Otro punto a considerar es la contaminación poscosecha tal como: traslado, manipulación y almacenamiento de los vegetales, que pudieran aumentar la posibilidad de contaminar con Listeria spp. Zhao y col. (20) evidenciaron Listeria monocytogenes en las manos de trabajadores de una planta procesadora, lo que permite que fácilmente puedan llegar al vegetal.
En el presente estudio en las muestras de cilantro estudiadas se aislaron Listeria monocytogenes, Listeria ivanovii y Listeria seeligeri, con resultados mucho más elevados que los observado por Miranda (14). Fröder y col. (21), encontraron Listeria spp en muestras de vegetales mínimamente procesados, de los cuales 0,6% era Listeria monocytogenes. Sin embargo, los resultados del presente trabajo se relacionan con los datos reportados por Pingulkar y col. (5), donde evidenciaron un alto porcentaje de Listeria spp en un grupo de vegetales de ensaladas listas para consumo, encontrando tanto Listeria ivanovii, como Listeria monocytogenes este último en 50% de los cilantros analizados.
El alto porcentaje de positividad de Listeria spp encontrado en este estudio, pudiera deberse como es en el caso del tomate, a la manipulación o al riego y no al supermercado, dado que el control microbiológico desde el origen no asegura la calidad microbiológica del mismo, alterando de esta manera la cadena alimentaria; por otro lado el almacenamiento prolongado en los anaqueles, pudiera alterar las condiciones de higiene del producto. Carrasco y col. (22) reportaron la habilidad de Listeria monocytogenes para sobrevivir y crecer en vegetales almacenados durante periodos largos a temperaturas de refrigeración.
La positividad de Listeria monocytogenes encontrada en cilantro mayor que en tomates, se relacionan con los reportados por diferentes investigadores, (14-16, 21,22), esto se explica en virtud de que la planta de tomate es un arbusto y los tomates no están en contacto directo con la tierra abonada, cosa que no es así con el cilantro, que posiblemente se contamina por el riego al salpicar la tierra húmeda sobre la planta. Grif y col. (24), refieren que excrementos de animales infectados con Listeria monocytogenes pueden contaminar el suelo, lo que a su vez contamina el vegetal el cual al ser consumido por el hombre pudiera ser causa de listeriosis. Además, los patógenos aprovechan ciertas cicatrices en los vegetales, para poder entrar e iniciar la proliferación en los mismos, aunque el tomate forma una zona de separación natural que es la cicatriz del pedúnculo, de allí que sea más resistente al ataque de microorganismos patógenos que otros productos, como el cilantro.
En este estudio, en las muestras de tomates y cilantro de los tres supermercados estudiados, hubo un crecimiento de Listeria monocytogenes muy superior, en relación al incremento observado en los últimos años de brotes de Listeriosis y su asociación con el consumo de vegetales crudos (13), los cuales se han hecho populares en forma lista para servir en los autoservicios de ensaladas de restaurantes y como parte integral en la preparación de diversos tipos de sándwiches, por lo que se ha estimulado la necesidad de un conocimiento general sobre la presencia de L. monocytogenes en este tipo de productos. Little y col. (25) indican que no es posible la eliminación total de L. monocytogenes de todos los alimentos; más bien el punto crítico no es cómo prevenir la presencia de L. monocytogenes en los alimentos, sino cómo controlarla para minimizar sus niveles en los mismos. De allí que las autoridades competentes deban velar que las industrias de alimentos realicen un esfuerzo en elaborar alimentos libres de L. monocytogenes, lo cual puede abarcar modificaciones de los equipos y procesos de limpieza ambiental y mejorar los controles de temperatura, para minimizar los posibles riesgos asociados con L. monocytogenes; por lo que se recomienda que la aplicación de los Sistema de Análisis de Riesgos y Puntos Críticos de Control establecidos por las normas internacionales de control de calidad de alimentos, se aplique de manera rutinaria en las industrias procesadoras de alimentos.
Se concluye que la presencia de Listeria monocytogenes, en las muestras de tomate y cilantro es independiente del sitio de expendio por lo que se evidencia la importancia del control microbiológico que se debe seguir a los vegetales frescos, desde su sitio de origen, para asegurar la calidad de los mismos y evitar el peligro potencial para el consumidor y un posible problema de salud pública cuando existe este tipo de contaminación.
Recibido: 21-10-2008 Aceptado: 17-07-2009