Listeria monocytogenes, además de ser un género capaz de producir una enfermedad infecciosa grave en el hombre, puede formar biopelículas en distintas superficies relacionadas con el ambiente de producción alimentario. Éstas constituyen un serio problema debido a que son una fuente importante y constante de contaminación para los alimentos y el ambiente de producción, además de que las bacterias presentes en ellas poseen una aumentada resistencia hacia agentes físicos y químicos de uso frecuente. En el presente trabajo se estudió la capacidad de formación de biopelícula de cepas de L. monocytogenes previamente aisladas a partir de queso tierno bajo diferentes condiciones de temperatura y cultivo. Se utilizó una técnica de microplaca con diferentes medios de cultivo (CICC, CTS 1:20 y suero de queso) a diferentes temperaturas de incubación (refrigeración, ambiente y 35ºC). La capacidad de formación de biopelícula fue clasificada según la densidad óptica obtenida a 620 nm. Ninguna de las cepas evaluadas fue clasificada como formadora fuerte de biopelicula bajo ninguna de las variables estudiadas, sí se detectaron formadoras débiles y moderadas. Los resultados obtenidos ponen de manifiesto la influencia del contenido de nutrientes en el medio de cultivo sobre la formación de biopelícula, no obstante, el CICC fue el único medio que permitió la expresión de formadores moderados. Por el contrario, el suero de queso resultó poco favorecedor. La formación de biopelícula es un proceso multifactorial, donde el nivel de adsorción depende de gran cantidad de variables y cuyo estudio debe fomentarse, de manera que se desarrollen metodologías que permitan su reducción o eliminación, de manera que las industrias alimentarias aseguren productos inocuos y de buena calidad microbiológica.
Palabras clave: Listeria monocytogenes, biopelícula, queso tierno.
Listeria monocytogenes is a bacteria associated with the production of severe infectious disease in human being, but also with the formation of biofilms in different surfaces related to the food production environment. Biofilm represents a serious problem in food industry, since it is a constant and important contamination source and also, bacteria present in it have an increased resistance towards physical and chemical agents of common use. The capacity of biofilm formation of L. monocytogenes strains previously isolated from soft cheese samples from Costa Rica was studied under different temperature and culture conditions. The microplate technique was performed using different culture media (BHIB, TSB 1:20 and cheese serum) and at different incubation temperatures (refrigeration, environmental and 35ºC). Biofilm formation capacity was classified according to the optical density obtained at 620nm. None of the strains evaluated was classified as strong biofilm former under any of the variables studied, nevertheless, weak and moderate formers were detected. The results obtained show the influence of the nutrient content of the culture media used over biofilm formation; BHIB was the only culture media that allowed the expression of moderate biofilm forms, contrary to cheese serum that did not promote biofilm production. Biofilm formation is a multifactorial process, where adsorption level depends on several variables and its study must be promoted in order to develop methodologies that allow its reduction or elimination, so food industries may offer safe food products to consumers.
Key words: Listeria monocytogenes, biofilm, soft cheese.
Facultad de Microbiología, Universidad de Costa Rica. Centro de Investigación en Enfermedades Tropicales.
San José, Costa Rica
La listeriosis es una enfermedad infecciosa bacteriana grave del hombre y de los animales, causada por Listeria monocytogenes y frecuentemente asociada al consumo de alimentos contaminados. Las manifestaciones clínicas de la listeriosis incluyen, entre otros, meningitis, encefalitis, septicemias e infecciones neonatales. Es una enfermedad infecciosa de baja morbilidad pero con una de las tasas de mortalidad más altas, variando entre 13 y 34% (1).
Esta bacteria es capaz de crecer en distintas superficies relacionadas con el ambiente de producción alimentario, y de rodearse de una matriz extracelular amorfa, formando biopelículas (2). La formación de éstas ocurre en dos fases: en la primera se da la adsorción de la bacteria a la superficie, potencialmente reversible, en la segunda se da una adherencia debido a la producción de polisacáridos extracelulares y es irreversible (3).
Las biopelículas constituyen un serio problema debido a que son una fuente importante y constante de contaminación para los alimentos y el ambiente de producción. Por otro lado, las bacterias presentes en ellas poseen una aumentada resistencia hacia los agentes desinfectantes y detergentes (2), la desecación, la luz ultravioleta y hasta el tratamiento con antimicrobianos. (4)
En Costa Rica, el queso blanco representa un producto de amplio consumo, cerca de una cuarta parte de la producción nacional de leche es dedicada a su elaboración (5). Sin embargo, este producto, así como su ambiente de producción, son vulnerables a la contaminación con L. monocytogenes y a la formación de biopelícula a partir de varios productos derivados del proceso de manufactura, especialmente el suero de queso, el cual es generado en un amplio porcentaje a partir de la leche utilizada como materia prima. El suero desechado se convierte en un contaminante habitual en las fábricas de queso donde representa un problema importante para los productores artesanales. Dado lo anterior, se pretende con este trabajo estudiar la capacidad de formación de biopelículas bajo diferentes condiciones de temperatura y de cultivo de diversas cepas de L. monocytogenes previamente aisladas a partir de alimentos.
Se utilizaron 13 cepas de L. monocytogenes, aisladas e identificadas previamente, de muestras de queso tierno provenientes de dos zonas productoras de Costa Rica (Coronado y Zarcero), (6), una cepa ATCC 19116 y tres cepas aisladas en el Hospital Nacional de Niños (HNN) a partir de casos clínicos. Estas cepas se mantuvieron en congelación a - 70ºC en viales conteniendo caldo infusión cerebro corazón (CICC) y glicerol al 30%. Se reactivaron utilizando CICC, incubando a 35ºC por 24 h y se verificó su pureza rayando en agar sangre.
Las cepas bacterianas, una vez reactivadas, fueron ajustadas al estándar de McFarland 1 en agua peptonada estéril al 0.1% (APE). Se tomó tres alícuotas de 500 ul cada una, las cuales fueron agregadas a tubos con 10 mL de CTS, e incubadas a tres temperaturas diferentes: 35ºC por 24 h, a temperatura ambiente (24-25ºC) por 24 y 48 horas y refrigeración (3-8ºC) por 7 días. De la misma manera se realizaron pruebas de crecimiento a temperatura ambiente y 35ºC en tubo utilizando suero de queso autoclavado como sustrato Estas condiciones fueron utilizadas con el fin de tener una mejor idea de la cinética de crecimiento de la bacteria ante las diversas condiciones ambientales que se pueden dar. Esto permitió establecer los parámetros de tiempo de incubación empleados en los experimentos con las placas descritos más adelante.
La cuantificación de la producción de biopelículas se realizó según el método descrito por Stepanovic et al (4) modificado. Brevemente, se utilizaron placas de 96 hoyos estériles, a los cuales se les agregó 230 ul del medio de cultivo a evaluar: CICC, CTS (caldo tripticase soya) 1:20 (placas 1-4) o suero obtenido a partir de queso y esterilizado en autoclave (121ºC, 15 min, 15 lbs presión) (placas 5 y 6). A cada uno de estos se agregó 20 ul de cada una de las suspensiones bacterianas preparadas previamente (por triplicado) y se incubaron en aerobiosis y cámara húmeda de acuerdo a la Tabla 1.
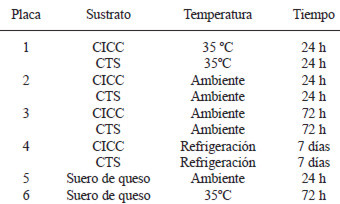
Cabe destacar que el suero de queso propició resultados negativos en cuanto a la formación de biopelícula a temperatura ambiente y a 35ºC por lo que se descartó su análisis en condiciones de refrigeración.
También, que estas condiciones fueron seleccionadas pues se buscaba imitar situaciones de crecimiento que se presentan en el ambiente real de una planta procesadora de queso.
Como control negativo se utilizó el medio o el suero de queso sin inocular. Transcurrido el tiempo de incubación, se procedió a eliminar el contenido de las placas, se realizó tres lavados con 300 μl de agua destilada estéril. Seguidamente se agregaron 250 μl de cristal violeta por 5 min, con el objeto de teñir las bacterias presentes en la biopelícula. Se eliminó el exceso de colorante y una vez secos los hoyos, se agregó 250 μl de ácido acético glacial 33% con el fin de eliminar el colorante de las bacterias presentes en la placa. Se leyó la densidad óptica de los hoyos a 620 nm utilizando un espectrofotómetro Reader 250 (Biomerieux®).
La capacidad de las cepas de producir biopelicula fue clasificada de acuerdo a la densidad óptica (DO) obtenida a 620 nm.
El punto de corte (D.O.C.) y la clasificación de las cepas fueron definidos de acuerdo a las recomendaciones de Stephanovic et al. (4). El D.O.C. está conformado por el promedio de las densidades ópticas obtenidas en los controles negativos más 3 desviaciones estándar. Se considera como no productoras de biopelícula a aquellas cepas con una DO inferior al DOC, cepas productoras débiles a aquellas con una DO superior a DOC e inferior a 2 DOC, moderadas aquellas que presentan una DO entre 2 DOC y 4 DOC y fuertemente productoras a aquellas que presentan una DO superior a 4 DOC.
Los resultados obtenidos fueron analizados mediante una prueba F (inferencia estadística) con el fin de determinar con un 95% de confianza la existencia de diferencias estadísticamente significativas. La comparación se efectuó utilizando los promedios de las densidades ópticas obtenidas por todas las cepas, a partir de cada sustrato, en cada una de las condiciones de incubación del experimento.
la Tabla 2 se presenta la clasificación de las cepas de L. monocytogenes evaluadas según su capacidad para formar biopelículas. De acuerdo a los resultados obtenidos, ninguna de las cepas evaluadas fue clasificada como formadora fuerte de biopelícula, bajo ninguna de las variables estudiadas. No obstante, existe diferencia estadísticamente significativa entre las cepas aisladas a partir de queso y las de origen clínico, siendo éstas últimas las que presentan mayor porcentaje de recuperación.
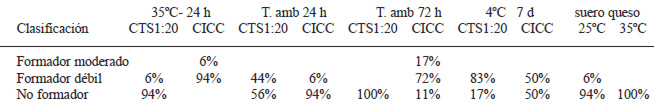
Al analizar los porcentajes de formación de biopelícula según el sustrato utilizado, no se puede discernir ninguna tendencia que favorezca a uno u otro. No obstante, el CICC permitió la detección de formadores moderados de biopelicula, no así el CTS 1:20.
Al analizar las densidades ópticas obtenidas a partir de cada sistema de incubación, se encuentra que existe una diferencia estadísticamente significativa entre los sustratos utilizados para todos los sistemas de incubación, excepto cuando se utilizó una incubación a temperatura ambiente por 24 h.
Se realizó una comparación entre los sistemas de incubación a temperatura ambiente por diferentes períodos de tiempo y también se encontró una diferencia estadísticamente significativa, lo cual pone de manifiesto la relevancia del período de incubación en la formación de biopelículas.
Cuando se utiliza el suero de queso como sustrato, únicamente 6% de las cepas que se incuban a temperatura ambiente se comportan como formadoras débiles de biopelículas y a 35ºC el 100% se comporta como no formador.
La capacidad de formación de biopelícula depende de varios factores, muchos de ellos aún desconocidos (8), uno de estos es el contenido de nutrientes del medio de cultivo. En el presente trabajo, la capacidad de formación de biopelicula por cepas de L. monocytogenes fue evaluada utilizando sustratos que emularan, de la mejor manera posible, las condiciones reales de las plantas procesadoras de queso. Con base en lo anterior, se utilizó CTS diluido, reportado en la literatura como el medio que mejor puede imitar las condiciones de este tipo de plantas procesadoras (9), CICC como medio más rico en nutrientes y suero de queso dada la gran producción de éste dentro de las industrias queseras.
Los resultados obtenidos ponen de manifiesto la influencia del contenido de nutrientes en el medio de cultivo sobre la formación de biopelícula. Tanto el CICC como el CTS diluido 1:20 propiciaron la formación de biopelicula, coincidiendo con los resultados obtenidos por varios autores (4,9). El CICC fue el único medio que permitió la expresión de formadores moderados de biopelícula. Por el contrario, el suero de queso sin diluir, a pesar de contener nutrientes y permitir un buen crecimiento de L. monocytogenes, y otros grupos bacterianos (bacterias mesófilas y coliformes) con base en pruebas realizadas en previamente (datos no mostrados), fue el elemento que menos favoreció la formación de biopelícula. Este comportamiento, coincide con los resultados obtenidos por Shi et al, 2009, quienes demuestran que la utilización de leche sin diluir como sustrato para la formación de biopelículas no es funcional, debido a la presencia de proteínas propias que inhiben la unión bacteriana a diferentes soportes, incluyendo el teflón y el metal (10).
De la misma manera, el pH promedio del suero de queso fue de 5,5, el cual resulta muy ácido para la excreción de sustancias exopoliméricas necesarias para la formación de biopelícula: normalmente, éste debe ser cercano a 7,0 para una producción óptima (11).
El período de incubación también es un factor que afecta la formación de biopelícula, tal y como lo demuestran los resultados obtenidos en este trabajo, donde se pone de manifiesto que mayores tiempos permiten una expresión diferenciada de la capacidad de formación de biopelícula. Como se aprecia en la tabla 2 el factor tiempo parece ejercer un efecto deletéreo en la capacidad de formación de biopelículas cuando el CTS diluido fue empleado como sustrato de crecimiento. Lo contrario ocurre cuando el CICC fue utilizado bajo las mismas condiciones de incubación.
Cabe destacar que la mayoría de las cepas analizadas en este estudio provenían de aislamientos en alimentos y presentaron un comportamiento poco invasivo, lo cual coincide con los resultados obtenidos por Van Langendonck y colaboradores, los cuales determinaron que en los alimentos y en el ambiente es muy frecuente aislar cepas de L. monocytogenes de poco virulencia (12).
Concluyendo, la formación de biopelícula es un proceso multifactorial, donde el nivel de adsorción depende de la superficie seleccionada, el pretratamiento que se dé a ésta, las condiciones ambientales y de crecimiento de las cepas, el pH y la temperatura (13) y donde la cantidad de nutrientes del medio sustrato son determinantes, así como la extensión del período de tiempo de contacto. Es necesario, en trabajos futuros, estudiar otras variables que puedan favorecer la formación de biopelículas, de manera que se puedan desarrollar metodologías que permitan reducir y/o eliminar la formación de las mismas en las plantas de procesamiento de alimentos y así asegurar productos inocuos y de buena calidad microbiológica.
Recibido: 23-09-2009
Aceptado: 27-01-2010