En los últimos años se ha promovido el consumo de linaza (Linum usitatissimum L.) como alimento funcional por sus beneficios a la salud, atribuibles principalmente a su contenido de ácidos grasos omega-3, lignanos, y fibra dietaria. En este estudio se evaluó la calidad microbiológica, composición química y las propiedades antioxidantes de la semilla de linaza cultivada en Venezuela y se comparó con una variedad canadiense de amplia venta en el país. Se determinaron coliformes totales, mohos y levaduras, S. aureus, y esporulados de los géneros Bacillus (aerobios) y Clostridium (anaerobios), humedad, grasas, proteínas, fibra dietética total, soluble e insoluble, mucílago, minerales, perfil de ácidos grasos, contenido de HCN equivalente, aw, color, polifenoles y propiedades antioxidantes como Eficiencia Antirradical (EA), concentración de antioxidante necesario para disminuir la concentración inicial en 50 % (EC50) y el tiempo necesario para alcanzar la EC50 (TEC50). Se determinaron diferencias significativas en la composición de las semillas, resaltando su elevado contenido de grasa, proteínas, ácido alfa-linolénico y fibra dietaria. Se observaron diferencias en el contenido de mucílago, pero no en el de fibra soluble, insoluble y total. La concentración de HCN equivalente en ambas semillas es del orden de 40 mg/100 g, lo cual no representa riesgos a la salud, si se consideran sus formas de consumo. La linaza venezolana contiene mayor contenido de polifenoles que la canadiense, pero la capacidad antioxidante de esta última es mayor; ambas tienen una EA calificada como media (TEC50>30 min).
Palabras clave: Linaza, polifenoles, capacidad antioxidante.
In recent years, the consumption of flaxseed (Linum usitatissimum L.) has been promoted as a functional food for its health benefits, mainly attributable to its content of omega-3 fatty acids, lignans and dietary fiber. This study evaluated the microbiological quality, chemical composition and antioxidant properties of flaxseed grown in Venezuela and compared them to the values of a Canadian variety widely sold in the country. Total coliforms, molds and yeasts, S. aureus and sporulated of the genera Bacillus (aerobic) and Clostridium (anaerobic), moisture, fat, protein, total dietary fiber, soluble and insoluble, mucilage, minerals, fatty acid profile, equivalent HCN content, aw, color, polyphenols and antioxidant properties, like antiradical efficiency (AE), concentration of antioxidant needed to decrease the initial concentration by 50 % (EC50) and the time required to reach the EC50 (TEC50) were evaluated. Significant differences in seed composition were determined, where its high content of fat, protein, alfalinolenic acid and dietary fiber stand out. Differences were observed in the mucilage content, but not in soluble, insoluble and total fiber content. Equivalent HCN concentration in both seeds is in the order of 40 mg/100 g, which poses no health risks, considering their consumption patterns. Venezuelan flaxseed contains higher content of polyphenols than the Canadian does, but the antioxidant capacity of the latter is higher; both have an EA rated as average and a slow reaction time (TEC50> 30 min).
Key words: Flaxseed, polyphenols, antioxidant capacity.
Laboratorio de Análisis de Alimentos, Universidad Simón Bolívar, Caracas, Venezuela.
La semilla de lino, mejor conocida como linaza, es una oleaginosa de origen mediterráneo, considerada hasta hace poco como una “oleaginosa industrial” por sus múltiples usos diferentes al de la alimentación. Sin embargo, variados estudios que muestran su valor nutritivo han despertado el interés de la industria de alimentos y del consumidor (1, 2). La linaza posee un elevado contenido de grasa, fibra y proteínas, así como un aceite, rico en ácidos grasos omega 3 y un considerable contenido de lignanos con efectos beneficiosos sobre la regulación hormonal y en la prevención de enfermedades como el cáncer y la diabetes (3, 4). Además, la linaza contiene compuestos polifenólicos, que le confieren una alta capacidad antioxidante. Sin embargo, también se ha contemplado la posibilidad de que durante el procesamiento de la linaza se generen compuestos tóxicos como glucósidos cianogénicos (5).
El consumo de linaza en Venezuela depende de una importación costosa y comúnmente es utilizada más como una medicina casera, pero varios artículos de divulgación en diferentes medios de comunicación han resaltado sus múltiples propiedades beneficiosas a la salud, tanto preventivas como curativas, sobre todo si la incorporamos a nuestra dieta diaria. Ello ha despertado el interés tanto del consumidor como de la industria y se están elaborando panes, barras energéticas, cereales para desayuno y galletas con linaza como ingrediente, tanto a nivel artesanal como industrial, lo que conlleva a mejorar el contenido de proteínas, fibra y perfil de ácidos grasos de los productos desarrollados (6).
El cultivo de linaza es climáticamente viable en Venezuela, en el estado Mérida existen pequeños cultivos que generan aproximadamente 150 kg de semillas/año. Considerando que la composición de la linaza varía con el ambiente, suelo y condiciones de cultivo, y que no existen antecedentes de estudios previos en Venezuela al respecto, es interesante estudiar la variedad de linaza producida localmente a fin de fomentar su cultivo, disminuir la dependencia de la importación de semilla canadiense, incentivar su investigación, explotar su potencial como ingrediente en la industria de alimentos y aprovechar al máximo sus beneficios como alimento funcional. La comparación con linaza canadiense es válida ya que es la variedad que se importa y consume en Venezuela. El consumo de dicha semilla en el país es en forma cruda, lo que requiere una buena calidad microbiológica que garantice su inocuidad al consumidor. Por lo tanto, el objetivo de este estudio fue evaluar la calidad microbiológica, la composición química y las propiedades antioxidantes de la linaza (Linum usitatissimum L.) cultivada en el Estado Mérida, Venezuela y compararla con la semilla canadiense.
Muestras: la linaza canadiense (de color pardo-rojiza) fue adquirida en el comercio local, mientras que la cultivada en Venezuela (de color dorado) se obtuvo directamente de su productor, en el sector “El Morro” de la ciudad de Mérida (Edo. Mérida). Se analizaron 2 cosechas de linaza venezolana (Cosecha I: Mayo 2005. Cosecha II: Mayo 2006), ya que la baja calidad microbiológica de la primera generó su descarte y se muestreó una segunda cosecha El muestreo utilizado fue de tipo aleatorio simple (7). El tamaño inicial del sublote para ambos tipos de semillas fue aproximadamente 12 kg, y la muestra final 3 kg. La linaza cultivada en Mérida se limpió manualmente de impurezas visibles como ramas, hojas, restos de cápsulas y pequeñas piedras. las muestras se almacenaron en recipientes de color oscuro y bajo refrigeración hasta su análisis.
Análisis microbiológico: Se determinaron coliformes totales, mohos y levaduras, Staphylococcus aureus, y microorganismos productores de esporas de los géneros Bacillus (aerobios) y Clostridium (anaerobios). Para coliformes totales y fecales se utilizó la técnica del número mas probable (NMP), con caldo Lauril Sulfato (Hi-Media) y Bilis Verde Brillante (Merck) en el caso de los coliformes totales y caldo EC (Merck) para los de origen fecal. Los tubos se incubaron a 35 ºC (totales) y a 44,5 ºC (fecales) por 24 - 48 h. (8). Para mohos y levaduras se empleó Agar Papa Dextrosa o PDA (Merck), previa adición de ácido tartárico (14 mL/L), y siembra en profundidad (9). Para S. aureus se utilizó agar Baird Parker BP (BBL™), adicionado de solución de yema de huevo al 40 % y telurito de potasio al 3,5 %, con siembra en superficie o por agotamiento con las diluciones 10-1 y 10-2. Las colonias sospechosas se inocularon por separado en caldo cerebro corazón (Merck) a 35 ºC por 24 h para su enriquecimiento y se les determinó su capacidad coagulasa positiva en solución de plasma de conejo (10). Para los esporulados aerobios se utilizó Agar Dextrosa Peptona de Caseína (Merck), con púrpura de bromocresol como indicador y siembra en profundidad incubadas por 24-72 h a 35 ºC. El recuento presuntivo de Bacillus cereus se hizo en agar Yema de huevo Polimixina Rojo Fenol, con un periodo de incubación de 24 h a 37 ºC, su presencia se confirmó con tinción Gram y pruebas bioquímicas. Para los esporulados anaerobios se utilizaron los medios Reinforced Clostridial Agar RCA (BBL™) con polimixina B (0,02g/L), y el agar Triptona Sulfito Neomicina TSN (Merck), específico para la detección y enumeración de Clostridium perfringens. Para la siembra en agar RCA se utilizaron las diluciones 10-1 y 10-3 con incubación de 7 días a 35 ºC. Se enumeraron las colonias con coloración crema o amarillo pálido. Las placas con agar TSN se incubaron por 24-48 h a 35 ºC, siendo las colonias presuntivas de C. perfringens de color negro, su presencia se confirmó con pruebas bioquímicas, previa recuperación de las colonias presuntivas tomadas del agar TSN en caldo tioglicolato por 24 h a 37 ºC (9). A las colonias obtenidas en ambos medios, se les realizó tinción Gram. Para la determinación de esporas aerobias y anaerobias se calentó la dilución madre de la muestra a 94 ºC por 15 min (11).
Todos los análisis microbiológicos se realizaron por triplicado.
Humedad: según el método 925.40 (12).
Proteínas: se determinó el porcentaje de nitrógeno por el método de kjeldahl (13), en la muestra desgrasada. Se calculó el porcentaje de proteínas (N x 6,25) (5, 14).
Grasa: la extracción fue semicontinua en equipo Soxhlet con hexano grado técnico como solvente, método 920.39 (12).
Cenizas: por incineración completa de la muestra a 500ºC, según método 923.03 (12).
Minerales: se determinó el contenido de sodio, potasio, magnesio, calcio, hierro, fósforo, cinc, cromo, cobre, manganeso y selenio, utilizando el método de emisión atómica con plasma acoplado inducido (ICP), en un equipo marca GBC modelo Integra XL 2001. Las condiciones de trabajo del equipo fueron: Flujo de argón: 0,5 L/min; altura de la fuente: 6 mm; plasma: 12,0 L/min; gas auxiliar: 0,5 L/min.
Fibra dietaria: se siguió el método enzimáticogravimétrico 985.29 (12). Se diferenciaron la fibra soluble y la insoluble.
Mucílago: se utilizó el método propuesto por Bhatty (14). La cuantificación del mucílago se realizó por gravimetría, la evaporación del extracto bajo vacío a 60 ºC para evitar la carbonización del mucílago.
Perfil de ácidos grasos: se separó la grasa con cloroformo/metanol (15), a temperatura ambiente y oscuridad en muestra recién molida. El solvente se evaporó a 30ºC. La grasa extraída se colocó en viales ámbar, bajo nitrógeno y se refrigeró a ≈10 ºC hasta su análisis. Se derivatizó el extracto lipídico (16) y la alícuota se inyectó en un cromatógrafo de gases (GC System) marca HP modelo 6890 Series con columna: SP-2380 (SUPELCO) de 30 m de largo x 0,25 mm de diámetro interno.
Ácido cianhídrico (HCN) equivalente: se utilizó el método propuesto por Bradbury et al. (17) con algunas modificaciones. La linaza contiene glucósidos cianogénicos que son degradados a HCN por la hidrólisis ácida o enzimática aplicada en método, por tanto lo que se determina es el contenido de HCN equivalente. Se pesaron 2 g de muestra y se añadieron 40 ml de H2SO4 0,1M, se colocaron en el desintegrador de tejidos (Polytron modelo PT3100), por 2-3 min, para luego centrifugar a 3500 rpm por 15 min y separar el extracto. Se colocaron 2 ml de dicho extracto en un tubo de ensayo con tapa, y 2 ml de H2SO4 4M, en un baño de agua hirviente por 50 min. Se enfrió a temperatura ambiente y se añadieron 5 ml de NaOH 3,6M, se agitó suavemente y se dejó en reposo por 5-10 min. Se añadieron 7 ml de buffer citrato (pH 5,0), 1,0 ml del extracto preparado y 0,4 ml de solución de Cloramina-T al 0,5% (solución 0,5% p/v en agua destilada), se dejaron reposar a temperatura ambiente por 5 min, y se añadió 1,6 ml de reactivo de könig. Se agitaron los tubos y se dejaron reposar por 60 min para el desarrollo del color. Para preparar la curva patrón se disolvieron 37,5 mg de kCN previamente deshidratado (en estufa de convección por 2 h a 100 ºC), en NaOH 0,2M y se llevo a 500 mL y a partir de esa solución se preparó la curva de calibración. Se leyó la absorbancia en un espectrofotómetro (Spectronic Milton Roy modelo 21D) a 583 nm.
Actividad de agua (aw): se utilizó el equipo Aqua-Lab modelo CX-2 de la Decagón Devices Inc.
Color: se empleó el colorímetro HunterLab modelo Miniscan D-65 45/0 LAV, se registraron valores de L, a y b.
Estos dos últimos análisis se le practicaron a la semilla entera
Polifenoles totales: se utilizó el método de Folin-Ciocalteu (18,19, 20). Se utilizó ácido tánico como estándar.
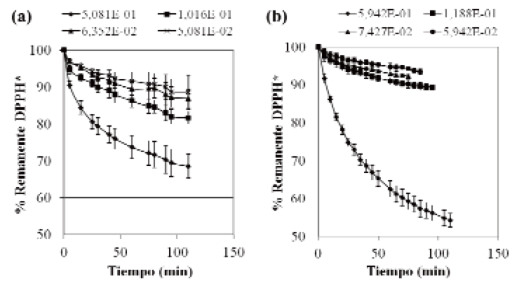
Capacidad antioxidante: se utilizó el método del radical DPPH* (2,2-difenil-1-picril-hidracil) (18). Se calculó la Eficiencia Antirradical (EA), la concentración de antioxidante necesario para disminuir la concentración inicial en 50%. (EC50) y el tiempo necesario para alcanzar la EC50 (TEC50). Los parámetros EC50 y TEC50 se obtuvieron a partir de las curvas de absorbancia vs concentración de DPPH, porcentaje remanente de DPPH vs concentración de muestra, y tiempo de reacción vs concentración de muestra.
Los análisis químicos y físicos se realizaron por triplicado y se expresaron en base seca como media y desviación estándar. El número de réplicas se fijó utilizando un parámetro establecido para d = 2,0, para que el error tipo II ( o probabilidad de aceptación de H0 siendo falsa) sea aproximadamente igual a 0,1. La comparación entre los 2 tipos de semilla se hizo mediante la prueba t de dos muestras independientes. Se determinó la normalidad de los datos utilizando la prueba de Anderson-Darling y la homogeneidad de varianza mediante el valor de F o del estadístico de Levene según sea el caso determinado por la normalidad. Se empleó el paquete estadístico StatgraphicsÒ Centurión XV versión 15.1.02 (StatPoint, Inc. 2006).
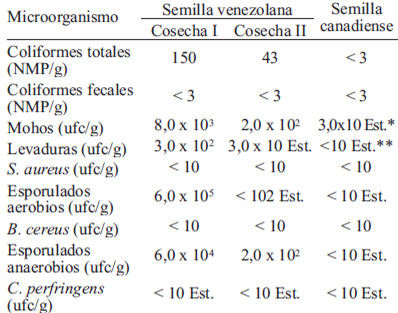
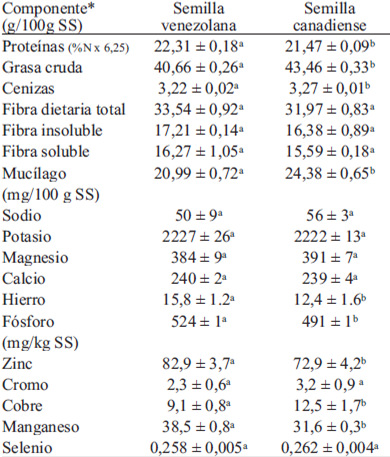
En la Tabla 1 se presentan los resultados del análisis microbiológico de las semillas de linaza; en la primera muestra de semilla venezolana analizada (primera cosecha), la carga microbiana fue alta, particularmente en microorganismos esporulados tanto aerobios como anaerobios. El análisis microscópico de las colonias indicó la presencia de 3 cepas morfológicamente diferenciadas de esporulados aerobios, una de ellas capaz de crecer también en condiciones anaerobias. Dos cepas fueron Gram positivas (incluyendo la cepa anaerobia facultativa), y la otra Gram negativa. Las pruebas para C. perfringens y B. cereus resultaron ser negativas. La elevada carga de esporulados de esa primera muestra condujo a la decisión de descartarla y tomar una nueva muestra (segunda cosecha), cuyos análisis indicaron una mejor calidad microbiana en lo referente a mohos, levaduras, esporulados aerobios y anaerobios (Tabla 1). Se evidenció solo una cepa Gram positiva, en incubación aeróbica y anaeróbica, con las mismas características morfológicas de la cepa facultativa detectada en la muestra de la primera cosecha, por lo que podría suponerse que se trata del mismo esporulado. En la Tabla 2 se presenta la composición química de las variedades de linaza venezolana y canadiense. Los principales constituyentes de las semillas fueron las grasas y fibra dietaria, aun cuando el contenido de proteína también es alto. Los valores se encuentran dentro de los rangos reportados por diferentes estudios previos para la variedad Norman (5, 21). Se observaron diferencias significativas entre la composición de los dos tipos de semilla, con excepción del contenido de fibra dietaria total, soluble e insoluble. La relación fibra soluble/insoluble es cercana a 1, lo cual refleja cantidades similares de ambos tipos de fibra. En cuanto a los minerales, destaca el alto contenido de potasio, calcio y magnesio en ambas semillas, con diferencias significativas en el contenido de hierro, fósforo, zinc, cobre y manganeso.
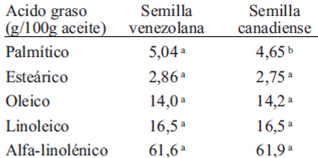
En la Tabla 3 se presenta el perfil de ácidos grasos de las semillas de linaza, sin diferencias significativas entre el contenido de ellos, a excepción del ácido palmítico cuyo aporte es mayor en la semilla canadiense. Es notable el elevado aporte de ácido alfa-linolénico (ALA), que supera el 60 % del total de los ácidos grasos, lo que justifica que la linaza se considere una fuente de este ácido graso esencial omega-3.
La Tabla 4 muestra el contenido de acido cianhídrico (HCN) equivalente y de polifenoles totales en la linaza canadiense y venezolana, sin diferencias significativas (p > 0,05) en el contenido de HCN equivalente de ambas variedades de semillas, con valores comparables con lo reportado para la linaza canadiense (40 mg/ 100 g) (22). Se detectaron diferencias significativas en el contenido de polifenoles totales, con un aporte mayor en la semilla venezolana. El método propuesto por Singleton y Rossi (23) para determinar los polifenoles contempla una extracción por etapas que permite obtener 3 fracciones claramente diferenciadas de polifenoles: (I) ácidos fenólicos y aldehídos, (II) esteres y polisacáridos, y (III) glicósidos fenólicos y taninos. La linaza canadiense contiene cantidades similares de las fracciones I y II (1172,06 y 1113,36 mg/100 g de linaza desgrasada, respectivamente). Por su parte, la semilla venezolana aporta principalmente polifenoles de la fracción II (1332,21 mg/100 g de linaza desgrasada). El aporte de glicósidos fenólicos y taninos es considerablemente menor para ambos tipos de semilla, siendo de 252,79 mg/100 g para la semilla canadiense y de 365,85 mg/100 g para la semilla venezolana.
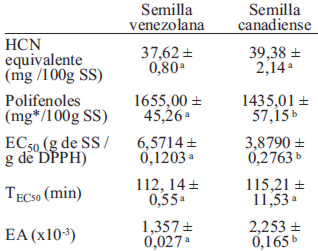
Los resultados obtenidos para las propiedades antioxidantes de la linaza canadiense y venezolana, expresadas mediante los parámetros EC50 (concentración de muestra necesaria para disminuir la concentración inicial del sustrato al 50 %), TEC50 (tiempo necesario para alcanzar el estado estacionario a la EC50), y Eficiencia Antiradical (EA) se presentan en la Tabla 4. Se observaron solo diferencias significativas (p < 0,05) entre la EC50 y la EA de ambas variedades de semillas.
En la Figura 1 se muestra el comportamiento cinético obtenido para el gráfico del porcentaje remanente de DPPH* (Y) vs tiempo de reacción (X). La variedad canadiense sigue un modelo multiplicativo: Y = aXb, donde a y b son constantes que representan al intercepto y a la pendiente, respectivamente. Por su parte, la variedad criolla presentó un comportamiento modelo raíz cuadrada de Y: Y = (a + bX)2. De acuerdo a la clasificación cinética realizada por Sánchez-Moreno et al. (18,19), basada en el TEC50, ambas semillas presentan un comportamiento lento (> 30 min).
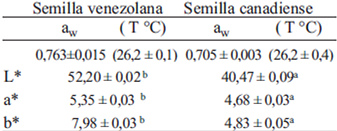
La actividad de agua (aw) y el color de las semillas de linaza se muestran en la Tabla 5. La semilla venezolana tiene mayor aw, lo cual permite tanto el crecimiento de algunas especies de hongos y la autooxidación lipídica por lo que requiere prevenir su contaminación y deterioro durante la cosecha y el secado. La determinación del color instrumental de la linaza indicó diferencias significativas entre los parámetros de las dos variedades de semillas.
La calidad microbiológica de la primera cosecha de linaza venezolana indica que la cosecha manual de la linaza venezolana, las condiciones de secado solar rudimentario y la mala manipulación postcosecha generaron la elevada carga microbiana de la primera cosecha (24). Basados en estos resultados se le dieron recomendaciones al productor a fin de que siguiera las buenas prácticas de fabricación agrícola (BPFA), y se generó una segunda cosecha con mejor calidad microbiológica que fue la muestra evaluada en el estudio. Contrariamente, la linaza canadiense mostró una carga microbiana acorde con lo esperado en semillas cosechadas mecánicamente, y correctamente secadas y manipuladas. Considerando que la linaza en Venezuela es consumida principalmente cruda, remojada en agua por algunas horas y/o sometida a leves tratamientos con calor, es necesario vigilar su calidad microbiológica para evitar poner en riesgo la salud del consumidor.
La semilla canadiense contiene más grasa y menos proteínas que la semilla venezolana, pero con pequeñas diferencias (Tabla 2). A menor temperatura del sitio de cultivo, menor es el contenido de proteína de la semilla y mayor es el porcentaje de grasa (5). Esto indica que quizás la temperatura promedio a la que fue cultivada la semilla canadiense es más baja que la temperatura de cultivo de la semilla venezolana. Al comparar la composición de 2 variedades de semillas, una de color pardo-rojiza y otra dorada, se observó que esta última tiene mayor porcentaje de proteínas y menor contenido de grasa que la primera (21), lo mismo se repitió en la semilla venezolana analizada. La variabilidad en la concentración de proteínas en la linaza también ha sido atribuida a factores genéticos y medioambientales (28). El contenido de proteína fue mayor en la semilla canadiense que en la semilla venezolana, al igual que el contenido de cenizas, concordando con lo reportado por otros autores (5, 21). Existe limitada información sobre la variación de la fibra dietaria entre variedades y cultivos de linaza, ya que no es un componente tan estudiado como la grasa o la proteína. Diversos autores (25, 26) señalan que las semillas de variedad dorada (como la semilla venezolana) tienen menor contenido de fibra que las pardorojizas (como la semilla canadiense analizada). Se determinaron diferencias significativas entre el contenido de mucílago de ambos tipos de semilla, siendo mayor el aporte en la semilla canadiense que en la semilla venezolana. El mucílago es un constituyente de la fibra (21) y una sobrestimación en el contenido de mucílago puede ocurrir considerando el método utilizado para su análisis. La agitación prolongada de las semillas por varias horas, indicado en la metodología, puede dañar la estructura de la semilla debido al roce y a la acción erosiva del agua, provocando la solubilización de otros componentes que se cuantifican como mucílago. Las semillas doradas tienen un menor contenido de mucílago que las semillas pardo-rojizas, lo cual se corresponde con lo determinado en este estudio. Los valores de minerales de las semillas de linaza se corresponden con lo reportado por Morris (21).
Las dos semillas analizadas poseen una mayor cantidad de ALA y menor cantidad de ácido oleico (Tabla 3) que lo reportado. La de origen canadiense contiene 57 % de ALA, 18 % de ácido oleico y 9 % de ácidos grasos saturados (21). El aceite de la linaza cosechada en Nueva Zelanda tiene entre 51,80 a 60,42 % de ALA, 22,21 % de ácido oleico y valores superiores al 9 % de ácidos grasos saturados (26). Los incrementos del contenido de ALA en el aceite de linaza van en detrimento del contenido de ácido oleico. Los niveles de insaturación de la grasa se afectan por la variedad de la semilla y las condiciones climáticas; los niveles de insaturación de la grasa son mayores en climas fríos. Los valores de ácido palmítico y esteárico en las variedades del presente estudio se corresponden con los reportados en la bibliografía (5). En el perfil obtenido para ambas variedades de linaza, el aporte de ácidos grasos saturados es menor al 8 %. El alto nivel de insaturación de los ácidos grasos en el aceite de linaza es una limitante para su vida útil. Sin embargo, estudios muestran que no hay cambios significativos en la concentración de ALA de la semilla, almacenada a 22 °C o tostada a 100 °C por una hora (26,28). Sin duda, mantener la semilla en refrigeración y protegida de la luz y el aire prolonga su vida útil (21).
El contenido de HCN equivalente en la semilla esta en el rango reportado (29) para la linaza canadiense (40 mg/ 100 g). Aubourg et al. (30) señalan que en el extracto acuoso de linaza están presentes diferentes tipos de glucósidos hidrosolubles, entre los cuales están la linamarina y la lotaustralina, ambos cianógenos. En países como Alemania, Estados Unidos, y el Reino Unido, el valor aceptado como límite de toxicidad del HCN equivalente es de 10 ppm (31).
Un adulto saludable puede llegar a detoxificar entre 30 y 100 mg/día de cianuro, sin embargo cuando se combina el consumo de glucósidos con alguna deficiencia nutricional, como por ejemplo un déficit de proteínas en la dieta, la habilidad del organismo de eliminar el cianuro se ve considerablemente comprometida (5, 31). En general, si se considera que el consumo diario de linaza en la alimentación humana es bajo, una persona sana tiene la capacidad de metabolizar el HCN producido a partir de los glucósidos cianogénicos presentes en la semilla sin riesgo de producir intoxicaciones.
Los valores obtenidos muestran que la semilla canadiense tiene mayor poder antioxidante que la semilla venezolana (Tabla 4), ambas variedades tienen una EA calificada como media y un TEC50 indicativo de un comportamiento lento (> 30 min) según lo establecido por Sánchez-Moreno et al. (18). Las propiedades antiradicales de la linaza se deben principalmente a la presencia de compuestos bioactivos con capacidad antioxidante como el lignano secoisolariciresinol diglucósido (SDG) y sus oligómeros, los ácidos fenólicos libres y glucosilados, y los flavonoides como el herbacetin diglucósido (32). La acción antioxidante de estos compuestos fenólicos en la semilla es mayor que la de la vitamina E (20). Estudios previos presentan una correlación positiva entre el contenido de polifenoles totales y la actividad antioxidante (33, 34, 35); sin embargo, la linaza venezolana tiene menor poder antiradical que la semilla canadiense aún cuando presenta el mayor contenido de polifenoles totales. El contenido de polifenoles no es el único factor influyente en la capacidad antioxidante de una muestra ya que hay otros compuestos bioactivos presentes, además del efecto intrínseco de la sinergia entre los componentes del alimento (19). La actividad antioxidante de los polifenoles varía según el método de ensayo utilizado, por lo cual se recomienda utilizar varios métodos para evaluarla (35).
El aw de la semilla canadiense es lo suficientemente bajo para inhibir el crecimiento bacteriano y el de la mayoría de las especies de mohos, lo cual ayuda a conservar su buena calidad microbiológica (Tabla 5). En términos generales, las oleaginosas tienen menor aw que los cereales (al mismo porcentaje de humedad y temperatura); esto se debe en parte al tipo de interacción del agua con los diferentes solutos que componen la matriz del alimento (36). A bajos valores de aw, la actividad enzimática se reduce, y quizás se retarda la producción de HCN. Con respecto al color, el valor L es mayor en la semilla venezolana, ya que su color es mas claro que la canadiense. Para los parámetros a y b, las coordenadas fueron positivas, lo que indica la presencia de tonalidades rojas y amarillas, respectivamente, con mayor intensidad en la semilla venezolana.
La composición química y la microbiología de las semillas variaron según su procedencia a excepción del contenido de fibra dietaria. En ambas variedades destacó el alto contenido de grasa, fibra dietaria, proteínas y minerales como potasio, magnesio y fósforo así como también un elevado contenido de ácido -linolénico (ALA). El contenido de polifenoles fue mayor en la linaza venezolana. La EA de las semillas se consideró como media y el TEC50 lento. No se observó relación entre el contenido de polifenoles y la capacidad antioxidante, lo que sugiere que otros compuestos presentes en la semilla, así como su sinergia, también contribuyen a dicha capacidad.
Los autores agradecen el financiamiento de este estudio al Decanato de Postgrado de la Universidad Simón Bolívar, Caracas, Venezuela.
Recibido: 03-03-2012
Aceptado: 13-06-2012