La historia familiar (HF) de Enfermedades Crónicas no Transmisibles (ECNT), aumentaría el riesgo de síndrome metabólico (SM). En Chile, el SM afecta al 27% de niños con sobrepeso, y la hiperglicemia de ayuno (HA) es el trastorno menos prevalente (4.0%). El objetivo fue estudiar la prevalencia del SM y de los factores de riesgo cardiovascular (FRCV) en niños con sobrepeso e HF de ECNT analizando su asociación con el número de parientes afectados y con la historia parental (HP). En 183 niños con IMC ≥p85 de 11,8 ± 1,8 años (86 varones) e HF (padres y/o abuelos) de ECNT, se evaluó el z IMC (CDC / NCHS), el perímetro de cintura, la presión arterial, la glicemia, la insulina, los triglicéridos y el colesterol-HDL. El SM y los FRCV fueron diagnosticados por el criterio de Cook y la insulinoresistencia (IR) por el HOMA-IR. Se utilizaron Chi2, ANOVA, t Student y Willcoxon. La HF de DM2, hipertensión arterial y dislipidemia fue de 81,4 %, 88,0 % y 71,6 % respectivamente. La prevalencia del SM fue de 46,5%, asociándose a la magnitud del sobrepeso y a la HP de ECNT. La prevalencia de hipertrigliceridemia y de hiperglicemia de ayuno fueron de 54,6% y 31,4% respectivamente. No hubo asociación entre el número de parientes con HF y el perfil cardiovascular y metabólico del niño. Se concluye, que la HF de ECNT, se asocia a una mayor prevalencia del SM, de dislipidemia y de hiperglicemia de ayuno que la observada en población general de niños con sobrepeso.
Palabras clave: Síndrome metabólico, riesgo cardiovascular, historia familiar de ECNT, obesidad.
Family history (FH+) of non transmisible chronic diseases (NTCD) increase MetS risk. In Chile, the MetS affects 27% of overweight children, and fasting hyperglycemia is very low prevalent (4,0%). The objective was to study the prevalence of MetS and the cardiovascular risk factors (CVRF) in overweight children with a family background of NTCD and analyze its association with the number of relatives witth NTCD and with parental history (PH). In 183 overweight children (BMI ≥p85) mean age 11,8 ± 1,8 (86 males) with a FH+ (parental or grandparental) of NTCD, were assessed the BMI z (CDC / NCHS), waist circumference, blood arterial pressure, fasting Glucose and Insulin (RIA), triglycerides, HDL chol. The MetS and the CVRF were diagnosed using the Cook phenotype and the insulin resistance (IR) through the HOMA-IR. Chi2, ANOVA, t Student and Willcoxon test were performed. The frequency of FH+ of DM2, hypertension and dyslipidemia were 81,4 %, 88,0 % and 71,6 % respectively. The MeTS prevalence was 46,5 % associated to overweight magnitude an parental history of NTCD. The prevalence of hypertriglyceridemia was 54,6%, while fasting hyperglycemia affected 31,4% of the sample. There was no association between number of relatives with NTCD and CV risk profile. We conclude that in overweight children with FH+ of NTCD, the prevalence of MetS, dyslipidemia and fasting hyperglycemia are significantly higher, than those observed in the general population of obese children.
Key words: Metabolic síndrome, cardiovascular risk, Familial history chronic diseases, obesity
Instituto de Nutrición y Tecnología de los Alimentos (INTA), Departamento de Nutrición y Escuela de Nutrición y Dietética y de la Facultad de Medicina. Universidad de Chile. Santiago, Chile
A nivel mundial, coincidiendo con las tendencias de la dieta y los estilos de vida de la población, hay un aumento progresivo de la obesidad y sus comorbilidades: diabetes mellitus tipo 2 (DM2), hipertensión arterial (HTA) e infarto agudo al miocardio (IAM) (1). La obesidad infantil, se asocia a un conjunto de factores de riesgo cardiovascular reconocidos como un síndrome metabólico (SM) que aumenta la predisposición a las enfermedades antes señaladas (2-5). Los seguimientos longitudinales permiten ponderar estos riesgos(4-6). El SM afecta a casi un tercio de los niños obesos y se asocia al depósito adiposo abdominal, a la mala condición física y a una predisposición genética a la insulino resistencia (IR) (7-9). En niños chilenos que consultan por sobrepeso, se ha encontrado una prevalencia de SM de 27%, siendo la hipertrigliceridemia el trastorno metabólico más prevalente (39%) y la hiperglicemia de ayuno el menos prevalente (4%) (7).
La historia familiar (HF) de DM2, aumenta el riesgo de obesidad, de IR y de hiperglicemia de ayuno en población infantil (10-12). De la misma forma, la HF de coronariopatía y de dislipidemia, aumenta el riesgo de dislipidemia y ateroesclerosis desde etapas tempranas de la vida (13,14). La Academia Americana de Pediatría (AAP), reconoce como la mejor estrategia para la prevención de las enfermedades crónicas no transmisibles (ECNT), la pesquisa y tratamiento temprano de los niños portadores del SM, ya que en ellos se concentra el mayor riesgo cardiovascular y metabólico, siendo la HF de DM2, dislipidemia, HTA y coronariopatía, uno de los elementos que recomiendan la pesquisa (15). El objetivo general de este trabajo, ha sido evaluar si la HF de ECNT (DM2, HTA, dislipidemia y/o IAM), es una variable asociada a un mayor riesgo cardiovascular y metabólico en niños con sobrepeso. Un objetivo específico fue evaluar la asociación entre el perfil cardiovascular y metabólico del niño con el número de familiares con historia positiva y otro, la influencia de la historia parental (HP) en la prevalencia del SM de sus hijos.
El estudio se realizó en 2 muestras de niños con sobrepeso (IMC ≥ p 85), de 8 a 15 años, de ambos sexos, seleccionados entre los años 2006 y 2008 en 4 establecimientos educacionales municipalizados de 2 comunas de Santiago de Chile para ser intervenidos con un protocolo integral de 4 meses el cual incluyó apoyo médico, nutricional, psicológico y con ejercicio físico. 73 niños fueron intervenidos en un centro de salud cercano a sus establecimiento (Proyecto “Canasta FONASA”) y 110 en sus establecimientos (Proyecto Domeyko “Disrupción de la homeostasis metabólica y cardiovascular asociada a la obesidad infantil”). Los criterios de inclusión para ambas muestras fueron los mismos: tener sobrepeso (IMC ≥ 85), estar cursando entre cuarto básico a segundo medio, antecedente de al menos un padre y/o abuelo con alguna ECNT (DM2, HTA, dislipidemia y/o coronariopatía) y el consentimiento de los padres y niños para participar en el estudio. Ambos, estudios fueron aprobados por el Comité de ética del INTA, de la Universidad de Chile.
Antropometría: El IMC, se calculó midiendo el peso y la talla con una balanza de precisión (SECA) con cartabón incluido de acuerdo a normas internacionales (metodología de Frankfurt). La magnitud del sobrepeso se calificó por el puntaje z del IMC (CDC/NCHS2000) como exceso de peso (entre ≥ +1 y < +2), obesidad leve (entre ≥ +2 y <+3), obesidad moderada (≥ + 3 y < +4) y obesidad severa (≥ + 4). El perímetro de la cintura (PC) se midió con cinta métrica no distensible de fijación automática (SECA) aplicada por sobre la cresta iliaca, diagnosticándose obesidad abdominal si era ≥ p90 de los referentes USA (16). El grado de pubertad se evaluó por los 5 estadios de Tanner (mama en la mujer y genital en el varón); la presión arterial diastólica (PAD) y sistólica (PAS) con un esfingomanómeto de mercurio con manguito “ad hoc” según metodología estandarizada por el “Second Task Force“ (17). Por encuesta “ad hoc” a la madre o tutor, se consignó el antecedente familiar de ECNT en padres, y/o abuelos.
Laboratorio.- Se extrajo en ayunas 10 ml de sangre venosa para medir la glicemia por método colorimétrico enzimático (GOD-PAP, Química Clínica Aplicada S.A.) y la insulinemia por radioinmunoanalisis (RIA Diagnostic Products Corporation). La resistencia insulínica basal se calculó a través del HOMA-IR (Insulina ayuno (uUI/mL) * Glicemia ayuno (mmol/L) / 22,5) (18). El perfil de colesterol (colesterol total, colesterol LDL, colesterol HDL, y triglicéridos) se evaluó mediante metodología analítica seca (Vitros, Johnson & Johnson, Clinical diagnostics Inc.). Los padres de los niños del Proyecto Domeyko fueron invitados a chequearse los niveles de colesterol y glicemia en ayunas y 63 aceptaron (56 madres).
Diagnostico del SM y de la IR.- El SM se confirmó con la presencia de 3 de los 5 componentes del fenotipo de Cook (PC ≥ p90, Pr. arterial ≥ p90, TG ≥ 110 mg/dl, HDL ≤ 40 mg/dl o glicemia de ayuno ≥ 100 mg/dl) (8). Se consideró IR si el HOMA-IR era ≥ 2,1 en (niños con Tanner 1-2) y ≥ 3,3 (niños con Tanner 3-5), de acuerdo a referentes nacionales (19).
Procesamiento y análisis estadístico de los datos.-Los datos se analizaron utilizando estadística descriptiva (mínimos, máximos y tablas de frecuencias) para todas las variables. En las variables continuas se realizó el test de bondad de ajuste de Shapiro Wilk y test de homogeneidad de varianza. Aquellas con distribución normal, se expresaron como promedio y desviación estándar, en caso contrario como mediana y percentilos 25 y 75. Se utilizó test de Student o el test de Wilcoxon para muestras independientes para comparaciones por sexo, ANOVA para comparaciones entre grupos y Chi2 para estudiar asociaciones entre variables.
El 100% de los niños tenía al menos un padre ó abuelo con una ECNT. El 81,4 % (149) presentó HF de DM2, el 88,0% (161) de hipertensión arterial, el 71,6 % (131) de dislipidemia y el 18,0 % (33) de infarto al miocardio.
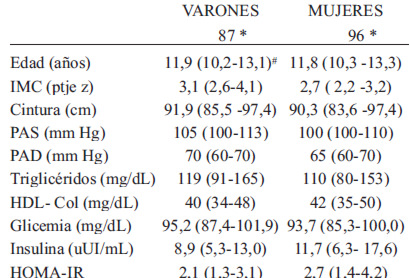
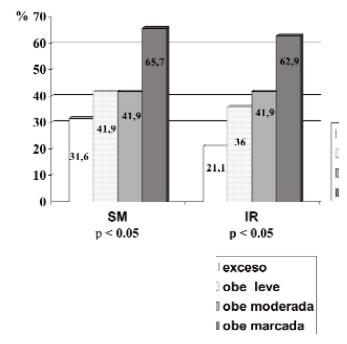
No hubo diferencias por sexo en las características antropométricas, metabólicas y cardiovasculares de la muestra (Tabla 1). El SM se presentó en el 46,5 % y la IR en el 41,6% de los niños asociándose ambos a la magnitud del sobrepeso (p < 0.05 y p< 0.025 respectivamente (Figura 1). La Figura 2 muestra la distribución de los FRCV en la muestra; se destacan la hipertrigliceridemia en el 54,6% de los niños, la hipocolesterolemia HDL en el 38,9% y la hiperglicemia de ayuno en 31,4%. Hubo 2 niños con glicemias ≥ 126 mg/dL.
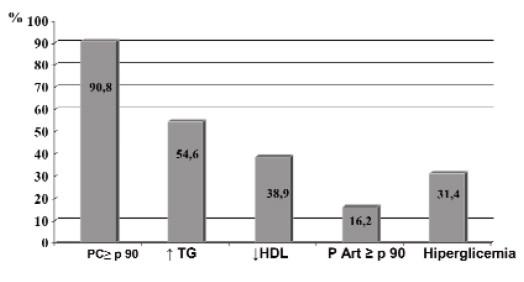
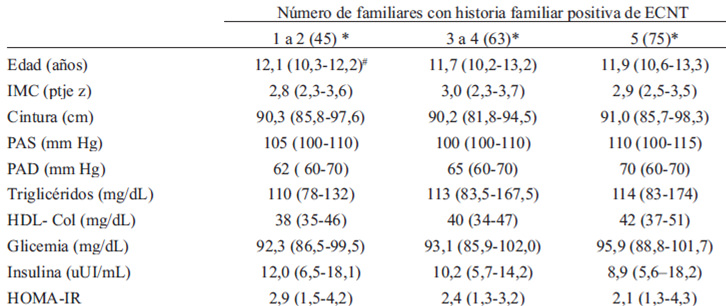
No hubo diferencias significativas en el perfil antropométrico y cardiovascular de los niños, según el número de familiares afectados por una ECNT (Tabla 2). Hubo una mayor prevalencia de SM (p < 0.05) en los niños con historia parental (HP) de ECNT (52,5%) comparados con aquellos cuyos padres no tienen el antecedente de una ECNT (39,1%) (Figura 3).
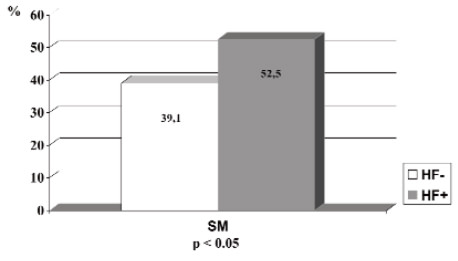
En escolares con exceso de peso e HF de ECNT, la prevalencia del SM alcanzó un 46,5% con una asociación directa y significativa con la magnitud del sobrepeso. Esta cifra duplica lo observado en otros estudios (2 nacionales y uno norteamericano) de niños con sobrepeso de similar edad y diagnosticados con el mismo criterio, pero, en los que la HF no fue un requisito de inclusión, donde la prevalencia de SM fluctuó entre 27 y 29% (7, 8,20). Por otro lado, la historia parental (HP) de ECNT se asoció a una mayor prevalencia de SM (52,5% en los con HP+ vs 39,1% en los sin HP), lo que refleja el mayor impacto del antecedente paterno que el de los abuelos sobre el riesgo cardiovascular y metabólico (10, 15,22).
En esta muestra, donde la HF de DM2 fue la más prevalente (80,5%), hubo 2 niños con DM2 asintomática (glicemia de ayuno ≥ 126 mg/dl) y la hiperglicemia de ayuno fue de un 31,4%, cifra también significativamente más alta que las observadas en los otros 3 estudios donde fluctuó entre 1,8% a 4,6% (7, 8, 20). Hay coincidencia en que la HF de DM2 aumenta el riesgo de intolerancia a la glucosa y de diabetes en la descendencia, especialmente cuando es parental (10, 11, 21, 22). En niños americanos hispánicos con sobrepeso e HF de DM2, la intolerancia a la glucosa afectó al 27%, sugiriendo un determinante genético familiar asociado a la susceptibilidad de daño de las células beta del páncreas más que a la IR (21). En nuestros niños, si bien la IR se asoció a la magnitud del sobrepeso, su prevalencia no fue más alta que la observada en los otros estudios nacionales, donde la hiperglicemia de ayuno fue muy poco prevalente, lo que estaría apoyando lo planteado por Cruz y cols (21). La Asociación Americana de Diabetes (ADA) señala que la HF es uno de los elementos que justifica el screening para diagnosticar la DM2 en población obesa menor de 18 años (15).
En esta muestra, donde la HF de dislipidemia alcanzó un 70,8%, la hipertrigliceridemia afectó al 54,6% de los niños, cifra también significativamente más alta que las observadas en otros estudios de niños con sobrepeso (39% y 28,7%) (7,8). Un estudio nacional (1996), mostró que los niños con HF de coronariopatía, tenían niveles de colesterol total, triglicéridos, y lipoproteína A, significativamente mayores a la de niños sin antecedente familiar (14). La AAP si bien modificó (2008) los puntos de corte para diagnosticar la dislipidemia, mantuvo la recomendación de realizar un screening de lípidos en todo niño con HF de coronariopatía y/o cuando uno de los padres tiene un colesterol total ≥ 240 mg/dL, independiente de su estado nutricional (13,15).
La falta de asociación entre el perfil cardiovascular y metabólico del niño y el número de familiares portadores de una ECNT podría tener varias explicaciones. El ambiente (dieta y actividad física entre otros) es un fuerte determinante en la variabilidad de la expresión genética de estas enfermedades. Por otro lado, en la mayoría de los casos sólo contamos con la información de quienes conocen ser portadores de alguna ECNT, desconociéndose la existencia de los falsos negativos y esto lo reconocemos como una debilidad del estudio. De 63 padres y madres de este estudio, que aceptaron hacerse una glicemia y un perfil de colesterol, hubo 8 (12,6%) que desconocían ser diabéticos (4) y/o tener hiperglicemia de ayuno (4) y 25 (39,7%) que desconocían tener una dislipidemia. Otra debilidad de este estudio, es la falta de un grupo control sin HF, lo que obligó a comparar a estos niños con el de otros estudios no dirigidos por HF que pueden diferir en variables étnicas, ambientales y familiares. Sin embargo, nuestros resultados coinciden con otros que incluyen diversos y diferentes grupos étnicos y utilizan distintas metodologías para el diagnóstico de la HF (10, 12, 14, 21, 23).
Si bien el Servicio de Prevención de USA (TASk Force) no ha logrado consensuar un criterio para diagnosticar el mayor riesgo biológico asociado al SM en población pediátrica, tanto la AAP como la Asociación Americana del Corazón utilizan la HF de diabetes y/o dislipidemia como uno de los factores para focalizar tanto la pesquisa de niños con alto riesgo biológico como las intervenciones (15,24). La OMS y la OECD (2008) desarrollaron un modelo para facilitar los estudios de costo beneficio de las intervenciones preventivas de las ECNT (1). Este, considera como factores de riesgo distales a la dieta (baja en fibra y alta en grasa) y al sedentarismo, como factor intermedio al peso corporal y como factores proximales a la presencia de HTA, dislipidemia e hiperglicemia de ayuno, pero no incluye la historia familiar.
Los resultados de este estudio, confirman la asociación de la HF de ECNT con un mayor riesgo cardiovascular y metabólico asociado al sobrepeso. De esta forma, la HF obligaría a un especial énfasis en la consejería a los padres sobre la promoción desde edades tempranas de hábitos y estilos de vida saludables en sus hijos. Aún cuando la HF puede contribuir a focalizar niños de mayor riesgo biológico, su ausencia, no podría ser utilizada para excluir niños obesos de un eventual screening o de una intervención. El desconocimiento por parte de la familia, especialmente de los padres, de si son portadores de una ECNT, contribuye a un porcentaje no despreciable de falsos negativos, lo que obliga a considerar además otros factores de riesgo como son la magnitud y distribución de la obesidad, la inactividad física, la presencia de síndrome de ovario poli quístico, y el tabaquismo entre otros.
Un especial reconocimiento a todos los niños del estudio y a sus padres, porque sin su participación no hubiera sido posible generar estos conocimientos.
Recibido: 21-11-2011
Aceptado: 22-06-2012