Los estudios sobre los efectos del envejecimiento en la fisiología y el metabolismo cada vez son más, uno de sus objetivos es contribuir a instrumentar programas para mejorar la calidad de vida y prevenir discapacidades en la vejez. Es de gran importancia mencionar que durante el envejecimiento se presenta una desaceleración natural del metabolismo, se produce una serie de cambios en la regulación de la energía, lo que contribuye a la pérdida de peso y grasa; estos cambios en la regulación de la ingesta calórica contribuyen en un aumento de la susceptibilidad al desequilibrio energético tanto positivo como negativo, lo cual va asociado a un deterioro en la salud. Sin embargo, el llegar a la vejez, no es una sentencia de muerte para el metabolismo, por el contrario, éste puede ser controlado mediante el mantenimiento de un estilo de vida activo, aunado a esto investigaciones han demostrado que el metabolismo puede ser regulado mediante el papel que desempeña un sistema de reloj sincronizado (ritmos biológicos), el cual a su vez es modulado por varias proteínas reguladoras; esta relación garantiza que las células funcionen correctamente y por tanto el mantenerse saludables. El objetivo de esta revisión es aportar información actualizada sobre la regulación metabolismo-energía y su relación con la gran variedad de componentes involucrados en el gasto energético que acompañan al envejecimiento; analizar la regulación de este sistema para mejorar la calidad de vida y mantener la salud en la vejez.
Palabras clave: Envejecimiento, gasto energético, factores reguladores del metabolismo, reloj biológico, ritmo circadiano.
Studies about the effects of aging in the physiology and metabolism are increasingly, one of its objectives is to help implement programs to improve the quality of life and prevent disability in elderly. It is relevant to mention that, during aging, there is a natural metabolic deceleration, a series of changes in the regulation of energy are produced, which contributes to loss of weight and fat; the changes in the regulation of caloric intake contribute to increase the susceptibility to energy imbalance both positive and negative, which is associated with a deterioration in health. However, to grow old, is not a death sentence for metabolism, on the other hand, it can be controlled by maintaining an active lifestyle, coupled with this, research has shown that the metabolism can be regulated by a synchronized clock (circadian rhythms), which is mediated by regulatory proteins, this relationship ensures the proper functioning of the cells and therefore good health. The aim of this review is to provide updated information on the energy- metabolism-regulation and its relationship with the great variety of components involved in energy expenditure that accompany aging, to analyze the regulation of this system to improve the quality of life and maintenance of health in old age.
Key words: Aging, energy expenditure, metabolism regulatory factors, biological clock, circadian rhythm.
Centro de Investigación Biomédica de Occidente, Instituto Mexicano del Seguro Social. Guadalajara, Jalisco. México. Centro Universitario de Ciencias de la Salud, Universidad de Guadalajara. Guadalajara, Jalisco. México. OPD Instituto Jalisciense de Cancerología. Guadalajara, Jalisco. México.
Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara. Guadalajara. Jalisco. México. Centro Universitario Enrique Díaz de León, Guadalajara, Jalisco. México.
Los estudios sobre los efectos del envejecimiento en la fisiología y el metabolismo son cada vez más, éstos contribuyen a instrumentar programas para mejorar la calidad de vida en los adultos mayores y prevenir la discapacidad a edades avanzadas. En este contexto, la comprensión de los cambios en la regulación de la ingesta calórica con la edad, así como la prevención de la pérdida de peso y grasa es un componente importante para mantener la salud en la vejez, ya que la pérdida de peso involuntaria aparece de manera desproporcionada en adultos y se asocia con una mayor mortalidad (1-6).
A principios del siglo 20 la esperanza de vida media al nacer en los países desarrollados para los hombres y las mujeres en conjunto se estimó en 50 años; 100 años después, la esperanza de vida media es superior a los 77 años y se prevé que aumente a un promedio de 85 años para el año 2025 (7); incluso, la mayoría de teorías de predicción sobre la esperanza de vida estiman que esta seguirá aumentando inclusive presentando una esperanza de vida de 105 años en el año 2065 (8). Este cambio se debe principalmente a la eficiencia de nuestros sistemas de salud pública (sistemas sanitarios: incluidos algunos países de Latinoamérica como México, Venezuela, Brasil, Argentina etc.) que ha dado como resultado el abatimiento de la mortalidad y por lo tanto, el promedio de vida media de las personas que se puedan clasificar como “ancianos” (60 años) se prolongará (9).
El porcentaje de la población con 60 años y más, ha aumentado del 2 al 4% en 1900 a más del 13% en algunos países de Latinoamérica, el problema actual es que muchos de estos países no poseen cobertura real y efectiva para esta población.
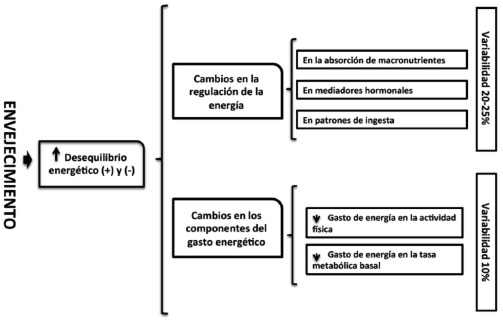
La edad avanzada se asocia con alteraciones en las respuestas de la ingesta. Las fluctuaciones del equilibrio en la sobrealimentación y la subalimentación son hoy en día un excelente objetivo para ser estudiado en forma sistemática (10). Muchas de las causas de la desregulación en la ingesta de alimentos durante el envejecimiento se desconocen, en gran parte debido a los mecanismos subyacentes a la propia regulación energética y esto es a cualquier edad. En el humano este, desde el punto de análisis bioquímico-metabólico-fisiológico hoy en día no se explica completamente, por ejemplo en los adultos jóvenes se acepta que existen múltiples mecanismos para regular el equilibrio de energía dentro de límites bastantes estrechos, (hambre y saciedad) y que éste está regulado tanto periféricamente como a nivel central (10-12). Hoy en día las tendencias seculares a la ganancia de peso alrededor del mundo (durante los últimos 30 años), han demostrado la ineficacia de estos mecanismos corporales de regulación; sin embargo, un consenso demostró que estos mecanismos de regulación de la energía suelen proteger a los niños y adultos jóvenes; sin embargo en la vejez, estos cambios puede tener múltiples explicaciones (anorexia del envejecimiento), así también es importante reconocer cuales son los factores involucrados en los mecanismos de regulación de energía (Figura 1). Esto implicará posteriormente que un número bastante grande de estos mecanismos podría verse afectado con la edad, en especial en la regulación de la ingesta; este aspecto es muy importante identificarlo y atenderlo tempranamente (13-15).
Durante la vejez la sensibilidad al sabor y aroma juegan un papel importante en la desregularización de energía; en particular, la mayoría de los estudios sugieren que la detección y reconocimiento del umbral de la sal y otros sabores específicos se ven afectados con la edad, en parte por el uso de medicamentos que impactan en el sabor pero también por la pérdida funcional del olfato y el gusto (16-17). No está bien documentado si la disminución en la sensibilidad del gusto y del olfato asociado a la edad puede desempeñar un papel en la desregulación de la energía (17). Los sentidos intactos del gusto y del olfato son necesarios para la fase cefálica de la digestión, esto incluye los aumentos iniciales en las secreciones salivares, estomacales, pancreáticas e intestinales que inician la digestión (13, 18). La fase cefálica del metabolismo postprandial se inicia por la estimulación olfativa, gustativa y cognitiva de los alimentos e incluye la activación de los sistemas nerviosos simpático y parasimpático, que a su vez inicia múltiples procesos relacionados con la digestión con el fin de la preparación del cuerpo a absorber nutrientes (12).
La estimulación cognitiva, visual y olfatoria puede ocasionar un incremento de salivación que va entre los rangos de un cuarto y un tercio de la necesaria para la masticación pero no deglución. Debido a que la saliva contiene enzimas digestivas, estas inician el desdoblamiento del almidón, el incremento de la producción de saliva por el consumo de la mayoría de los alimentos, puede acelerar la digestión y absorción de los carbohidratos (19).
La estimulación insípida tiene efectos mínimos en la secreción de ácidos gástricos y pancreáticos, mientras que las comidas apetitosas tienen mejores resultados en marcar la estimulación y secreción que promueve la digestión. Relacionada a esta observación la evidencia sugiere que lo aceptable-apetitoso puede influir en el rango de la absorción de nutrientes y en la eficiente interacción metabólica de la glucosa: Glucólisis-Glucogenólisis (10, 17). El consumo de comida insípida reduce la respuesta glucémica en comidas apetitosas con idéntica composición de macronutrientes, que sugiere que existe una reducción de rango de vaciamiento gástrico y por lo tanto menos digestión en las comidas insípidas. Se ha estudiado que hay diferencias entre la comida apetitosa y la comida insípida así como sus efectos en la circulación de la glucosa; Las comidas liquidas tienen diferentes efectos de saciedad comparados con los sólidos.
Si, la perdida de sabor y olor está asociada con el envejecimiento (16), se sabe tiene un efecto (comúnmente se reporta el hacer las comidas más blandas) que anticipa en la reducción del vaciado gástrico y por lo tanto el retraso en la absorción de los nutrientes, esto puede explicar el incremento de saciedad y la consecuente pérdida de hambre en edad avanzada (15). Consistente con estas situaciones los individuos en edad avanzada comen más porciones individuales (si tienen comprometido el sabor y el olfato), esto se relacionada significativamente con el hambre y el apetito: los individuos de edad avanzada tienen una reducida habilidad de reconocer porciones de comida en pruebas con los ojos vendados.
La saciedad se define como la sensación de plenitud de comer, lo que frecuentemente se altera en la vejez, varios estudios han documentado un hambre anormalmente baja después de la inducción experimental de ayuno o balance energético negativo en personas ancianas(15). El hambre antes de las comidas y el aumento de la saciedad postprandial son colaboradores independientes de regulación energética en la vejez, el aumento de la saciedad se asocia con el aumento de la superficie del antro estomacal y con una aparente distensión de este después del consumo de las comidas. Existe una reducción en la percepción de hambre y/o un aumento de la saciedad, lo que contribuye a la pérdida de peso en el envejecimiento (11).
La pérdida de peso y grasa en el adulto mayor se ve influenciado por los cambios en la regulación de la energía que se producen en forma normal, donde la capacidad para regular con precisión el consumo de energía se ve afectado. Para explicarse este cambio se acepta que influyen factores como: la tasa de retraso en la absorción de macronutrientes secundario a la reducción de la agudeza del gusto y el olfato; mediadores hormonales y metabólicos de regulación de la energía que cambian durante el envejecimiento, cambios en los patrones de ingesta alimentaria y una reducción en la variedad de los alimentos consumidos en la vejez que disminuye aun más el consumo de energía (20-21). Una variabilidad de la alimentaciónsobrealimentación en el día a día puede ser de hasta un 20-25% (Figura 1), Esta pérdida ha sido asociada también a deficiencias de micronutrientes, fragilidad, traumatismos derivados de caídas, retraso en la recuperación de heridas y mortalidad acelerada, esto se observa entre los 65 y 75 años, incluso en individuos sanos (3).
Los factores como el gasto de energía para la actividad física y la tasa metabólica basal se modifican sustancialmente durante el envejecimiento, la variabilidad en el gasto de energía por lo general es alrededor de un 10%; en conjunto, estos factores contribuyen con un aumento de la susceptibilidad al desequilibrio energético tanto positivo como negativo y esto se asocia con el deterioro de la salud (21).
Las alteraciones en la homeostasis de la glucosa en la tercera edad pueden contribuir a alterar el hambre y la saciedad, por una parte sabemos que la glucosa en la sangre ha sido postulada a ser un disparador de señales de hambre en humanos, estudios recientes en adultos jóvenes y en modelos animales vinculan transitoriamente pequeñas disminuciones de la glucosa en sangre al inicio del consumo de alimento (22); los alimentos con un alto índice glucémico, como el pan blanco, cereales y otros carbohidratos refinados (índice glucémico de 100-120) se utilizan como referencia con un valor fijado en 100 y que inducen hipoglucemia relativa de los 90 a los 120 minutos después del consumo de estos alimentos lo que condiciona a un retorno más rápido del hambre y un aumento en el consumo energético posterior (comer en exceso). La mayoría de los adultos jóvenes mantienen la glucosa circulante en el rango de 80-140 mg/dl a lo largo de ciclos de alimentación y ayuno a través de oscilaciones en las secreciones equilibradas de insulina y de hormonas contra-reguladoras que sirven para facilitar la absorción y síntesis y liberación de glucosa bajo diferentes condiciones metabólicas. Sin embargo cuando se produce la hipoglucemia esto provoca sensaciones de hambre, en contraste los adultos mayores, incluso saludables tienen una gama más amplia sobre el cual se mantiene la glucosa circulante y además se atenúa las respuestas contra-reguladoras y el retraso a la recuperación de la hipoglucemia (6, 22). Además de la insulina y la glucosa, el cortisol y el sulfato de dehidroepiandrosterona (DHEAS) se han asociado con la saciedad (23).
La elevación de los niveles circulantes de insulina (un 8% mayor que en adultos jóvenes) es típica de la sensibilidad a la insulina que ocurre en la vejez y que acompaña a los niveles altos de glucosa postprandial, esto contribuye a un retorno tardío del hambre, tal vez a través de un efecto de saciedad central y de los niveles altos de insulina o mediante la alteración de la sensibilidad central a otros componentes de la cascada de mecanismos que regulan la ingesta de alimentos tales como la colecistoquinina (CCK) y el neuropéptido Y (NPY); los niveles persistentemente elevados de glucosa postprandial así como de insulina pueden ser explicados por la reducción en el vaciado gástrico en la vejez (este es más lento), así el vaciamiento gástrico retardado extenderá el periodo de tiempo durante el cual los nutrientes aparecen en la circulación y esto propiciará una digestión más prolongada. Por otra parte esta no es la única explicación detrás el consumo de comida en las personas de edad avanzada; la captación tardía de la glucosa por el músculo y el hígado también proporcionan otra explicación. Al respecto se ha descrito también la deficiencia de la acción de la orexina, en particular de la señalización de su receptor 2, ya que altera los mecanismos de protección contra la resistencia a la insulina que se asocian con el envejecimiento, por lo que se sugiere que la orexina es un factor crucial para prevenir la resistencia a la insulina que acompaña al envejecimiento (24).
La mayoría de los estudios que examinan el vaciamiento gástrico en relación a la edad han reportado alteraciones en los ancianos, el retraso en el vaciado gástrico, en general se ha relacionado con la reducción del hambre y la saciedad mayor y por lo tanto potencialmente pueden contribuir a aumentar la saciedad y la disminución del hambre en los ancianos (11, 19). Varios modelos de regulación de la energía postulan un papel central para la disponibilidad de sustratos en la regulación de la energía, la glucosa en la sangre y el hambre apoyan el concepto del papel de que la baja concentración de glucosa en la sangre inicia las señales de hambre en los adultos jóvenes; el retardo en el vaciamiento gástrico presumiblemente se extiende desde el periodo durante el cual no solo la glucosa si no también otros sustratos de energía se absorben, además de influir en el hambre y la saciedad a través de la disponibilidad de nutrientes (22). Las alteraciones en el vaciamiento gástrico en la tercera edad presumiblemente también dan lugar a un prolongado periodo de distención del estómago lo que además podría prolongar la saciedad directamente a través de señales vagales aferentes, en los ancianos se sugiere que el aumento de la presión de las ondas fásicas pilóricas en respuesta a los nutrientes en el duodeno en conjunto con las alteraciones de la función del sistema nervioso autónomo (que es común en los ancianos) y una distención antral elevada son las causas subyacentes de retraso del vaciamiento gástrico (Figura 2).
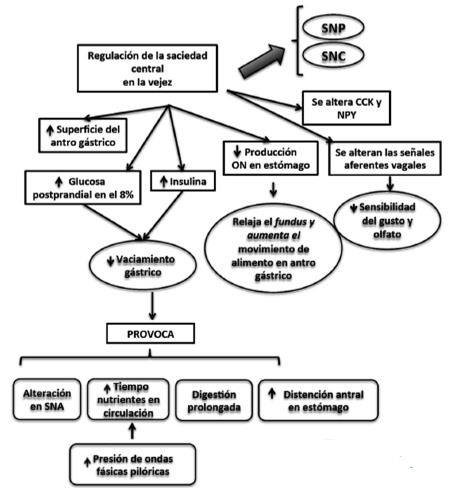
Se ha sugerido que una reducción en la producción de óxido nítrico por el estómago de los adultos mayores aumenta la saciedad por medio de un mecanismo que induce la reducción de la relajación del fundus y acelera el movimiento de los alimentos para el antro estomacal (11, 13, 19).
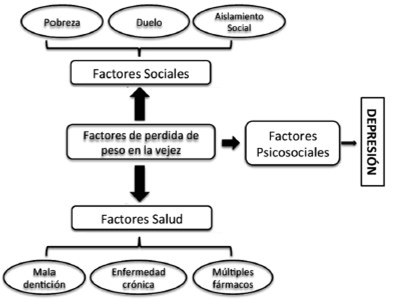
Muchos de los cambios en el envejecimiento (sociales y de salud) han sugerido múltiples causas para desarrollar una pérdida de peso, tales como: la pobreza, el duelo, el aislamiento social, la mala dentición, las enfermedades crónicas y el uso de múltiples medicamentos (21, 25).
Otro factor muy importante es la depresión ya que esta se ha sugerido como una causa de pérdida de peso entre las personas mayores. La depresión se asoció con la pérdida de peso solo en personas mayores de 55 años de edad y se asocia actualmente con el aumento de peso en los adultos jóvenes (20, 25). Una posible explicación para este hallazgo es que los factores psicosociales son catalizadores potenciales de la pérdida de peso solo cuando hay un deterioro subyacente en la regulación de la ingesta de alimentos (impide comer para expresarse). En cuanto al aislamiento social se sabe que se come menos cuando se come solo en comparación con las comidas en compañía, la diferencia en el consumo entre las dos situaciones es un importante 30%, en estos datos se sugieren que el consumo social es desfavorable ya que promueve la sobrealimentación y la obesidad (20-21), todo lo contrario que al comer solo, lo que puede conducir a la pérdida de peso. Esto es especialmente cierto cuando se considera que los seres humanos somos una especie de animal gregario y naturalmente comemos en grupos (sociales). Este dato es relevante en cuanto a la menor alimentación y además de baja calidad (rica en carbohidratos) en el envejecimiento, además el luto y la discapacidad funcional (sordera, miopía o hipermetropía, aislamiento social) limitan el contacto social (21). (Figura 3)
El mantenimiento del gradiente electroquímico de energía, los procesos de biosíntesis, procesos catabólicos y el transporte de moléculas son funciones básicas en todo el organismo mediadas por la tasa metabólica basal. Existe una estrecha relación entre una alteración en este gasto energético y el envejecimiento, hay una desaceleración natural del metabolismo con la edad, sin embargo, no es una sentencia de muerte para el metabolismo; por el contrario la mayor parte del metabolismo de una persona puede ser controlada mediante el mantenimiento de un estilo de vida activo; una persona puede mantener un cuerpo de manera eficiente (20).
Los sistemas orgánicos en los mamíferos están programados (por lo general) para un reloj de 24 horas, investigaciones han demostrado que este reloj regula los niveles de energía y por lo tanto el metabolismo. Varias proteínas que regulan el reloj y el metabolismo están relacionadas y dependen unas de otras (26).
La ingesta de alimentos, tanto en calidad como en cantidad, posee un gran peso. Actualmente, existe una intensa investigación en el área de la restricción calórica, lo cual puede explicar el hecho de por qué el síndrome metabólico, en presencia de una dieta hipercalórica, se asocia fuertemente al desarrollo de enfermedades degenerativas y a una disminución en la esperanza de vida. La restricción calórica, considerada como una disminución del 30-40% de una ingesta a demanda libre (27), ha demostrado un incremento en la esperanza de vida de hasta un 50% o más (estudio realizado en roedores) (28); esta respuesta se ha vinculado principalmente con dos moléculas: Las sirtuinas (particularmente, SIRT1), y la proteína TOR (“objetivo de Rapamicina”, por sus siglas en inglés).
Otro compuesto de interés es el resveratrol, un polifenol que se encuentra en el vino tinto y que tiene la propiedad de incrementar el AMPc y secundariamente, el NAD+, de manera tal que contribuye a la activación de SIRT1 y consecuentemente, a sus efectos.
Una de las proteínas involucradas en la regulación del metabolismo es la leptina, esta proteína funciona como un regulador de este reloj de 24 horas a través del control hormonal y debido a que leptina posee un ritmo de 24 horas y es responsable de establecer el calendario de otras hormonas (29), la regla N° 1 de la dieta de esta proteína es: no coma después de la cena; así mismo uno de los temas claves de la dieta de la leptina es: "comer es tan importante como lo que se come" (30). (Figura 4)
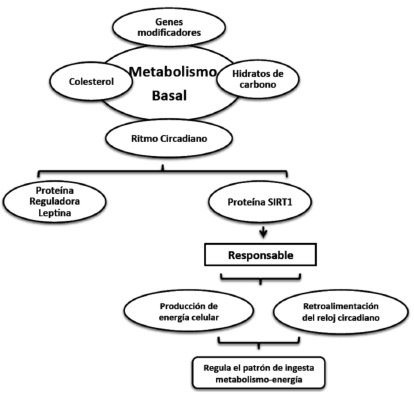
Nuestros ritmos circadianos y el metabolismo están íntimamente relacionados para garantizar que las células funcionen correctamente y así poder mantenerse saludables; esto da pauta a nuevos estudios para entender como estos dos procesos fundamentales pueden tener un gran impacto en los nuevos tratamientos para las enfermedades causadas por deficiencia de energía celular (Alzheimer, Parkinson, Diabetes etc.); por lo que es de gran relevancia el investigar qué genes modificadores se producen y como se relacionan con el metabolismo celular y la producción de energía.
TOR (proteína diana de la rapamicina) es una proteína cinasa sensible a los nutrientes que regula el crecimiento y metabolismo en todas las células eucariontas, se ha sugerido ser la responsable por la mayor parte de incremento en la esperanza de vida asociada a la restricción calórica (31-33). La influencia del subtipo de esta proteína en los mamíferos (mTOR), TORC1, influencia procesos celulares como la traducción del ARNm, autofagia, transcripción, metabolismo y supervivencia celular, proliferación, tamaño y crecimiento; lo cual la ha vinculado a ejercer una gran influencia en la esperanza de vida de los organismos, desde levaduras hasta mamíferos e incluso, humanos.
Las células eucariónticas utilizan la vía de señalización de TORC1 para adaptar la relación entre la cantidad y calidad de nutrientes que obtiene el organismo (el tamaño y crecimiento celulares), de manera tal que la supresión de aminoácidos actúa como un potente inhibidor de TORC1 incluso en presencia de factores de crecimiento, develando su relación con la nutrición (31).
El envejecimiento no se produce por acumulación de daño molecular, como antes se pensaba, sino como continuación del desarrollo celular. Es así, que tanto el crecimiento como el envejecimiento se ven estimulados por vías de señalización sensibles de nutrientes y mitógenos. Entre estas vías, se encuentra mTOR, la cual se encuentra también involucrada en el desarrollo del cáncer, puesto que su sobreactivación puede volver a las células normales en no respondedoras a factores de crecimiento. Así, el mTOR se considera un gerosupresor (inhibe procesos de senescencia celular) (34).
Las sirtuinas son una familia de deacetilasas dependientes de NAD+, lo cual permitió vincular su influencia en el envejecimiento al considerarlas sensibles a la dieta y metabolismo (28). Estudios realizados en ratones con fenotipos similares a la diabetes tipo 2, cáncer y la enfermedad de Alzheimer, han demostrado que la expresión de SIRT1 produce un incremento en la esperanza de vida y un envejecimiento saludable (35-36).
La proteína SIRT1 es clave en el reloj biológico (ritmos circadianos) esta se convierte en mensajes anti-envejecimiento del metabolismo llamado SIRT1; activa los principales pasos de la producción de energía en las células y retroalimenta directamente a este sistema de reloj circadiano, la activación de SIRT1 es una de las claves para regular el sistema metabólico durante el envejecimiento. (Figura 5)
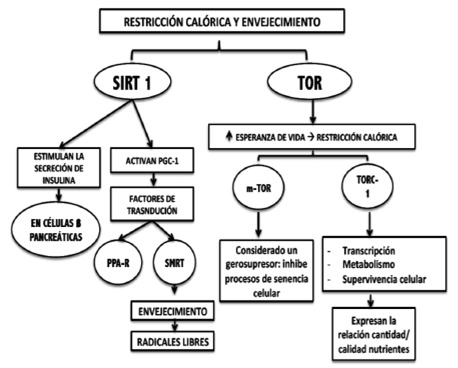
Los hidratos de carbono como combustible, inducen el metabolismo del colesterol, aumentan la beta oxidación de las grasas y modulan a que la insulina funcione correctamente; SIRT1 estimula la secreción de insulina por las células β del páncreas (28, 35). La regulación de este sistema induce a no comer en exceso y propone en los mamíferos un patrón de ingestametabolismo-energía lo más saludable posible.
La disfunción mitocondrial juega un papel importante en el envejecimiento y enfermedades relacionadas al envejecimiento, por lo que el mantenimiento de su función es benéfico en la prevención o retraso de enfermedades relacionadas.
Un regulador de la biogénesis mitocondrial, el PGC-1α (receptor co-activador proliferador de perixosomas-α), es una molécula central, que regula la función mitocondrial e influencia distintos aspectos del destino de las células y cuya función se encuentra afectada en el envejecimiento. Además, promueve la expresión de barredores de especies reactivas de oxígeno y por lo tanto previniendo neurodegeneración mediada por estrés oxidativo (37-38). La activación de SIRT1 induce un incremento en la actividad de PGC-1α. Es por ello que su modulación también podría ofrecer un potencial terapéutico en enfermedades relacionadas con el envejecimiento (38). Además, PGC-1 α activa la factores de transcripción, entre ellos, los PPAR (receptor activado-proliferación de peroxisomas). Uno de sus co-represores, el SMRT (receptor-silenciador mediador de la hormona tiroidea y retinoides) es una molécula que regula muchos factores de transcripción y que se ha visto implicada en la producción de radicales libres de oxígeno, por lo que se vinculado con el desarrollo del envejecimiento y los trastornos metabólicos relacionados (37).
Las causas aparentes de la desregulación en el metabolismo durante la vejez pueden asociarse a una alteración en la ingesta (hambre-saciedad), tanto los cambios en la regulación de la energía y factores de salud y psicosociales, considerados como catalizadores de la pérdida de peso, se asocia a una mayor mortalidad. Más sin embargo el metabolismo puede ser regulado mediante un estilo de vida activo y mediante proteínas claves de regulación de nuestros ritmos circadianos.
En humanos es deseable poner en un horario a nuestro organismo (garantizar de 7-8 horas de descanso), esto ayudará a sentir el cuerpo en una agradable sincronía, que literalmente se expresa de la siguiente manera: "la salud está asociada con la energía que se enciende cuando se debe, por la mañana, se metaboliza según las necesidades, durante el día, y se apaga correctamente en la noche". Hay una sensación inconfundible de un ritmo saludable cuando se hace esto.
Esto es un ángulo completamente nuevo en la gestión del tiempo. No se trata solo de hacer el mejor uso de su tiempo. Se trata de tener un sistema de reloj sincronizado correctamente a la luz del planeta tierra y los ciclos de oscuridad; cuando mejor lo haga, más energía se tendrá y mejor funcionara su metabolismo y más tiempo vivirá.
Recibido: 03-05-2012
Aceptado: 04-10-2012