Las frutas son consideradas fuentes de compuestos antioxidantes, cuyas propiedades pudieran desmejorar debido al procesamiento. El objetivo de esta investigación fue determinar el efecto del escaldado y la deshidratación osmótica sobre el contenido de polifenoles totales, taninos y la capacidad antioxidante de la ciruela criolla (Prunus domestica) en sus variedades amarilla y roja. La concentración de los polifenoles totales se determinó mediante el método Folin-Ciocalteu, los taninos por el método de la vanilina y la capacidad antioxidante por la eficiencia antirradical (EA) y el método de poder reductor férrico (FRP). El contenido de polifenoles totales y los taninos fueron mayores en la ciruela roja que en la amarilla. En las dos variedades, el mayor contenido de polifenoles se encontró en la pulpa, mientras que los taninos se encontraron en mayor proporción en las cáscaras. La ciruela roja presentó mayor capacidad antioxidante, siendo la EA baja y de cinética lenta para las dos variedades. Se observó una correlación lineal entre los polifenoles y los taninos con la eficiencia antirradical, sin embargo, con el poder reductor no hubo correlación. El escaldado incrementó el contenido de polifenoles, mientras que los taninos y la EA disminuyeron, el poder reductor no se vio afectado por los tratamientos. Para la deshidratación osmótica se obtuvo una disminución significativa de los taninos y la eficiencia antirradical, mientras que los polifenoles y el poder reductor no se vieron afectados por el procesamiento. Se recomienda el escaldado como alternativa de consumo y conservación en la ciruela criolla.
Palabras clave: Ciruela criolla, antioxidantes, polifenoles, Prunus domestica, taninos.
Fruits are considered sources of antioxidant compounds whose properties could impair due to processing. The objective of this work was to determine the effect of blanching and osmotic dehydration on the total polyphenols content, tannins and antioxidant capacity of plums (Prunus domestica) in yellow and red varieties. The total phenolic content in plums was determined according to the Folin-Ciocalteu assay and tannins were determined by vanillin assay. The antiradical efficiency (AE) and ferric reducing power (FRP) were used to estimate the total antioxidant capacity. The content of total polyphenols and tannins were higher in the red plum. The content of polyphenols in the pulp was higher that the peel while for tannins the opposite was observed in both varieties. The red plum had higher antioxidant capacity. The AE was low and slow kinetics for the two varieties. There was a linear correlation between polyphenols and tannins with antiradical efficiency; however, there was no correlation with the reducing power. The total polyphenols content was increased with blanching, while the tannins and the AE decreased, ferric reducing power is unaffected. For osmotic dehydration, the tannins and the AE were decreased, while the total polyphenols content and ferric reducing power are unaffected. It is recommended the blanched as an alternative to consumption and conservation in the plum.
Key words: Plum, antioxidants, polyphenols, Prunus domestica, tannins.
Departamento de Tecnología de Procesos Biológicos y Bioquímicos.
Universidad Simón Bolívar. Sartenejas, Baruta. Caracas, Venezuela.
La ciruela (Prunus domestica) es un fruto originario de la región tropical americana. Es un árbol pequeño, que pertenece a la familia de las Rosáceas y al género Prunus (1). En Venezuela, la ciruela criolla es una de las frutas de consumo común, por su disponibilidad, sabor y costo. Su fruto es una drupa, de forma redondeada y con semilla ovalada, que se caracteriza por una pulpa jugosa y un sabor agridulce. Se puede encontrar en cualquiera de sus dos variedades de color: la amarilla y la roja, cuando están maduras. La primera presenta ciertos toques rojizos en su cáscara y posee un sabor más ácido que la roja, aún después de ser procesada.
La ciruela es usada en diversos procesos industriales, que abarcan desde postres sencillos hasta salsas (2). La forma común de consumo de la ciruela criolla es como fruta fresca; sin embargo, en algunos estados de Venezuela se preparan dulces a base de ciruela, vinagretas y hasta vino. El procesamiento tecnológico de la fruta ofrece opciones de conservación para extender su vida útil.
Hoy día existe un gran interés en aquellos alimentos que posean la capacidad de inhibir procesos de oxidación, generados por radicales libres en el organismo (2). En la actualidad, el aumento en el consumo de frutas y vegetales ha sido asociado con la disminución de enfermedades crónico-degenerativas como obesidad, cáncer y aquellas relacionadas con el envejecimiento (1-4) y su acción benéfica ha sido asociada principalmente al potencial antioxidante por la presencia de compuestos bioactivos con capacidad antioxidante, como la vitamina C, E, β-caroteno, y una mezcla compleja de compuestos fenólicos (5). Los polifenoles, compuestos provenientes del metabolismo secundario de las plantas, se encuentran naturalmente en alimentos y bebidas de origen vegetal (6).
El contenido de compuestos antioxidantes en frutas y vegetales, depende también de la forma como ésta se consume, ya sea frescos o procesados (7). Kaur y Kappor (8), consideran que el tratamiento térmico es una de las principales causas del cambio en el contenido de antioxidantes naturales en los alimentos. Diferentes métodos de conservación de alimentos pueden ser responsables de un aumento o disminución de la acción antioxidante, y depende de varios factores, tales como estructura química, potencial de óxido- reducción, ubicación en la matriz y posibles interacciones con otros componentes de los alimentos.
El objetivo de esta investigación fue determinar el efecto del escaldado y la deshidratación osmótica sobre el contenido de polifenoles, taninos y la capacidad antioxidante de la ciruela criolla (Prunus domestica) en sus variedades amarilla y roja.
Las ciruelas criollas, en sus variedades amarilla y roja, fueron adquiridas en el comercio local. Se seleccionaron cien (100) ciruelas, para cada variedad amarilla y roja, y se dividieron en tres lotes. Para establecer el grado de madurez de las frutas, definido como el cociente entre el contenido de sólidos solubles y la acidez titulable de la fruta fresca, se determinó la acidez según la metodología COVENIN 1151-77 (9) y los sólidos solubles totales en °Brix mediante un refractómetro (Pocket Refracto Meter, USA) (escala de 0 – 32%), según 932.12 AOAC (10), con corrección por temperatura (20 °C).
El primer lote de frutas frescas fue pelado y despulpado. Las cáscaras y la pulpa fueron congeladas en bolsas herméticas. Una muestra de ciruela completa se homogeneizó y se congeló hasta su uso.
El segundo lote de ciruelas completas fue sometido a un proceso de escaldado, en un escaldador alimentado con vapor de agua a 100 °C, mediante una caldera (Chromalox, USA). El tiempo de residencia fue de 4 minutos. Una vez escaldadas fueron homogeneizadas y congeladas en bolsas herméticas.
El tercer lote fue escaldado, como en el punto 2, y sometido a deshidratación osmótica, como método de conservación. Dicho procedimiento se realizó tomando como referencia la normativa COVENIN para Frutas en Almíbar y al Natural (3031-93) (11) en cuanto a los sólidos solubles (ºBrix). Para esto, las frutas escaldadas fueron sumergidas completas en 600 mL de una solución de sacarosa (Merck, Alemania), con 65% de sólidos solubles, a una temperatura de 40 °C. Dicho medio funcionó como solución osmótica. Transcurridas 24 horas, las frutas se homogeneizaron y se congelaron.
Los lotes congelados fueron liofilizados (LABCONCO, USA), empacados al vacío y almacenados en un desecador hasta su análisis.
Se tomaron 500 mg de cada una de las partes de la ciruela completa, cáscara, pulpa y procesada, se suspendieron en 25 mL de metanol (Merck, Alemania)-agua (80:20 v/v acidificado con HCl 0,1%, Merck, Darmstadt, Alemania) y se agitó la suspensión por 1 h a temperatura ambiente. Se centrifugó a 1.800 g por 15 min, se decantó el metanol y se re-extrajo el residuo con 12,5 mL de metanol-agua (80:20 v/v acidificado con HCl 0,1%), se agitó por 1 h. Finalmente, se centrifugó nuevamente y se combinaron los extractos (12).
Se determinaron los polifenoles totales con el método de Folin-Ciocalteau (13) usando una curva patrón de ácido gálico (Sigma-Aldrich, Steinheim, Alemania) en un rango de concentración de 0,05 – 0,60 mg/mL. A una alícuota de 100 μL de extracto metanólico y solución estándar, se agregó 5 mL de reactivo de Folin-Ciocalteu (10%) (Merck, Darmstadt, Alemania), se dejó reposar por 8 min, luego se añadieron 3,5 mL de una solución de carbonato de sodio (0,12 g/mL), se agitó e incubó en un baño termostático (Jouan, Virginia, USA) a 40 ºC por 1 h. Se enfrió a temperatura ambiente y se realizó la lectura de absorbancia a 765 nm en un espectrofotómetro Génesis 6 (Thermo Scientific, USA). Los resultados se expresaron como equivalentes de ácido gálico en mg/100 g de muestra seca. El análisis se realizó por triplicado.
El contenido de taninos se determinó colorimétricamente, por la capacidad de los taninos para formar grupos funcionales que absorben en el rango del visible, cuantificando taninos condensados en presencia de taninos hidrolizables y otros polifenoles (14). La curva patrón se realizó con catequina (+) (Sigma-Aldrich, USA). En tubos de ensayo, 1 mL de cada extracto metanólico o estándar se mezcló con 5 mL de HCl:vanilina (Sigma, Alemania) (4%:0,5% en metanol) y se dejó desarrollar el color durante 20 min, en la oscuridad. Paralelamente, se prepararon los blancos de cada muestra mezclando 1 mL de cada extracto metanólico con 5 mL de metanol acidificado (HCl 4%, Merck, Darmstadt , Alemania) y se dejó desarrollar el color junto a las muestras, al resguardo de la luz. La absorbancia de los estándares y los blancos se midió en un espectrofotómetro Génesis 6 (Thermo Scientific, USA) a 500 nm.
Taninos(mg/100g)=[(Concentración(mg/mL)
*Volumen extracto(mL))/Peso de ciruela(g)]*100
La capacidad antioxidante se determinó mediante el método del radical DPPH* (1,1-difenil-2-picril- hidracil) (Sigma, Alemania) el cual se basa en la utilización del radical libre del DPPH* en solución metanólica al 0,025g/L (15). La reacción se realizó usando 3,9 mL de esta solución de DPPH y 0,1 mL de extracto metanólico a diferentes concentraciones. La absorbancia se leyó a 515 nm en un espectrofotómetro Génesis 6 (Thermo Scientific, USA) a intervalos de tiempo diferentes hasta que la reacción alcanzó un equilibrio. El análisis se hizo por triplicado. El porcentaje de DPPH* remanente fue calculado como sigue:
%DPPHREM=[(Abs515 muestra)/(Abs515 control)]x100
A partir del gráfico de este porcentaje versus la concentración de la muestra se obtiene el EC50 definido como la cantidad de muestra (g) necesarios para disminuir en un 50% la absorbancia. A valores mas bajos de EC50 mayor la actividad antioxidante. El tiempo necesario para alcanzar el equilibrio a la concentración de EC50 (TEC50) se calcula gráficamente. Como el EC50 y el TEC50 afectan la capacidad antirradical, se calcula la eficiencia antirradical (EA) que combina estos dos factores:
EA = 1/(EC50 x TEC50)
La actividad antioxidante fue medida utilizando el método del Poder Reductor Férrico (FRP) (16). A 50 μL de ciruela previamente desproteinizada con ácido tricloroacético 10% (Merck, Alemania), se le adicionaron 100 μL del reactivo FRP (1,5 mL de solución de FeCl3 (20 μmol/L) (Riedel De Haën, Hanover, Alemania), 1 mL de K3Fe(CN)6 (0,3 μmol/L) (Merck, Alemania) y 15 mL de tampón acetato (300 μmol/L), pH 3,6), se homogeneizaron y se dejaron en reposo durante 1 h a temperatura ambiente. Se midió la absorbancia contra un blanco de agua a 720 nm en un lector de microplacas modelo ELx800 (BioTek Instruments, EEUU). El FRP se expresa como la cantidad de hierro reducido (mmol Fe+2/100 g), utilizando como solución patrón al FeSO4 (250 – 1.000 mmol/L).
Todas las determinaciones se realizaron por triplicado y se expresaron los valores como los promedios ± la desviación estándar (DE). Se realizó un análisis de varianza con el fin de determinar el efecto del procesamiento sobre los parámetros medidos (α = 0,05) y para la validez de los resultados obtenidos se procedió a verificar los supuestos de normalidad, homogeneidad de varianza e independencia. En el caso donde no se cumplían los supuestos se utilizó Kruskal-Wallis. La prueba a posteriori utilizada fue la prueba de rango múltiple de Duncan. Para determinar diferencias entre las variedades se realizó una t-student con un nivel de confianza de α = 0,05 para cada uno de los parámetros.
Los resultados correspondientes al índice de madurez de la fruta, indican que ambas variedades se encontraban maduras, aún cuando la ciruela roja (índice de madurez: 36,30) se encontraba en una etapa de maduración más avanzada que la amarilla (índice de madurez: 20,95), según lo establecido en la Norma Técnica Colombiana para Frutos (17).
El potencial funcional de una fruta puede estar determinado por su poder antioxidante, el cual ha sido relacionado al contenido de polifenoles presentes en la misma. En la tabla 1 se muestra el contenido de polifenoles totales y de taninos en la ciruela criolla completa, cáscara y pulpa para las dos variedades. Los resultados obtenidos muestran que el contenido de polifenoles y taninos en la ciruela roja es mayor que en la ciruela amarilla (p<0,05); sin embargo, esta diferencia no es significativa para los polifenoles de la cáscara y los taninos de la fruta completa (p>0,05). Es de hacer notar que la pulpa de la fruta, en sus dos variedades, posee una mayor cantidad de compuestos fenólicos en comparación con la cáscara, lo contrario se observa con el contenido de taninos.

En la tabla 2 se muestra la capacidad antioxidante de la ciruela criolla completa, cáscara y pulpa, expresada mediante los parámetros EC50 (concentración de muestra necesaria para disminuir la concentración inicial del sustrato al 50%), TEC50 (tiempo necesario para alcanzar el estado estacionario a la EC50), Eficiencia Antirradical (EA) y poder reductor férrico (FRP) para ambas variedades. Se observa que la ciruela criolla roja posee mayor capacidad antioxidante que la amarilla (p<0,05), aunque no hay diferencias significativas para la eficiencia antirradical de la pulpa y el FRP para la cáscara (p>0,05). Sin embargo, el poder reductor no presenta diferencias significativas entre cada una de las partes de la fruta (p>0,05), aunque para la eficiencia antirradical sólo la pulpa de la ciruela roja presenta discrepancias con respecto a otras partes de la fruta, teniendo la menor capacidad antioxidante

Los valores obtenidos muestran que la ciruela criolla, para ambas variedades, tiene una EA considerada como baja (EA ≤ 1 x 10-3) y los componentes antioxidantes presentes en ésta muestran una cinética lenta (TEC50 > 30 min) de acuerdo a la clasificación previa con estándares (15).
En la Figura 1 se puede apreciar el efecto del proceso de escaldado y deshidratación osmótica sobre el contenido de polifenoles totales, los taninos, la eficiencia antirradical y el poder reductor. Para el proceso de escaldado se puede observar un aumento significativo del contenido de polifenoles, mientras se observa una disminución de los taninos y de la eficiencia antirradical para ambas variedades (p<0,05); el poder reductor no se afectó significativamente con este procesamiento (p>0,05).
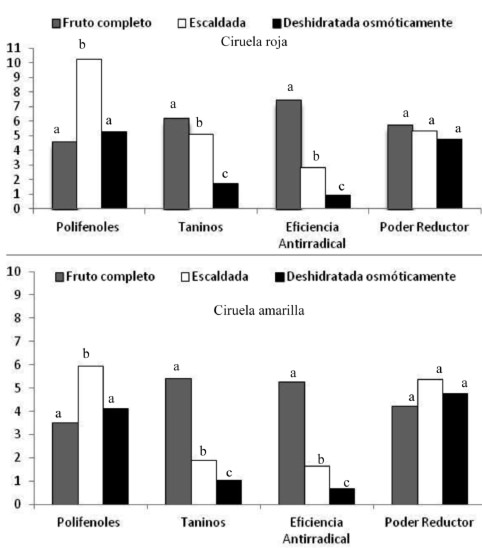
En las muestras que fueron tratadas con el proceso de deshidratación osmótica, posterior al proceso de escaldado, se observa una disminución significativa de los taninos y la eficiencia antirradical (p<0,05), mientras que los polifenoles y el poder reductor no muestran efecto alguno (p>0,05).
El estado de maduración de las frutas fue determinado debido a que este proceso implica una serie de reacciones bioquímicas, tales como la hidrólisis de almidón, la síntesis de carotenoides, polifenoles y compuestos volátiles. Esto conlleva a cambios en los compuestos fitoquímicos y de la capacidad antioxidante durante dicho proceso (18).
El contenido de polifenoles totales, los taninos y la actividad antioxidante varían notablemente dependiendo de la parte de la fruta y la variedad analizada. La comparación directa de los valores obtenidos en este estudio con los de otras investigaciones se hace difícil debido a las diferentes metodologías utilizadas, donde se tienen unidades, estándares y condiciones distintas.
El color de las frutas está altamente asociado a la cantidad de polifenoles y flavonoides. Las antocianinas son los compuestos responsables de la mayoría de los colores oscuros, como rojos, azules y violetas, estando en mayor cantidad en los frutos oscuros (1,8), coincidiendo con el mayor contenido de polifenoles totales y taninos de la ciruela roja comparada con la ciruela amarilla, observados en este trabajo.
La variabilidad del contenido de polifenoles totales y taninos en las diferentes partes de la fruta ha sido reportada por varios autores. Para el durazno (Prunus persica) y la guayaba (Psidium guajava L.) se ha encontrado un mayor contenido de polifenoles en la pulpa que la cáscara (3, 19). En manzanas, diversos autores reportan que el contenido de compuestos fenólicos totales es particularmente más alto en la cáscara de manzanas, que en la fruta entera y en la pulpa (20-23). En el túpiro (Solanum sessiliflorum Dunal) (24), se ha señalado el mismo comportamiento que en las manzanas. En este estudio se obtuvieron resultados contrarios para los polifenoles y los taninos, siendo mayor los polifenoles en la pulpa y los taninos en la cáscara, indicando esto que la naturaleza y la distribución de estos compuestos es diferente en la fruta.
Con respecto a la actividad antioxidante, la variedad roja presentó una mayor capacidad que la variedad amarilla, lo que podría estar relacionado con el mayor contenido de polifenoles. Para la fruta completa (variedad roja) se observó una correlación lineal entre el contenido de polifenoles y taninos con la EA (polifenoles vs EA, r2=0,81 y taninos vs EA, r2=0,93), siendo mayor la relación con los taninos, lo que indica que la actividad antioxidante en la fruta completa roja probablemente se deba principalmente a los taninos presentes en la misma. Sin embargo, no se obtuvo una correlación lineal entre el contenido de polifenoles y el poder reductor para ninguna de las variedades.
La ciruela contiene un gran número de compuestos polifenólicos, que pueden englobarse en el grupo de los derivados del ácido cinámico, clorogénico y neoclorogénico, antocianos, derivados de la cianidina y peonidina, flavonoles glicosilados derivados de la quercetina y flavan-3-oles derivados de la catequina (25). Si se compara la EC50 de algunos patrones expresados en (g/g DPPH), ácido gálico: 0,026 y ácido ascórbico: 0,076 (14), con los obtenidos para la ciruela, se puede decir que 1 g de fruta completa, de cáscara y pulpa de ciruela roja es equivalente al poder antioxidante de 0,85, 1,00 y 0,34 mg de ácido gálico, respectivamente y 2,49, 2,91 y 1,00 mg de ácido ascórbico, respectivamente. Para la ciruela amarilla, 1 g de fruta completa, de cáscara y pulpa es equivalente al poder antioxidante de 0,56, 0,74 y 0,26 mg de ácido gálico, y 1,64, 2,15 y 0,76 mg de ácido ascórbico.
La capacidad antioxidante de los alimentos depende de la forma como éste es consumido, sea de forma natural o procesado. Kaur y Kappor (8) consideran que el tratamiento térmico es la principal causa de la alteración del contenido de antioxidantes naturales presentes en alimentos. El procesamiento para la conservación de los alimentos pueden ser responsables tanto del aumento como de la disminución de la acción antioxidante, dependiendo de muchos factores, tales como: la estructura química, el potencial de óxido-reducción, la localización en la matriz y las posibles interacciones con otros alimentos. Se ha reportado que la deshidratación de ciruelas frescas degrada los componentes fenólicos, aproximadamente la mitad de los flavonoles y la mitad de los hidroxicinamatos se degradan después del procesamiento comercial, mientras que las antocianinas y los 3-flavanoles se degradan por completo. Sin embargo, el proceso de pasteurización del jugo de ciruela no produce efecto alguno en los compuestos fenólicos (1).
En este estudio, el escaldado presentó mejores resultados que la deshidratación osmótica para el contenido de polifenoles. En países como México, tratan al nopal (Opuntia spp.) con el método de escaldado para aumentar y conservar los polifenoles y otros compuestos relacionados con la capacidad antioxidante (26). La disminución observada en los taninos y la eficiencia antirradical, con el proceso de deshidratación osmótica, probablemente se deba a la pérdida de los compuestos al producirse el intercambio de agua por los azúcares que son suministrados en la solución de sacarosa, quedando éstos en la solución y no en la fruta. De los dos tratamientos aplicados, el proceso de escaldado representa la mejor alternativa de consumo y conservación en la ciruela criolla, aunque cabe resaltar la importancia del consumo de la fruta fresca completa, ya que presenta un mejor potencial antioxidante.
El efecto contrario que se obtuvo en la capacidad antioxidante con el procesamiento por los dos métodos utilizados, se debe a los diferentes mecanismos que estos evalúan, ya que el poder reductor esta basado en la actividad reductora del hierro III, mientras que el DPPH mide la transferencia de un átomo de hidrógeno entre un radical libre y un oxidante, por lo que es válido resaltar la importancia de utilizar varios métodos para evaluar la capacidad antioxidante de un alimento, puesto que cada uno de ellos evalúa un mecanismo diferente de protección.
La ciruela roja mostró mayor contenido de polifenoles y taninos, además de una mayor capacidad antioxidante que la variedad amarilla. La naturaleza y distribución de los compuestos polifenólicos es diferente en cada una de las partes de la fruta y depende de la variedad. El proceso de escaldado aumenta el contenido de polifenoles presentes en la ciruela, por lo que se recomienda dicho tratamiento como alternativa de consumo y conservación.
Recibido: 29-09-2012
Aceptado: 23-01-2013