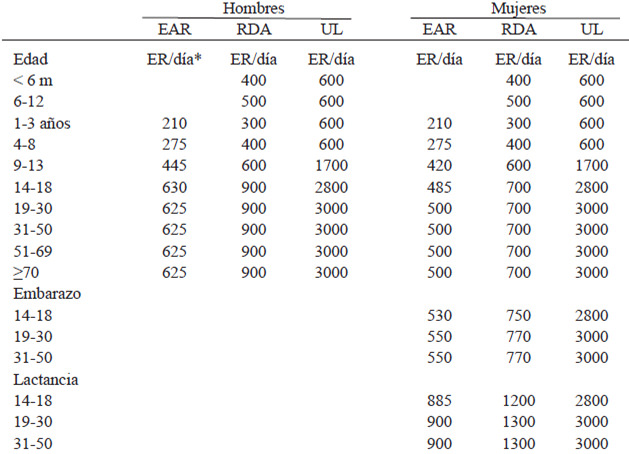
La deficiencia de vitamina A es uno de los problemas de salud pública mas prevalentes a nivel mundial, principalmente a los países menos desarrollados, afectando especialmente a mujeres y niños. La causa más común de deficiencia de vitamina A es la ingesta inadecuada, sobre todo en presencia de infección. Las consecuencias de la deficiencia son xeroftalmia, ceguera nocturna, anemia, mayor susceptibilidad a infecciones y el aun controversial aumento de la mortalidad neonatal. Los datos nacionales no son suficientes para establecer los requerimientos, por esto, igual que en la revisión del año 2000, las recomendaciones actuales se basan en las definidas para la población de Estados Unidos. La Ingesta Dietética Recomendada (RDA) para Venezuela es: menores de 1 año 400-500 ER/día, niños 300-400 ER/día, adolescentes 600 ER/día y para adultos 900 ER/día para hombres y 700 ER/día para mujeres, aumentando a 750 ER/día por embarazo y a 1200-1300 ER/día por lactancia, dependiendo de la edad. El Requerimiento Promedio Estimado (EAR) es 210 a 275 ER/día para niños, 445 ER/día para adolescentes varones, 420 ER/día para adolescentes hembras, 630 ER/día para hombres y 485 ER/día para mujeres, aumentando a 530-550 ER/día por el embarazo y a 885-900 ER/día durante la lactancia, dependiendo de la edad. Los Niveles de Ingesta Máximos Tolerables (UL) para vitamina A son 600 ER/día para niños, 1700 a 2800 ER/día para adolescentes y 3000 ER/día para adultos, hombres y mujeres.
Palabras clave: Vitamina A, retinol, Ingestas Dietéticas de Referencia, Ingesta Dietética Recomendada, Requerimiento Promedio Estimado, Niveles de Ingesta Máximos Tolerables, Venezuela.
Vitamin A deficiency is one of the most prevalent nutritional deficiencies worldwide, mainly affecting children and women. The cause of vitamin A deficiency is insufficient intake, especially in presence of infection and the consequences of the deficiency are xerophthalmia, night blindness, anemia, increased susceptibility to infections and the still controversial increase in infant mortality. National evidence at this point is insufficient to establish the recommendation, and as in the 2000 review of the Venezuelan RDAs, the actual recommendations are based on the reported for the United States population. The Recommended Dietary Allowances (RDA) for Venezuela are 400-500 RE/day for infants, 300-400 RE/day for children 600 RE/day for adolescents, 900 RE/day for men and 700 RE/day for women, increasing to 750 RE/day for pregnancy and to 1200-1300 RE/day during lactation, depending on the age. The estimated average requirement (EAR) is between 210 and 275 RE/day for children, 445 RE/day for male adolescents, 420 RE/day for female adolescents, 630 RE/day for men and 485 RE/day for women, increasing to 530-550 and 885-900 RE/day during pregnancy and lactation, respectively. The tolerable upper intake levels (UL) for vitamin A are 600 RE/day for children, 1700 a 2800 RE/day for adolescents and 3000 RE/day for adults, males and females.
Key words: Vitamin A, retinol, Recommended Dietary Allowance, Estimated Average Requirement, Adequate Intake, Tolerable Upper Intake Levels, Venezuela.
Instituto Venezolano de Investigaciones Científicas (IVIC). Centro de Medicina Experimental, Laboratorio de Fisiopatología. Caracas, Venezuela.
La vitamina A es un nutriente esencial para el crecimiento, mantenimiento de la función visual, regulación de la diferenciación de tejido epitelial y desarrollo embrionario. La vitamina A es también parte de las defensas del organismo contra los radicales libres. Su función como antioxidante incluye la captura de radicales como el singlete de oxígeno y grupos tiol y también se ha asociado a procesos que involucran expresión génica y de diferenciación celular (1,2).
La vitamina A se encuentra principalmente como retinol, retinal y ácido retinoico. Se almacena como retinol esterificado a ácidos grasos, principalmente como retinil palmitato. El retinal es la forma involucrada en la visión, formando parte de un pigmento llamado rodopsina y el ácido retinoico está involucrado en diferenciación y crecimiento celular. La formación enzimática de retinol y ácido retinoico a partir de retinol es reversible, aunque la oxidación de retinal a ácido retinoico no lo es (3).
La deficiencia de vitamina A es uno de los problemas de salud pública mas prevalentes a nivel mundial, principalmente a los países menos desarrollados, afectando especialmente a mujeres y niños. La causa más común de deficiencia de vitamina A, es la ingesta inadecuada, favorecida en ambientes socioeconómicos y ecológicos desfavorables. La presencia de infecciones, sobre todo a repetición y/o simultaneas, unidas a la ingesta inadecuada, agotan las reservas de vitamina A. Las consecuencias más comunes de deficiencia son xeroftalmia, ceguera nocturna, anemia, mayor susceptibilidad a infecciones y el aun controversial aumento de la mortalidad neonatal.
Los niveles plasmáticos de retinol se utilizan para estudiar el estatus de vitamina A, aunque se sabe que tiene un valor limitado debido a que estos niveles no se modifican hasta que las reservas hepáticas están casi agotadas y por lo tanto solo son útiles para documentar una deficiencia severa de vitamina A. Por esta razón el retinol sérico no es útil para evaluar la situación nutricional con respecto a la vitamina A en las personas, y puede que no responda a las intervenciones. Sin embargo, la distribución de los valores del retinol en suero en una población y la prevalencia de individuos con valores inferiores a un punto de corte determinado pueden aportar información importante sobre dicha situación a nivel poblacional, y reflejar la intensidad de la avitaminosis A como problema de salud pública, especialmente si se tiene en cuenta el grado de infección o de inflamación subyacente (4).
Para estudios de salud pública, concentraciones de retinol sérico por debajo de 0.70 umoles/L (o <20ug/dL) refleja niveles inadecuados de vitamina A en la población, y entre 0.70 y 1.05 umoles/L refleja deficiencia marginal (3). Debido al riesgo aumentado de mortalidad en poblaciones sin signos clínicos de avitaminosis, se clasifica la importancia para la salud pública como leve, moderada e intensa, cuando la prevalencia es 2-9, 10-19 y >20%, respectivamente (4). Se considera que el nivel sérico óptimo para que la vitamina A ejerza su función como antioxidante es > 80 ug/dl (2).
La principal fuente de vitamina A preformada es el hígado. También son buenas fuentes de vitamina A preformada (presente en alimentos de origen animal), la yema de huevo, leche completa, mantequilla y queso.
La vitamina A puede obtenerse de alimentos de origen vegetal a partir de precursores conocidos como carotenoides con actividad pro-vitamina A. Algunos alimentos ricos en carotenoides incluyen: zanahorias, vegetales de hojas verdes y amarillas (espinaca y brócoli), auyama, melocotones, melón (5).
En el caso de los niños, la lactancia constituye la única fuente de alimento durante los primeros meses de vida, en un período cuando las demandas de energía y micronutrientes son elevadas. La concentración de retinol en leche materna es de 0,6 mg/L aproximadamente, determinado en mujeres bien nutridas y que no recibieron suplementación alguna. Esta cantidad provee al infante con unos 450 equivalentes de retinol por día (6).
El carotenoide más abundante y el más estudiado es el β-caroteno, que se convierte en retinol en el organismo y que puede, potencialmente, ser escindido en 2 moléculas de retinol por molécula de beta-caroteno.
La eficiencia de conversión de carotenoides en retinol es muy variable y depende del carotenoide estudiado y de factores como la presencia y absorción de grasa en la dieta, la matriz del los alimentos, el método de preparación, la cantidad de vitamina A preformada presente en la dieta y más recientemente, del genotipo (1).
Estudios con isotopos estables muestran que los factores de conversión de carotenoides, especialmente β-caroteno a retinol, varían de 3.6:1 a 28:1, por peso, reportando grandes variaciones no solo entre estudios, sino en individuos dentro de un mismo estudio (7,8). Algunos muestran que la conversión de β- caroteno a vitamina A (administrado en aceite como suplemento), varía de 2:1 hasta 16:1. En forma de alimentos, la conversión es de 12:1 en frutas y de 24:1 en verduras. Debido a las grandes variaciones entre individuos, a los cambios en el tiempo después de la absorción y al carotenoide en consideración, resulta difícil establecer un factor de conversión para la población aunque parece ser mayor del inicialmente establecido de 6:1, para acercarse al propuesto en 2001 de 12:1 (9-12). El comité de expertos de la FAO/WHO en 2004, estableció como factores de conversión de β-caroteno: vitamina A 6:1 y para otros carotenoides: vitamina A 12:1 (13).
La investigación en este campo todavía continua y aparentemente la eficiencia de conversión no es tan alta como se pensaba. El factor de conversión actualmente más usado es el propuesto por el Institute of Medicine de los Estados Unidos, que sugiere un valor de conversión de 12:1 por peso, pero que debe ser tomado como un valor referencial y temporal, mientras se generan más datos (1,14).
Se ha detectado la presencia de la enzima responsable de la conversión (β-caroteno monooxigenasa 1) en otros tejidos. Este hallazgo de que la conversión en vitamina A a partir de β-caroteno puede ocurrir fuera del intestino, ha generado gran interés investigativo por las implicaciones de generar vitamina A en otros tejidos (11).
Debido a su almacenamiento hepático como ésteres de retinilo, ingestas aumentadas de vitamina A por periodos prolongados, pueden exceder la capacidad de almacenamiento hepático y producir daño al hígado, alteraciones en huesos y articulaciones, aumento de la presión intracraneal, perdida del cabello, mareos, vómitos y descamación de la piel (15). El desarrollo fetal normal requiere vitamina A, pero el consumo excesivo durante el embarazo, a través de la dieta o como suplementos, puede causar malformaciones en el recién nacido. Sin embargo, el consumo elevado de carotenoides no se reporta que sea teratogénico o produzca efectos adversos o signos de hipervitaminosis A (11).
Como se señala en la Tabla 1, el límite superior tolerable para vitamina A es de 3000 ER/día en adultos y 600 ER/día en niños. Además ingestas prolongadas de vitamina A preformada superiores a 1500 ug/día, se han asociado con riesgo aumentado de fracturas y disminución de la densidad mineral ósea en adultos mayores (16).
Se ha reportado disminución en la absorción de vitamina A, carotenoides y en general de vitaminas liposolubles por el uso de orlistat y también riesgo de hipervitaminosis A por el uso de retinoides en el tratamiento de afecciones de la piel (17).
Las estimaciones de prevalencia de deficiencia de vitamina A de la Organización Mundial de la Salud para el periodo 1995-2005, indican que en preescolares, la carencia de vitamina A representa un problema de salud pública importante en 45 países si se mide por la prevalencia de la ceguera nocturna, y en 122 si se mide por la carencia bioquímica de vitamina A (retinol sérico < 0,70 μmol/l).
Se calcula que la ceguera nocturna afecta a 5,2 millones de preescolares y a 9,8 millones de embarazadas a nivel mundial, lo que corresponde al 0,9% y al 7,8% de la población en riesgo de carencia de vitamina A, respectivamente. Se calcula que en todo el mundo presentan concentración sérica de retinol baja (< 0,70 μmol/l) 190 millones de niños en edad preescolar y 19,1 millones de embarazadas. Esto corresponde al 33,3% de la población en edad preescolar y al 15,3% de las embarazadas en poblaciones en riesgo de carencia de vitamina A, siendo las regiones de África y Asia Sudoriental las más afectadas (18).
En general se considera que la deficiencia de vitamina A no constituye un problema de salud pública en países desarrollados, aunque la deficiencia subclínica no ha sido evaluada en poblaciones de menores recursos de la mayoría de estos países. En los países menos desarrollados, la deficiencia de vitamina A es la causa más importante de ceguera y contribuye significativamente, incluso en casos de deficiencia subclínica, a la morbilidad y mortalidad por infecciones comunes de la infancia.
El aporte diario de vitamina A en países desarrollados proviene en un 30% de frutas y verduras (precursores de vitamina A) y en un 70% de alimentos de origen animal, como vitamina A preformada. La relación es exactamente la opuesta en países en vías de desarrollo: el 70% proviene de alimentos vegetales y el 30% de alimentos de origen animal (1).
Las hojas de balance de alimentos para el año 2007, muestran un promedio de disponibilidad per cápita de 1031,8 mcg-eqv y de 1138.7 para 2010 (19). En un estudio realizado por la Fundación Bengoa para Salud y Nutrición en base al análisis de las encuestas de seguimiento al consumo durante los años 2003 a 2010 (20), el consumo de vitamina A ha fluctuado entre 1210.3 y 1658.9 ER/persona/día en los años estudiados.
El Sistema de Información en Nutrición de Vitaminas y Minerales del la Organización Mundial de la Salud (VMNIS, por sus siglas en ingles), muestra en estudios puntuales reportados en su base de datos global para deficiencia de vitamina A, que en Venezuela la deficiencia de vitamina A, medida por retinol sérico, varia en diferentes grupos de edad entre 14 y 26%.
Un paso importante en el control y prevención de la deficiencia de vitamina A en Venezuela ha sido la fortificación de la harina de maíz con retinol y hierro (9.500 IU de vitamina A y 50 mg de hierro por kilogramo de harina). La harina de maíz usada para la preparación de las arepas, alimento de consumo masivo, es un vehículo ideal. Se ha estimado que la fortificación incrementa el consumo de vitamina A en los grupos económicamente más pobres en por lo menos un 20% (21).
Existe una importante cantidad de trabajos de investigación en vitamina A durante el periodo 2000-2013. La mayoría reportan la prevalencia de deficiencia en grupos vulnerables como los niños y las embarazadas, otros son estudios de evaluación del consumo y algunos exploran otras propiedades de la vitamina A como su papel en la respuesta inmunitaria o sobre la absorción de hierro.
Un estudio de prevalencia de deficiencia de vitamina A en 157 niños de 2-6 años provenientes de barrios marginales urbanos y rurales de Maracaibo no detectó signos clínicos ni oftalmológicos de deficiencia de vitamina A. La prevalencia de déficit sub-clínico de vitamina A, detectada por citología de impresión conjuntival anormal, fue de 35.4%, siendo más alta en el área rural (48.3%) (22). Al año siguiente, en infantes y niños de 24 a 85 meses de edad de tres barrios marginales urbanos del Estado Zulia, la prevalencia fue de 22,2%, mostrando que la deficiencia se presentó tanto en niños malnutridos como en los adecuadamente nutridos en términos de proteínas y calorías (23).
En Caracas en 2005, la prevalencia de deficiencia de vitamina A en un grupo de niños menores de 10 años fue de aproximadamente 10% en desnutridos y eutróficos, la prueba de citología de impresión conjuntival discriminó una proporción de deficientes superior a 25% y la prueba de dosis respuesta relativa mostró una prevalencia significativamente menor en eutróficos. Se detecto asimismo un consumo inadecuado de macro y micronutrientes (24). Ese mismo grupo de investigadores ya había reportado en el año 2001 en la misma población, que existía un problema leve de deficiencia subclínica de vitamina A, que era similar para desnutridos moderados y eutróficos (25).
La concentración de retinol sérico reportada para 85 preescolares sanos de una comunidad rural del Estado Mérida en 1999, fue de 0.3 +/- 0.15 mg/L (26), mientras que la prevalencia de deficiencia de vitamina A en una población rural de 104 niños entre 1 y 14 años del Estado Lara fue de 84,54% (27). Datos obtenidos en Valencia, Estado Carabobo en niños menores de 15 años (590) que fueron estudiados para determinar el status de vitamina A por diferentes métodos, muestran que de acuerdo a los criterios del IVACG (Iron and vitamin A Consultative Group) el riesgo de deficiencia severa, moderada y leve de la muestra fue 0.6, 8.8 y 90.6 %. La prevalencia de deficiencia usando la concentración de retinol sérico fue 0.7% mientras que si el diagnostico se hacía por citología de impresión cojuntival, la prevalencia era de 11.1% (28).
Debido a la asociación entre la trisomia del cromosoma 21 y la susceptibilidad a deficiencia de vitamina A, se estudió la prevalencia de deficiencia de vitamina A en 38 niños con síndrome de Down encontrándose una prevalencia de 18.4% y de 4% en controles, concluyendo que podría representar un problema de salud publica en estos individuos (29).
Un grupo de 240 mujeres adolescentes evaluado en el Estado Zulia en 2010, mostro una prevalencia de deficiencia de vitamina A menor al 2%, con un riesgo de deficiencia menor al 4%, tanto en zonas rurales como urbanas (30), mientras que el estudio del perfil de alimentación de 243 mujeres de 12 a 45 años de un municipio del Estado Lara mostró deficiencia importante en la adecuación de consumo de varios nutrientes, entre ellos de vitamina A, con una adecuación de 72.8 % para adolescentes y de 86.9% para adultas (31).
Un estudio de perfiles de vitaminas y lípidos de 241 adultos entre 35 y 50 años de Caracas, no mostró deficiencia de vitamina A en el grupo (32) mientras se reportó 8% de prevalencia de deficiencia en ancianos institucionalizados de Valencia (33) y un bajo consumo de vitamina A en un grupo de 94 ancianos no institucionalizados del Estado Zulia (34).
Estos estudios, principalmente los reportados en niños, muestran una variación en los niveles de prevalencia de deficiencia y en la severidad de la misma, mostrando grupos o áreas geográficas donde la deficiencia parece no ser un problema a otras con alta prevalencia de deficiencia.
El caso de las embarazadas merece especial mención, debido a las necesidades durante el embarazo, a las consecuencias de la deficiencia pero también debido a los daños en caso de exceso. Un estudio de prevalencia de deficiencia en 75 adolescentes embarazadas no mostro deficiencia de vitamina A, aunque 30% de los casos presentó niveles marginales de retinol sérico y un mayor riesgo de deficiencia de vitamina A durante el tercer trimestre (35). En ese mismo año y en la misma región, el análisis del consumo de un grupo de 75 embarazadas adolescentes mostró aumento en el consumo de vitamina A, especialmente durante el segundo y tercer trimestres (36), mientras que otro estudio mostró que el consumo en adolescentes embarazadas durante el primer trimestre fue menor a 2/3 de la recomendación en 36.6% de los 215 casos estudiados (37).
Más recientemente un estudio transversal, descriptivo y controlado en 235 adolescentes, 75 no gestantes y 160 gestantes, para determinar el estado nutricional de vitamina A (ENVA), el retinol sérico y la citología de impresión conjuntival (CIC), mostró una alta prevalencia de CIC anormal (37,5% vs 48%; p>0,05) y afectación del ENVA (41,24% vs 13,34%; p=0,0001) en gestantes y no gestantes; significativamente mayor durante el segundo y tercer trimestre de gestación (p<0,0002), además de la disminución significativa de los valores de retinol sérico (38).
El consumo de vitamina A de la población general, evaluado principalmente a través de recordatorios de 24 horas, resultó adecuado en la mayoría de los estudios revisados. La principal fuente de vitamina A en estas poblaciones proviene del consumo de harina de maíz fortificada. Se ha calculado que en preescolares el aporte adicional de hierro y vitamina A a través del consumo de harina de maíz precocida fortificada es de 38 y 10 %, respectivamente (39). En 2004 el estudio de 408 preescolares de bajo nivel socioeconómico de Valencia, mostró riesgo de consumo excesivo de vitamina A en este grupo (40). En un estudio de consumo en 438 niños entre 4 y 14 años de una comunidad pobre del mismo Estado, se encontró un consumo adecuado de vitamina A especialmente en el grupo de preescolares (41). De igual forma la evaluación del consumo de alimentos de un grupo de preescolares que asisten a un jardín de infancia público en Valencia, mostró un consumo adecuado de energía y hierro, con consumo excesivo de proteínas y vitamina A (42).
El papel de la vitamina A en la producción de citocinas en diferentes grupos de edad, ha sido evaluado en una serie de estudios. En 138 niños de 4-7 años provenientes de barrios marginales de Maracaibo, se encontró que los niños deficientes de vitamina A presentaron valores de IL-10 disminuidos con respecto a los no deficientes y no se observó efecto sobre IL-4, IL-2 e interferón gamma (43). Asimismo se estudiaron 73 mujeres adolescentes encontrándose deficiencia de vitamina A en 6.85% de los casos y riesgo de deficiencia en 41.1%. Los niveles bajos de retinol se correlacionaron con altos niveles de interferón gamma (44). En contraste, un estudio realizado en niños pobres no infectados, de ambos sexos de 45 a 77 meses de edad mostró que tenían altas prevalencia de anemia (75.5%) y de deficiencia de vitamina A (50.94%) y que en esos casos la concentración de interferón y de IL-10 estaba significativamente reducida con respecto a los niños no deficientes (45).
En un estudio para evaluar la suplementación con una dosis única de 200,000 UI de vitamina A sobre el metabolismo de hierro y la inmunidad innata en preescolares, se produjo la disminución de la prevalencia de anemia y deficiencia de vitamina A de 17.6 % a 13.2 % y de 25 % a 13.2 %, respectivamente sin haber suministrado hierro. Se registro también un incremento de la actividad fagocítica en el caso de los niños suplementados (46).
Se ha reportado un efecto favorecedor de la vitamina A y los carotenoides en el metabolismo de hierro y en particular en su absorción a nivel intestinal (47-49). El papel de la vitamina A en el metabolismo de hierro fue corroborado una vez más en un estudio realizado con escolares venezolanos con alta prevalencia de deficiencia de hierro (25%), folatos (75%) y vitamina A (43%). La intervención de educación nutricional tuvo efecto positivo sobre la prevalencia de deficiencia de hierro (25 a 14%), pero no sobre folatos o vitamina A (50).
Las recomendaciones más recientes de vitamina A para la población, aparecen en el libro de “Valores de referencia de energía y nutrientes para la población Venezolana. Revisión 2000” (Ministerio de Salud y Desarrollo Social. Instituto Nacional de Nutrición 2000) (51). Debido a insuficiente datos nacionales, las recomendaciones están basadas en las RDA (Recommended Dietary Allowances) de Estados Unidos para el año 1989 (52), que recomiendan 350 ER/día para recién nacidos, 400 a 750 ER/día para niños y 900 para adultos (hombres y mujeres), recomendando 800 y 1300 ER/día durante embarazo y lactancia, respectivamente.
Debido a las definiciones adoptadas a nivel mundial sobre el conjunto de parámetros definidos como Ingesta Dietética de Referencia (DRIs por Dietary Reference Intakes) que incluye: Ingesta Dietética Recomendada (RDA), Requerimiento Promedio Estimado (EAR), Ingesta Adecuada (AI), Niveles de Ingesta Máximos Tolerables (UL), no están disponibles en la revisión Venezolana del año 2000, en esta revisión se incluirán RDA, EAR, AI y UL, tanto como la data nacional e internacional lo permitan (53,54).
A pesar de que se han realizado un importante número de investigaciones en Venezuela, los datos generados no son suficientes para establecer nuestras propias recomendaciones para vitamina A, por lo que, al igual que para la revisión anterior, estas se basan en las propuestas por el Instituto de Medicina de los Estados Unidos en 2001. Las Ingestas Dietéticas Recomendadas (RDA) de vitamina A para Venezuela son 400-500 ER/día durante el primer año de vida, 300 a 400 ER/día para niños, 600 ER/día para adolescentes, 900 ER/día para hombres y 700 ER/día para mujeres, aumentando a 750 ER/día por embarazo y a 1200-1300 ER/día por lactancia, dependiendo de la edad.
En cuanto a Requerimiento Promedio Estimado (EAR), 210 a 275 ER/día para niños, 445 ER/día para adolescentes varones, 420 ER/día para adolescentes hembras, 630 ER/día para hombres y 485 ER/día para mujeres, aumentando a 530-550 ER/día por el embarazo y a 885-900 ER/día durante la lactancia, dependiendo de la edad.
Los Niveles de Ingesta Máximos Tolerables (UL) para vitamina A son 600 ER/día para niños, 1700 a 2800 ER/día para adolescentes y 3000 ER/día para adultos (hombres y mujeres), incluyendo embarazo y lactancia, de acuerdo a los rangos de edad (14-18, 19-30 y 31-50 años).
En la Tabla 1 se presentan las Ingestas Dietéticas de Referencia (DRIs por Dietary Reference Intakes) para vitamina A que incluyen: Ingesta Dietética Recomendada (RDA), Requerimiento Promedio Estimado (EAR), Ingesta Adecuada (AI) y Niveles de Ingesta Máximos Tolerables (UL), así como las recomendaciones de FAO/WHO, España y la Unión Europea (52,54).
En el país se necesitan estudios para definir el valor del retinol sérico como indicador de deficiencia de vitamina A, así como la búsqueda de biomarcadores más sensibles para medir el estatus de vitamina A y la estandarización de nuevas técnicas de cuantificación de vitamina A en alimentos.
Se deben desarrollar estudios que evalúen el consumo de vitamina A y carotenoides en los diferentes grupos de edad en muestras representativas de la población, especialmente en los grupos más vulnerables, para definir si es necesaria una política de fortificación con vitamina A o sus precursores, a fin de minimizar el riesgo de daños tanto por déficit como por exceso. También es importante desarrollar investigaciones sobre el factor de conversión de carotenoides a vitamina A.