La información sobre biomarcadores óseos en adolescentes y adultas durante el periodo posparto es incierta, por lo que el objetivo de este artículo fue analizar el patrón de biomarcadores óseos en adolescentes y adultas a 15, 90, 180 y 365 días posparto (dpp) y su asociación con la densidad mineral ósea (DMO) y lactancia materna. Se realizó un estudio de cohorte en 32 madres adolescentes ≤17 años y 41 adultas de 18 a 29 años de edad en el primer año posparto. Se realizaron medidas antropométricas, DMO y biomarcadores óseos y así como datos del tipo y la duración de lactancia. Como resultados se encontró asociación entre la concentración basal de N-telopéptidos ≤24 μg/L y mayor aumento de DMO. Las adolescentes tuvieron mayor concentración de N-telopéptidos (p≤0.004) y menor concentración de osteocalcina (5±3 vs13±4, p <0.001) que las adultas. La lactancia no afectó el cambio de DMO (p>0.050), ni de biomarcadores óseos. La osteocalcina se asoció con el cambio en DMO (p<0.040). La prolactina fue mayor entre las que practicaron lactancia materna exclusiva (p<0.001). A menor edad menores concentraciones de osteocalcina (p<0.001) y mayores concentraciones de N-telopéptidos (p<0.001). Se concluyó que a menor concentración de N-telopéptidos y mayor de osteocalcina hubo un mayor aumento de DMO, lo cual implica menor aumento de ésta en el grupo de adolescentes. La lactancia no afectó la DMO.
Palabras clave: Adolescente, densidad mineral ósea, Ntelopéptidos, osteocalcina, posparto, México.
The objective of this study was to describe the trend of bone biomarkers in adults and adolescents women at 15, 90, 180 and 365 postpartum days (ppd) and its relation with bone mineral density (BMD). It was a prospective cohort of 32 teenager’s ≤17 and 41 women from 18 to 29 years old. We evaluated diet, anthropometry, BMD, bone biomarkers and hormonal profile. In all, the concentration of N-telopeptide was higher at 15 days postpartum decreasing during first year postpartum, but adolescents had the highest concentration. The lowest N-telopeptide concentration was associated with highest increasing of the BMD. Osteocalcin concentration was lower in adolescents than in adults women (5 ± 3 vs 13 ± 4 ng/mL, p<0.001) during first year postpartum. Exclusive breastfeeding did not affect the BMD (p>0.050) or bone biomarkers. Osteocalcin concentration was positively associated with bone BMD (p<0.040), breastfeeding did not affect osteocalcin concentrations. Prolactin was higher among women who breastfed exclusively (p<0.001). Age and breastfeeding inversely correlated with bone biomarkers (p<0.001) N-telopeptide and PTHi respectively. We concluded that a lower N-telopeptide concentration and a higher osteocalcin concentration were associated with a higher increasing of BMD, so then, adolescents showed the lowest recovery of the BMD. Breastfeeding does not affect the BMD.
Key words: Adolescent, bone density, N-telopeptide, osteocalcin, postpartum Mexico.
Instituto Nacional de Perinatología. Instituto Politécnico Nacional. Universidad del Altiplano de Tlaxcala. Universidad Iberoamericana Ciudad de México. Universidad del Valle de México. México
El tejido óseo constituye el principal sostén del cuerpo y es la mayor reserva de calcio. Durante la adolescencia se acumula casi 50% de la masa ósea total (1,2). Se ha observado que a lo largo de la gestación y la lactancia hay un mayor recambio de la masa ósea (3), proceso por el cual el hueso viejo es reemplazado por hueso nuevo en un mismo sitio y es el responsable de la completa regeneración del sistema esquelético del adulto (4). Sin embargo, el proceso de resorción ósea es más rápido que el de formación, por lo que todo aumento en el ciclo de remodelamiento conlleva a una pérdida de la masa ósea (5).
En la remodelación ósea intervienen biomarcadores como los N-telopéptidos, los cuales se han asociado a la degradación de la matriz ósea, son sensibles y específicos de la resorción ósea (6). Por otra parte, la osteocalcina producida por los osteoblastos en concentraciones elevadas correlaciona con la formación o remodelado óseo (7). Las hormonas estradiol y progesterona también participan en la resorción y formación ósea respectivamente (8). El calcio participa en la remodelación y formación ósea, manteniéndose en condiciones óptimas cuando su aporte dietario es adecuado acorde a las necesidades fisiológicas de los sujetos, pero cuando la concentración sérica o iónica de calcio baja, la secreción de la hormona paratiroidea (PTH por sus siglas en inglés) aumenta, lo que resulta en un mayor recambio óseo (9-12). El bajo consumo de calcio en mujeres mexicanas (13,14) se puede relacionar con la desmineralización ósea (10).
Previamente se documentó que la densidad mineral ósea (DMO) de la vértebra lumbar 2 a la 4 (L2-L4) y del cuello del fémur no disminuye en mujeres adolescentes durante el periodo posparto y que la edad y las concentraciones de estradiol podrían estar relacionadas con estos resultados (14), sin embargo el patrón hormonal que influye sobre el recambio óseo en adolescentes y adultas que practican la lactancia materna es incierto en esta población, por ello es necesario comprobar los postulados que establecen que en la edad materna, las hormonas y la lactancia humana pueden influir en la pérdida o recuperación de la DMO (11-12).
El propósito de esta investigación fue analizar el patrón de biomarcadores óseos en madres adolescentes y adultas a los 15, 90, 180 y 365 días posparto (dpp) y su asociación con la DMO y la lactancia materna.
Esta investigación deriva de una cohorte de madres adolescentes y adultas atendidas en el Instituto Nacional de Perinatología (INPer) en México, de los años 2003 a 2010 y esta parte del estudio comprende el análisis de biomarcadores de formación y resorción ósea y su asociación con la DMO y la lactancia materna durante el primer año posparto, en un análisis secundario se describió la evolución de la DMO (14). La cohorte, consistió de una muestra de 73 mujeres en el período posparto; seguidas por 1 año posterior al parto, de las cuales 32 eran ≤17 años de edad y 41 mujeres de 18 a 29 años. El tamaño muestral se calculó con base en la diferencia del 7% en la pérdida de DMO, un valor de alfa de 0.05 y de beta de 0.20. Cabe destacar que durante la adolescencia se adquiere el 50% de la masa ósea, las mujeres en esta etapa son consideradas vulnerables fisiológicamente, aunado al proceso de gestación en el que las demandas de nutrimentos se incrementan por la formación del nuevo ser, incrementando el riesgo de osteopenia a edades tempranas por una débil adquisición de la masa ósea, potenciado por un consumo deficiente de calcio y otros nutrimentos relacionados con la masa ósea, por ello es que se contó con casos de adolescentes y los controles con adultas jóvenes, bajo las mismas condiciones socioeconómicas y geográficas (14). Los criterios de selección fueron los siguientes: sin evidencia de enfermedades metabólicas o infecciosas, primigestas, con producto único vivo a término y eutrófico, con método anticonceptivo el ritmo, el dispositivo intrauterino o el preservativo durante el período de seguimiento. No se incluyeron las que tuvieron antecedentes personales de alguna enfermedad ósea, crónica y/o aguda, presencia de toxicomanías y/o que no aceptaron participar en la investigación. Todas las participantes firmaron carta de consentimiento informado, se solicitó la autorización y firma de sus padres o tutores en el caso de las adolescentes. El estudio aprobado por los Comités de Ética e Investigación del propio Instituto.
Las participantes se citaron para su primera evaluación a las dos semanas después del parto, todas las valoraciones, excepto la densitometría ósea; se realizaron a los 15, 90, 180 y 365 días posteriores al parto.
Cuarenta y siete mujeres menores o igual a 17 años y 58 adultas jóvenes (18 a 29 años) iniciaron el estudio, sin embargo, se presentó una tasa de deserción cercana al 25% en ambos grupos.
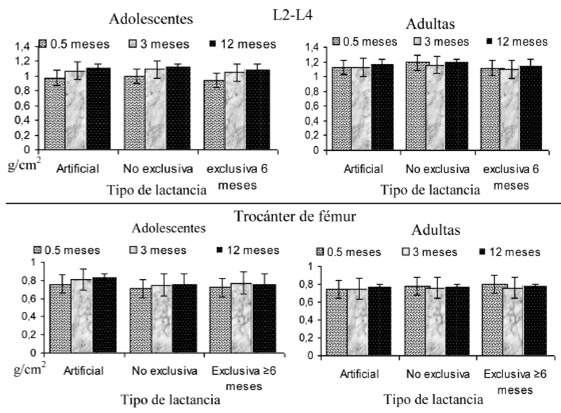
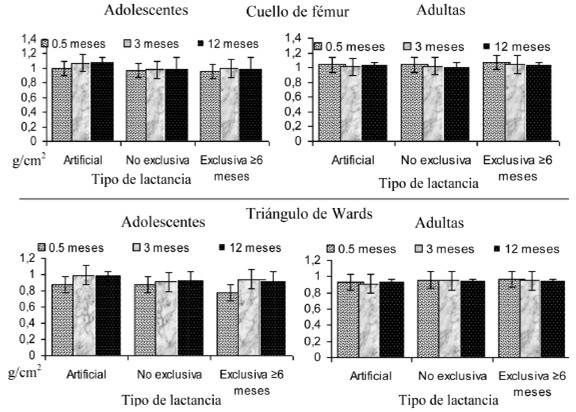
La evaluación de la DMO se efectuó mediante absorciometría dual de rayos X (DEXA) con un densitómetro óseo de la serie Lunar Prodigy (GE Healthcare, Bélgica) y los sitios de evaluación fueron en la columna vertebral L2 - L4, cuello y trocánter de fémur y el triángulo de Wards a los 15, 90 y 365 dpp.
En cada una de las citas de evaluación a las madres se interrogó sobre el número de tetadas (mamadas) y biberones que fueron proporcionados al lactante. La clasificación de lactancia materna exclusiva fue acorde con el número de tetadas y biberones-onzas con fórmula maternizada que se administraban al lactante; ≥8 tetadas y 0 onzas de fórmula al día fue considerada como lactancia materna exclusiva, incorporar a la alimentación del infante más de cuatro onzas con fórmula maternizada fue considerada como lactancia no exclusiva, cero tetadas y alimentación con fórmula fue considerada lactancia artificial. De acuerdo con la duración en la que se proporcionó la lactancia materna exclusiva se hicieron los siguientes puntos de corte para el análisis 0 meses (lactancia artificial), 1 a 5 meses (lactancia no exclusiva), más de 6 meses con lactancia (lactancia exclusiva) (16).
Todas las muestras de sangre materna se tomaron en ayuno previo de 8 horas. Las determinaciones séricas de prolactina y progesterona se realizaron mediante un método automatizado usando la técnica de ELISA (ensayo por inmunoabsorción ligado a enzimas), la detección fue por quimioluminiscencia en un equipo IMMULITE-1000 (Siemens, Estados Unidos) para lo cual se utilizó un volumen aproximado de 50 μL de suero para cada análisis; la cuantificación de osteocalcina se efectuó con la técnica de ELISA manual por el método Metroosteocalcina con un equipo Quidel, sus unidades de expresión fueron en ng/mL, en el laboratorio del Departamento de Nutrición y Bioprogramación del INPer. Para la cuantificación de las concentraciones de N-telopéptidos se utilizó la técnica de radioinmunoensayo (RIA) en un equipo contador gamma, expresadas como μg/L. La PTHi (parathormona intacta) se determinó por la técnica de IRMA (análisis inmunoradiométrico) con un equipo contador gamma expresado en ng/L, estos análisis por el Instituto Nacional de Nutrición y Ciencias Médicas, Ciudad de México.
Otros datos. Todas las participantes fueron medidas y pesadas en cada evaluación, con estas mediciones se calculó el IMC, a través de una encuesta se obtuvo la edad cronológica, edad de la menarca y con estos datos se calculó la edad ginecológica (edad cronológica – edad de la menarca), además se cuestionó cuál era el método anticonceptivo utilizado durante el último mes, así como el mes en que se reinstaló la menstruación. Los datos sociodemográficos correspondieron a mujeres que pertenecen a un nivel socioeconómico medio bajo y bajo, con una escolaridad de secundaria incompleta o menos (14).
Se compararon las medias de los grupos con respecto al tiempo y la edad con análisis de medidas repetidas y se calculó el coeficiente de correlación de Spearman para identificar la asociación entre las variables con distribución no paramétrica. Los puntos de corte usados en la tabla 2a y 2b fueron de acuerdo con la mediana de los propios datos de la concentración de osteocalcina y N-telopéptidos, con la finalidad de tener grupos homogéneos en el análisis. Se consideró una diferencia o asociación significativa cuando existió un valor de p<0.05, el análisis se efectuó mediante el programa estadístico SPSS para Windows, versión 15.
Del total de mujeres invitadas y que completaron el estudio 32 eran ≤17 años de edad y 41 de 18 a 29 años, cuando se compararon las medias de los casos completos y las deserciones no se presentó diferencia significativa en edad cronológica, edad ginecológica, estatura, peso pregestacional, peso máximo gestacional, índice de masa corporal (IMC), DMO en L2-L4, cuello de fémur, trocánter y triángulo de Wards. N-telopéptidos, osteocalcina, progesterona, PTHi y prolactina basales.
La edad cronológica de todas las participantes fue de 20 ± 4.4 años, con una edad de la menarca de 12.0 ± 1.4 años, edad ginecológica de 7.4 ± 4 años. Las adolescentes presentaron una edad cronológica en años de 15.6 ± 0.7, en las adultas ésta correspondió a 22.6 ± 3.5. El IMC al inicio del estudio fue cercano a 23 kg/m2 en adolescentes y adultas.
El tiempo de práctica de lactancia exclusiva en adolescentes fue de 0 meses en 13 casos (40%), de 1 a 5 meses en 9 (27%) y 6 meses o más en 11 participantes (33%); mientras que las adultas que lactaron 0 meses fueron 14 (35%), de 1 a 5 meses 16 casos (40 %) y seis meses y más lo practicaron 10 mujeres (25%), sin asociación significativa por edad (p=0.500)
En las Figuras 1a y 1b se puede observar la tendencia de la DMO por práctica de lactancia por grupo de edad, sobresalió que las adolescentes no disminuyeron su masa ósea, sin embargo, mantuvieron valores más bajos que las adultas (p<0.001), no se observó diferencia significativa por práctica de lactancia (p>0.050), cabe mencionar que se recuperaron las cifras basales de DMO.
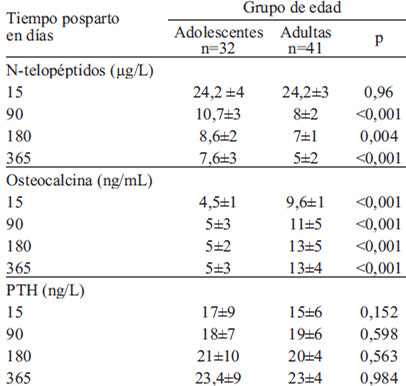
En la Tabla 1 se aprecia que la mayor concentración de N-telopéptidos se ubicó a los 15 dpp, mientras que la osteocalcina tuvo un patrón inverso. En cuanto a los grupos de edad, las adolescentes fueron las que tuvieron las cifras más altas de N telopéptidos y menores de osteocalcina.
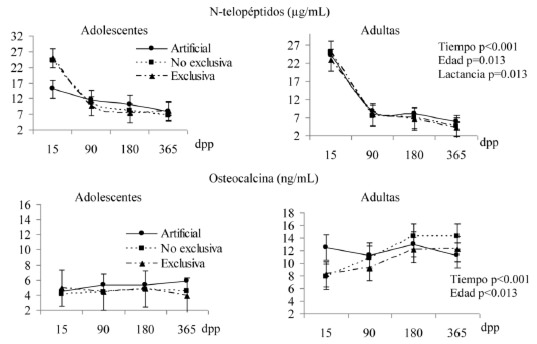
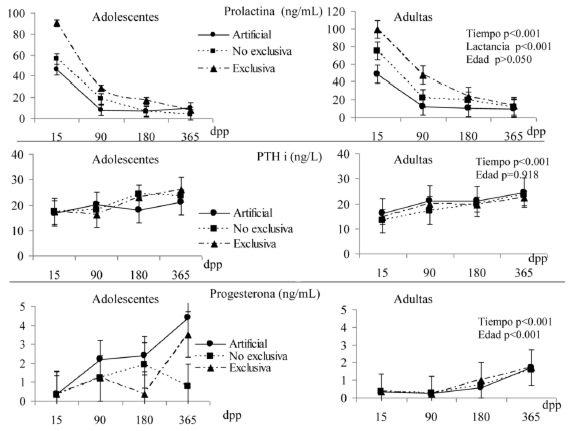
En la Figura 2a se observa que a mayor frecuencia de práctica de lactancia exclusiva menor era la concentración de N- telopéptidos, no obstante, con el tiempo estas concentraciones disminuyeron. Las adolescentes tuvieron concentraciones más altas de N-telopéptidos, comparadas con las adultas. Por su parte, la osteocalcina fue menor en las adolescentes, sin efecto por práctica de lactancia ni por el tiempo. La progesterona fue más alta entre las adolescentes, siendo mayores los valores en proporción al tiempo posparto. En cambio, la prolactina sólo se vio afectada por la práctica de lactancia en ambos grupos. La PTHi, aumentó de forma significativa conforme avanzó el seguimiento, independientemente de la edad y práctica de lactancia materna, como se ve en la figura 2b
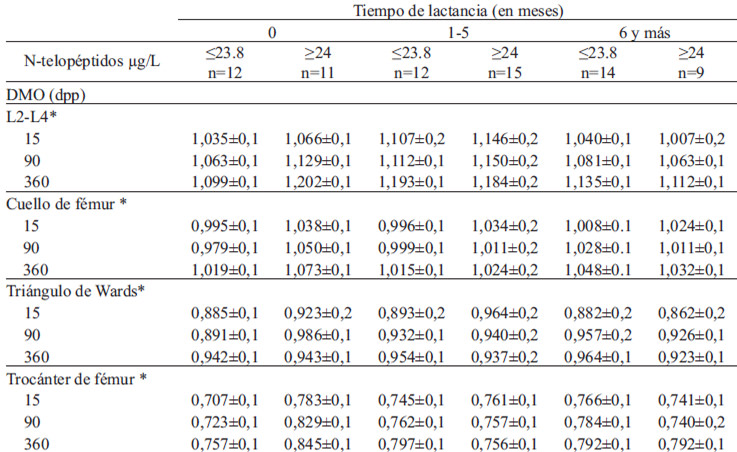
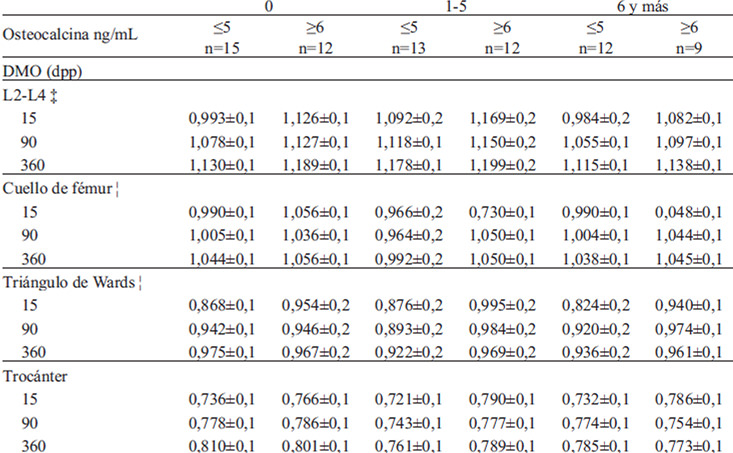
En las tablas 2a y 2b se muestra que el cambio de la DMO se relacionó con la concentración de los N-telopétidos a los 15 dpp, siendo mayor el aumento de la masa ósea entre las que tenían menos N-telopétidos. En contraste, las que tuvieron cifras ≤6 ng/mL de osteocalcina tuvieron menor aumento de DMO. La lactancia no tuvo efecto en la DMO de los sitios estudiados.
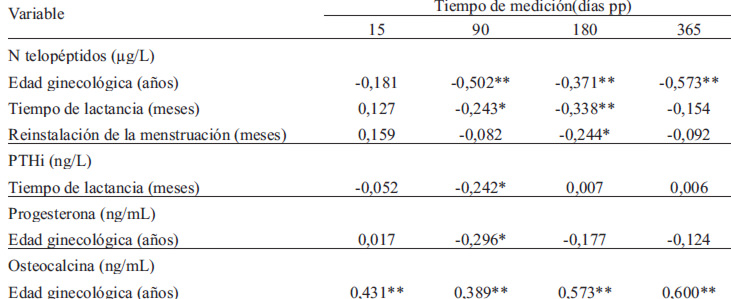
En esta investigación se observó que la edad ginecológica correlacionó directamente con osteocalcina e inversamente con la concentración de N-telopétidos, mientras que la lactancia tuvo una correlación inversa con N- telopéptidos y PTHi, como se ve en la tabla 3.
Este estudio evidencia la variabilidad de los biomarcadores óseos en un mismo período fisiológico de una muestra de mujeres jóvenes mexicanas con diferente edad y práctica de lactancia así como su efecto sobre la DMO.
Las concentraciones de N-telopéptidos en todas las mujeres disminuyeron independientemente de la práctica de la lactancia materna, de esta forma se postula que la pérdida ósea posparto es fisiológica y se explica por la presencia de N-telopéptidos en el grupo de las adultas, en quienes las concentraciones de Ntelopéptidos fueron semejantes a los observados en las mujeres posmenopáusicas (15), así se asume que las adultas atraviesan por un proceso de desgaste óseo aunado al hipoestrogenismo propio del periodo posparto, que va disminuyendo conforme avanza el tiempo. En la presente investigación no se evidenció el papel de la progesterona sobre la DMO, sin embargo se ha documentado que en adolescentes la progesterona se puede asociar con el aumento de la DMO en el periodo posparto, en conjunto con otros factores como el factor de crecimiento insulínico tipo 1 (IGF-1) (17) y el estradiol; hormonas que desafortunadamente no fueron evaluados en este estudio. En este mismo sentido las adolescentes podrían llegar a presentar altas concentraciones de IGF-1 y estradiol contribuyendo así al crecimiento de la estatura, junto con receptores de la vitamina D (18).
Por su parte, las concentraciones de osteocalcina fueron inferiores en el grupo de adolescentes, lo que indica una baja remodelación ósea y por lo tanto una menor capacidad de remodelación. Aún así, las adolescentes de este estudio presentó concentraciones de osteocalcina menores comparadas con otros grupos de adolescentes nulíparas españolas (17, 19), lo que advierte que si bien las madres adolescentes no pierden tanta masa ósea como las adultas, sí podrían limitar su pico máximo de masa ósea, por el propio proceso reproductivo. En este mismo sentido, en las adultas la osteocalcina mostró concentraciones similares a las de mujeres posmenopáusicas (13.3 vs 13.5 ng/mL) (15), por consiguiente, el grupo de las adultas podría estar cursando por un desgaste óseo desde el primer día postparto, manifestado en la DMO y la osteocalcina a los 90 dpp, que se elevó para cubrir la resorción ósea provocada por los N-telopéptidos desde los 15 dpp.
Las concentraciones de PTHi en todas las que participaron en este estudio fueron similares a las reportadas en madres adolescentes brasileñas a los 180 dpp con baja ingestión de calcio (18). La PTHi no mostró diferencia significativa por edad o práctica de lactancia, con relación a lo anterior, se ha reportado que durante los períodos de embarazo y lactancia la PTHi muestra mayores concentraciones cuando la ingestión de calcio es baja, para mantener la concentración de calcio sérico a expensas de la masa ósea con la finalidad de evitar la pérdida renal de calcio (20-22) y como se ha documentado los porcentajes de adecuación de calcio en madres adolescentes son inferiores a lo reportado en población adulta y adolescente en México (13,14, 23).
Por su parte, la prolactina mostró una tendencia diferente por práctica de lactancia materna en ambos grupos y no se asoció con el cambio de la DMO, de esta forma se evidenció que la lactancia materna fue determinante de las concentraciones séricas.
En este documento se observó que la edad ginecológica correlacionó inversamente con la concentración de progesterona y de los N-Telopéptidos, con ello se puede deducir que la madurez fisiológica sería la principal determinante de la salud y desgaste óseo; porque los valores de biomarcadores como la osteocalcina aumentan con la edad (24) para una mayor formación ósea, sin embargo, es preciso reiterar que la muestra de adultas jóvenes fue de menores de 30 años, quienes aún están en formación de masa ósea. (25)
En esta muestra se observó que el tiempo fue la principal variable asociada al cambio en la DMO, mientras que los biomarcadores relacionados al cambio en la DMO fueron osteocalcina y N-telopéptidos, sin que la práctica de lactancia afectara los biomarcadores ni la DMO; contrario a lo reportado (26) en adultas con edad cercana a los 31 años, donde se observó que a mayor tiempo de lactancia mayor concentración de osteocalcina y de telopéptido C terminal.
Los autores de este documento consideran necesario contar con más estudios que corroboren este postulado en población joven; principalmente porque en México las menores de 30 años, incluyendo adolescentes, siguen embarazándose en una tasa alta y acorde con lo hallado en este artículo, se estaría limitando su pico de masa ósea máxima. En este documento se pudo reiterar que la práctica de la lactancia exclusiva no interfiriere en la DMO, sin embargo, se observó que el propio proceso reproductivo entre las adolescentes implica limitar su pico de masa ósea máxima, exponiéndolas a mediano o largo plazo a desgaste óseo.
La principal limitación de este estudio fue no contar con niveles séricos o iónicos de calcio ni la ingesta de éste dentro de las variables confusoras, así como tampoco contar con evaluaciones previas al embarazo que realmente determinen un estado basal y fisiológico, además de tener una diferencia relativamente corta entre las edades de los grupos estudiados, pues esto podría limitar hasta cierto punto el encontrar mayores diferencias. Sin embargo, su principal fortaleza es la relativamente baja tasa de deserción y las múltiples determinaciones a largo plazo que reflejan de mejor manera el patrón fisiológico de los biomarcadores óseos correlacionados con la lactancia y la densidad mineral ósea.
Finalmente, se concluyó que en los N-telopéptidos alcanzaron su mayor concentración a 15dpp, disminuyendo con el tiempo, una menor concentración se asoció a más aumento de DMO al año postparto, sin asociación por práctica de lactancia. La osteocalcina no mostró cambios significativos con el tiempo y su concentración se asoció con el cambio en la DMO.
Los autores agradecen a las mujeres que participaron en el estudio, así como a la Coordinación de Medicina del Adolescente y al Departamento de Climaterio del INPer por las facilidades otorgadas para la realización de la presente investigación.
Recibido: 07-02-2014
Aceptado: 24-04-2014