El objetivo de este estudio fue determinar la relación entre los parámetros de control metabólico y la calidad de los hidratos de carbono (H de C) de la dieta, en sujetos diabéticos tipo 2 (DM 2), controlados con dieta y/o metformina. A 108 hombres y mujeres con edades comprendidas entre 18 y 60 años, hemoglobinas glicosiladas (HbA1c) entre 6% y 10%, sin sulfonilureas ni insulinoterapia; se les aplicó dos encuestas de recordatorio de 24 horas. Se determinó la ingesta de H de C, el índice glicémico (IG) y la carga glicémica (CG) de la dieta. Desde las fichas clínicas se obtuvieron valores recientes de HbA1c. Los datos fueron tabulados en el programa SPSS versión 17. Se utilizó el test de correlación de Pearson para analizar el grado de asociación entre las variables, considerándose significativo un p < 0,05. El promedio de HbA1c fue de 7,3 ± 1,3 %, el consumo de H de C fue de 219,8 ± 27,0 g/día; el IG fue de 74,9 ± 11,3 % y la CG fue de 164,0 ± 22,04 g. Se encontró correlación positiva y significativa entre el consumo de H de C (r=0,290; p<0,05), IG (r=0,70; p<0,001) y CG (r=0,225; p<0,05) de la dieta con los niveles de HbA1c de los sujetos estudiados. En conclusión la calidad de los H de C, especialmente el IG, de la dieta de los sujetos estudiados se asocia fuertemente al control metabólico de la DM 2.
Palabras clave: Diabetes mellitus 2, índice glicémico, hemoglobina glicosilada, hidratos de carbono en la dieta.
The Objective of this study was to determine the relationship between the parameters of metabolic control and quality of carbohydrates (CHO) of the diet in individuals with type 2 diabetes, controlled with diet and / or Metformin. In 108 men and women aged between 18 and 60 years, glycosylated hemoglobin A (HbA1c) between 6 % and 10 %, without sulfonylureas or insulintheraphy; were examined through two separate surveys of 24-hour recall. The CHO intake, GI, GL of diet was analyzed. Values of HbA1c were collected from medical records. Data was tabulated in SPSS version 17 software. The Pearson correlation test was used to analyze the degree of association between variables, considering significant at p < 0.05. The mean HbA1c was 7.3 ± 1.3%, CHO consumption was 219.8 ± 27.0 g / day; GI was 74.9 ± 11.3% and GL was 164.0 ± 22.04 g. A significant positive correlation was found out between the CHO intake (r = 0.290, P < 0.05), GI (r = 0.70, p < 0.001), GL (r = 0.225, p < 0.05) of diet and HbA1c levels in the individuals. In conclusion the study showed that the quality of CHO, mainly GI, are strongly associated with metabolic control of DM 2.
Key words: Diabetes mellitus type 2, glycemic index, glycosylated hemoglobin A, dietary carbohydrates
Escuela de Nutrición. Facultad de Farmacia. Universidad de Valparaíso. Valparaíso, Chile.
La Organización Mundial de la Salud (OMS) estima que la prevalencia de diabetes mellitus tipo 2 (DM 2) en todo el mundo, aumentará de 171 millones (año 2000) a 366 millones (año 2030) (1). Chile, según la última Encuesta Nacional de Salud (ENS), presenta una prevalencia de 9,4% de DM 2. El 52,05% de los diabéticos nacionales se encuentran bajo tratamiento médico, ya sea dietético y/o farmacológico, y tan sólo el 34,32% presentan un buen control metabólico, es decir, una hemoglobina glicosilada (HbA1c) menor a 7% (2).
La DM 2 es un trastorno metabólico cuyo rasgo principal es la hiperglicemia crónica debido a un déficit relativo de la producción de insulina junto con una deficiente utilización de la glucosa por los tejidos periféricos (resistencia a la insulina) (3).
El mantener a largo plazo un mal control metabólico en sujetos DM 2 trae como consecuencias complicaciones microvasculares (retinopatía, nefropatía, neuropatía) y macrovasculares (arterioesclerosis; coronaria, cerebrovascular y de extremidades inferiores) que aumentan sustancialmente la morbi-mortalidad de estos pacientes (3).
Diversos estudios han demostrado una relación directa entre el mal control glicémico y el desarrollo de enfermedades cardiovasculares. El “Study Strong Heart”, encontró una asociación positiva entre la situación basal de la HbA1c, la respuesta glicémica y la incidencia de enfermedades cardiovasculares, tras un seguimiento de nueve años (4).
La intervención dietoterapéutica es un componente clave en el control metabólico de la DM 2 y en la prevención de futuras complicaciones de la enfermedad. Tradicionalmente el asesoramiento se ha centrado en la cuantificación de hidratos de carbono (H de C) pero actualmente la calidad de los H de C, conceptualizada en el índice glicémico (IG) y en la carga glicémica (CG) de la dieta, ha adquirido protagonismo y ha sido impulso de nuevas investigaciones que demuestran, en forma muy controversial, el efecto de estos parámetros dietéticos sobre el control metabólico de sujetos con DM 2 (5,6).
El IG, término introducido en 1981 por Jenkins y cols. (7), es un método para clasificar los H de C de los alimentos según su efecto sobre la glicemia postprandial. Un alto IG está generalmente acompañado de una alta respuesta glicémica e insulinemica en sujetos sanos. Por otro lado, la CG es un concepto que permite evaluar la calidad y la cantidad de H de C utilizando un sólo valor, y se calcula multiplicando el IG por la cantidad de H de C disponibles (g) en el alimento dividido en 100.
Existen distintos factores que pueden influir en el IG, tales como: el tipo de fibra (fibra soluble versus insoluble), proporción amilosa:amilopectina, grado de gelatinización del almidón, composición química de los H de C, presencia de grasas y proteínas en una comida mixta, y la forma de preparación o método de cocción del alimento (7). Esto explica en parte, lo controversial de los hallazgos encontrados en estudios anteriores que han evaluado la asociación de este indicador dietético con la incidencia o el control de determinadas patologías.
La Asociación Americana de Diabetes (ADA) plantea que la utilización de la CG y el IG en la planificación de la dieta del paciente DM 2, puede proporcionar un beneficio adicional, al uso del conteo de H de C (6). Por otro lado la Asociación Europea de Diabetes (EASD) y la Asociación Canadiense de Diabetes (CDA) también reconocen el potencial efecto de los alimentos de IG bajo y ricos en fibra (8).
Un metaanálisis de 14 estudios que incluyeron a 356 sujetos con diabetes tipo 1 y tipo 2 concluyó que es posible mejorar el control de la glucosa en sangre con dietas de bajo IG, en una proporción similar a la que se observa con los medicamentos (9). Otro metaanálisis publicado por Ludwig y cols. (10), que incluyó 16 estudios los cuales investigaron el efecto de dietas de bajo IG sobre los marcadores del metabolismo de los H de C y lípidos, arrojó que se reducen significativamente los valores de fructosamina y HbA1c en personas con DM 2. Por otro lado, el estudio UKPDS, que tuvo entre sus objetivos determinar si la terapia nutricional, a través del conteo de H de C, reduciría tanto el uso de fármacos como las complicaciones micro y macrovasculares; demostró que la retinopatía, la nefropatía y, posiblemente la neuropatía, se beneficiaban con la reducción de la cantidad de H de C ingeridos, disminuyendo la HbA1c de 7,9% a 7.0% (11).
Considerando las controversias que muestran estudios anteriores sobre el uso de la cantidad de H de C, del IG y de la CG en el tratamiento dietético de los sujetos DM 2, y con el propósito de determinar el impacto de la cantidad y calidad de los H de C de la dieta sobre parámetros de control metabólico de sujetos DM 2; se formuló el presente estudio.
El grupo estudiado comprendió a 108 hombres y mujeres entre los 18 y 60 años, con hemoglobinas glicadas (HbA1c) entre 6% y 10%, sin sulfonilureas ni insulinoterapia. La muestra fue seleccionada en forma aleatoria de acuerdo a los criterios de inclusión y exclusión (Tabla 1), la antigüedad de los exámenes de laboratorio no fue superior a 3 meses desde su recolección. Los sujetos fueron reclutados en los centros de atención primaria pertenecientes a las comunas de Quilpué y Villa Alemana, de la región de Valparaíso, Chile. El estudio fue aprobado por el Comité de Ética de la Facultad de Farmacia de la Universidad de Valparaíso. Todos los pacientes firmaron un consentimiento informado.
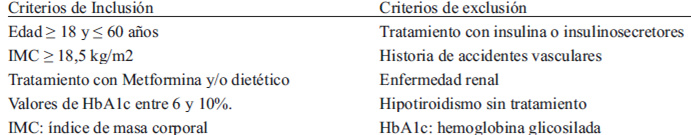
Este estudio fue de carácter descriptivo correlacional de corte transversal. Se seleccionaron los sujetos a través de la revisión de fichas clínicas y se citaron vía telefónica. Los participantes fueron sometidos a evaluación nutricional antropométrica y alimentaria, a cargo de un profesional Nutricionista.
Se determinó el consumo de alimentos, mediante una encuesta de recordatorio de 24 horas aplicada en dos días no consecutivos de la semana, se realizó el correcto registro de la información, considerando horarios, tiempos de comida, preparaciones y cantidad de los alimentos consumidos (12). Se calculó el aporte de hidratos de carbono (H de C) de la dieta mediante el uso del programa computacional Microsoft Excel y la base de datos de composición química de los alimentos de la pirámide alimentaria chilena (13). Para estimar la calidad de los H de C de la dieta se calculó el IG y CG de la dieta. Para el IG se utilizó la metodología descrita por Wolever y Jenkins (7) en 1986, teniendo como referencia la publicación de Foster-Powell (14) 2002 sobre valores de IG. Esta fórmula es avalada por la FAO/OMS para preparaciones mixtas (15), y se describe a continuación (ver ecuación 1):
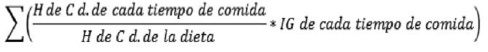
La CG de la dieta se determinó a partir del total de H de C consumidos en el día, se multiplicó por el IG de la dieta y se dividió por cien (14) (ver ecuación 2):
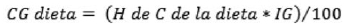
Se midió el peso corporal en una balanza digital Tanita ® número 2204, con precisión de ± 100 g y la talla con un estadiómetro con variación de 0.1 cm Seca® (Vogel & Halke GMBH & Co, Alemania); los pacientes fueron evaluados descalzos y con ropa ligera. Con los datos obtenidos se calculó el índice de masa corporal (IMC= peso (kg)/talla (m2).
El indicador de hemoglobina glicosilada (HbA1c) se obtuvo de los exámenes bioquímicos registrados en las fichas clínicas de los sujetos estudiados que no sobrepasaron una antigüedad de tres meses desde y posterior a la recolección. El método analítico para su determinación debía corresponder a HPLC (cromatografía líquida de alta precisión) que participa en Programas de Evaluación Externa de Calidad (PEEC) del Instituto de Salud Pública, Chile (ISP) y usa técnicas certificadas por el National Glucohemoglobin Standaritation Program (NGSP) (16).
Los resultados están expresados como promedio ± desviación estándar. La correlación entre variables se evaluó con el coeficiente de Pearson. El programa computacional utilizado para el análisis estadístico fue el SPSS, Statistical Package for the Social Sciences versión 17 ® (SPSS Inc, Chicago IL, USA). Para cada una de las asociaciones se consideró significativo un p<0,05.
Las características generales de los sujetos estudiados aparecen detalladas en la Tabla 2. Mayoritariamente los sujetos estudiados correspondían al sexo femenino al canzando un 79 % del total (n=108). El 95,4% de la población estudiada presentó mal nutrición por exceso, considerando en este porcentaje la suma del sobrepeso, y la obesidad clase I, II y III.
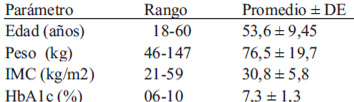
En relación a los niveles de HbA1c el 55,5 % de la muestra estudiada presentó un valor superior al 7%, cifra que da cuenta de un inadecuado control metabólico. El consumo promedio de H de C fue de 219,8 g ± 27,0 g, el IG promedio de las dietas analizadas fue de 74,9 % ± 11,3 % y la CG fue de 164,0 g ± 22,4 g. El IG observado alcanzó un máximo de 125 % y un mínimo de 57,6%, mientras que el valor máximo de la CG fue de 221 g y el mínimo de 93,9 g.
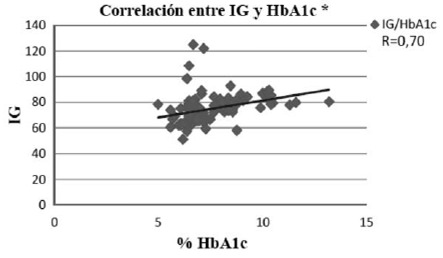
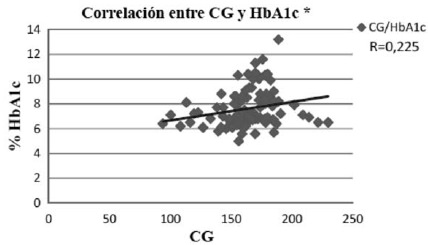
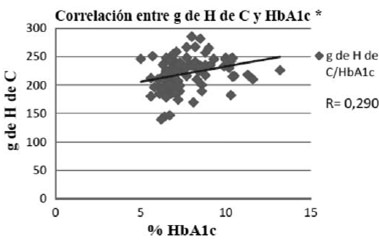
Al analizar con el coeficiente de correlación de Pearson, la asociación entre el IG y la HbA1c mostró una correlación positiva con un r = 0,70 (p <0,001), demostrando que hay una fuerte asociación entre el IG de la dieta y los valores de HbA1c (fig.1). La CG de la dieta, también presentó una correlación positiva con la HbA1c, pero en este caso el coeficiente de correlación fue de 0,23 (p <0,05), valor que demuestra una asociación débil entre las variables estudiadas (fig.2). El consumo de H de C, presentó una correlación positiva débil con los valores de HbA1c (r = 0,29; p <0,05) (fig.3), con consumo de H de C que aumenta a mayor valor de HbA1c.
La Diabetes Mellitus tipo 2 (DM 2) es un trastorno metabólico cuyo rasgo principal es la hiperglicemia crónica derivada de un déficit relativo de la producción de insulina y de la utilización de la glucosa por parte de los tejidos periféricos (3). Según la última Encuesta Nacional de Salud (ENS) en Chile, la prevalencia de DM 2 ha aumentado considerablemente, pasando de un 6,3% en el año 2003 a un 9,4% el año 2010; condición más prevalente en mujeres con una prevalencia del 10,4% frente a un 8,4% de los hombres (2), que explica el hecho de que los sujetos estudiados correspondían mayoritariamente al sexo femenino. Además la prevalencia nacional de malnutrición por exceso va en ascenso llegando al 64,5% actualmente (2). Esta cifra es menor al 95,4% encontrado en este estudio y confirma que la presencia de obesidad como enfermedad crónica es uno de los principales factores que se asocia con la incidencia de DM 2 (17).
El 44,5% de los sujetos encuestados presentaba una HbA1c dentro del rango establecido por la Asociación Americana de Diabetes (ADA) para determinar un buen control metabólico (<7%) (18). Este valor es mayor a la realidad nacional donde tan sólo el 34,32% de los sujetos DM 2 presenta un adecuado control metabólico (2). Esto se puede explicar porque la cifra nacional contempla a aquellos sujetos DM 2 de larga evolución que se encuentran bajo tratamiento dietético y/o farmacológico, incluyendo sulfonilureas e insulina, situación contraria a esta investigación que sólo contempla sujetos DM 2 con metformina y/o dieta, que están en la 1° etapa del algoritmo de tratamiento recomendado por la ADA y la Asociación Europea de Diabetes (EASD) (19).
En relación al consumo de H de C de la muestra estudiada, la ingesta promedio de los sujetos fue de 219,8 ± 27,0 gramos de hidratos de carbono/día, valor que se encuentra dentro de la cantidad de H de C que recomienda la ADA (55% de hidratos de carbono del valor calórico total diario) para el paciente diabético, correspondientes a 190 a 248 g diarios para un sujeto con una ingesta energética recomendada entre 1400 y 1800 kcal/día (20).
El IG promedio de las dietas analizadas fue de 74,9 % ± 11,3 %, valor que se considera de alto IG de acuerdo a lo postulado por Brand Miller y cols. (21) quienes clasifican como alimentos, preparaciones y/o dietas de bajo IG ≤55 %, IG moderado 56 69%, y alto IG ≥70 %. La CG promedio fue de 164,0 g ± 22,4 g, categorizada como moderada (considerando 250 g de H de C de ingesta máxima diaria). Estos resultados reflejan que los sujetos estudiados presentan una ingesta de H de C adecuada, sin embargo, seleccionan alimentos de alto IG (2), lo que estaría explicado por los distintos factores que influyen en el IG tales como: el tipo de fibra, grado de gelatinización del almidón, composición química de los H de C, presencia de grasas y proteínas en una comida mixta, la forma de preparación y/o método de cocción del alimento (7).
En este estudio, cuyo objetivo principal era determinar el impacto de la cantidad y calidad de los H de C de la dieta sobre parámetros de control metabólico de sujetos DM 2, el primer hallazgo fue constatar una asociación positiva significativa entre el IG de la dieta y los valores de HbA1c de los sujetos estudiados. Esto también se afirma en el meta-análisis publicado por Ludwig y cols. (10), que incluyó 16 estudios, donde se vinculó la ingesta de dietas de bajo IG con los valores de HbA1c en sujetos DM 2 y es coherente con una revisión de Thomas y Elliott (22), que incluyó 11 estudios con 402 sujetos DM 2, donde dietas de bajo IG produjeron una disminución, clínicamente significativa, de la HbA1c en un 0,5%.
La CG de la dieta, se asoció con los niveles de HbA1c, sin embargo, es importante destacar que la asociación es más débil que la encontrada para el IG, hallazgo concordante con lo demostrado por un estudio realizado en pacientes DM 2 con sobrepeso y obesidad, el cual reveló que la disminución de la HbA1c se logra cuando una dieta con bajo IG se asocia con una baja CG en comparación con una dieta de alto IG y alta CG (23).
Se observó que la ingesta de H de C en la dieta se correlaciona con los niveles de HbA1c. Esto ratifica lo expuesto en el estudio UKPDS, el cual determinó que la terapia nutricional a través del conteo de H de C reducía tanto el uso de fármacos como los parámetros de HbA1c y complicaciones micro y macrovasculares (11). Los resultados obtenidos en este estudio ratifican las actuales recomendaciones de la ADA, que señalan que la CG y el IG en la planificación de la dieta del paciente DM 2, puede proporcionar un beneficio adicional al uso de la técnica de conteo de H de C en el diseño de un plan alimentario (20). Sin embargo, tanto el IG como la CG no deben ser utilizados en forma aislada ni desconocer sus limitaciones y consecuentes controversias. Existen diversos argumentos en pro y en contra del uso del IG como medida de la calidad de un alimento, existiendo muchas veces opiniones discrepantes sobre este tema (24). Una de sus limitaciones es que sólo considera la respuesta glicémica, y no la respuesta a la insulina, que puede ser más apropiada en la representación de los efectos de algunos alimentos cuyo contenido no sea principalmente H de C; además en este estudio los cálculos se basan en valores promedios de IG obtenido de la base de datos de composición química de los alimentos de la pirámide alimentaria chilena (13) que si bien entregan una visión general, puede conllevar a errores, puesto que el IG se ve significativamente alterado por una serie de factores extrínsecos, donde las costumbres culinarias locales y domésticas juegan un papel notable. En general se debe buscar un mejor entendimiento y uso de estos concepto, más que apoyarlos o refutarlos en su totalidad (25).
Los resultados obtenidos en este estudio sugieren que se podría tomarse como referencia el uso del IG y la CG de la dieta como complemento al conteo de H de C en la consejería nutricional, puesto que se encontró una correlación positiva y significativa del IG, CG e ingesta de H de C con los niveles de HbA1c en sujetos diabéticos tipo 2, siendo dicha asociación más fuerte para el IG de la dieta.
Los autores expresan su agradecimiento a Profesores Informantes de la Universidad de Valparaíso: Nta. Rafael Jiménez Lira, Dra. Gloria López Stewart, Dra. Karen Valenzuela Landaeta por su colaboración en el proyecto de investigación. Igualmente se agradece la colaboración del personal técnico-administrativo y profesional de los Centros de atención primaria de las Corporaciones de Quilpué y Villa Alemana, por su participación en la identificación de potenciales candidatos para el estudio.
Recibido: 11-06-2014
Aceptado: 21-09-2014