Existen fórmulas enterales específicas para mejorar el control glicémico en diabéticos; con carbohidratos cuya respuesta glicémica sería de interés indagar. Se determinó el efecto del consumo de una fórmula con carbohidratos de liberación prolongada sobre la respuesta glicémica e insulina post-prandial en 21 sujetos sanos; (11 hombres y 10 mujeres) entre (17 y 25 años), quienes consumieron en 2 ocasiones la fórmula enteral polimérica para diabéticos y el alimento de referencia (pan blanco), en una cantidad de 50 g de carbohidratos disponibles. La glicemia fue medida a los 0, 15, 30,45, 60, 75, 90, 105 y 120 min y las concentraciones de insulina en ayuno y a los 120 min. El área bajo la curva de glicemia fue calculada resultando más baja para la fórmula 11718,20. ± 1112,38 que para el pan blanco 13269,18 ± 1351,05, (p<0,001). El índice glicémico (IG) resultó intermedio (63,33±5,22), y más bajo al compararlo con los rangos de IG publicados para el alimento de referencia(80-96). Se produjo una menor concentración de glicemia posterior al consumo de la fórmula; sin incrementos en los requerimientos de insulina, presumiendo un uso adecuado en diabéticos y una respuesta de saciedad más prolongada. Este efecto y la hemoglobina glicosilada deberían estudiarse tras el consumo en períodos prolongados en sujetos con diabetes.
Palabras clave: Carbohidratos, diabetes, respuesta glicémica.
There are specific formulas of enteral nutrition to improve glycemic control in diabetic patients containing different types of carbohydrates which glycemic response should be investigated. The consumption effect of a formula with carbohydrates with extended release was determined on the glycemic response and postprandial insulin in 21 healthy individuals (11 men and 10 women) from 17 to 25 years old, who consumed in two different time the polymeric enteral formula for diabetics and the reference food (white bread) in a quantity of 50 g of available carbohydrates. The glycemia was measured at 0, 15, 30, 45, 60, 75, 90, 105 and 120 min and the insulin concentrations in fasting and within 120 min. The area in the glycemic curve was measured being the lowest the formula 11718.20. ± 1112.38 than in white bread 13269.18 ± 1351.05 (P<0.001). The glycemic index (GI) resulted to be intermediate (63.33±5.22) and lower when compared to the GI ranks published for the reference food (80-96). A lower concentration of glycemia occurred after the consumption of the formula, without increments in the insulin requirements; thus, assuming an adequate use in diabetic and a more extended feeling of fullness. This effect and the glycated hemoglobin should be studied after the extended consumption in people with diabetes.
Key words: Carbohydrates, diabetes, glycemic response
Centro de Investigaciones Endocrino-Metabólicas “Dr. Félix Gómez”, Laboratorio de Ciencia y Tecnología de los Alimentos. Facultad de Medicina, Universidad del zulia-Venezuela. Departamento de Medicina. Universidad de Córdoba. España
Una las patologías crónicas, de mayor incidencia a nivel mundial lo constituye la diabetes mellitus tipo 2 (DM 2) la cual a pesar de ser una enfermedad no transmisible, su prevalencia se ha incrementado aceleradamente en los últimos años,así como lo expone la Federación Internacional de la Diabetes (IDF), con una proyección de 471 millones de diabéticos para el 2035 (1). Se calcula que en 2014 la prevalencia mundial de la diabetes fue del 9% entre los adultos mayores de 18 años.(2) En el continente Americano, el estudio CARMELA, muestra una prevalencia general de 7%, cuyo muestreo transversal multifásico, incluyó más de 11.000 individuos pertenecientes a 7 ciudades de Latinoamérica, resaltando (8,9%) de prevalencia en Ciudad de México y (6,4%) en Barquisimeto, única ciudad de Venezuela incluida en el estudio.(3) Según datos de la IDF, Venezuela presentó una prevalencia de diabetes del 6,6% para el 2013 equivalente a 1,2 millones de personas (1).
En estos pacientes, la hiperglicemia constituye el factor etiológico más determinante de las complicaciones macro y microvasculares de esta patología; estudios han demostrado la influencia que ejerce específicamente la composición de la dieta sobre este factor de riesgo (4). De acuerdo a la Asociación Americana de la Diabetes, la selección adecuada y monitorización de la ingesta de hidratos de carbono, constituye una herramienta eficaz en el control glicémico de los sujetos que padecen de esta enfermedad. Por esta razón, la recomendación dietética a nivel mundial está centrada tanto en la calidad como en la cantidad del carbohidrato (5).
Específicamente este nutriente, afecta alrededor del 40% de la varianza en la respuesta glicémica posterior a la ingesta de un alimento, determinado por el índice glicémico y la carga glicémica. Así, la selección del tipo de carbohidrato puede ser una alternativa viable para el mantenimiento de niveles adecuados de glicemia en diabéticos (6). Gran cantidad de estos pacientes con manifestaciones clínicas severas que incluyen accidentes cerebrovasculares con consecuencias como la disfagia, entre otras, frecuentemente requieren soporte nutricional enteral. Habitualmente, los requerimientos nutricionales de los pacientes con diabetes en la nutrición enteral se cumplen con el uso de productos enterales estándar o productos específicos para diabetes (7).Sin embargo, se ha reportado un mejor control metabólico con el uso de estos últimos, que con el uso de fórmulas estándar cuya composición es más elevada en carbohidratos de alto índice glicémico, aunado a que son más bajas en grasa y fibra dietética (8).
Revisiones sistemáticas de las fórmulas específicas para diabetes (FED) han detallado en su composición nutricional, ácidos grasos monoinsaturados (AGM), y endulzantes calóricos como la fructosa (7). A pesar de que estas fórmulas de liberación prolongada están diseñadas con el objetivo de lograr mejorar el control glicémico en los diabéticos, la Asociación de Nutrición Parenteral y Enteral (ASPEN) ha aprobado en sus guías clínicas, el uso de estas fórmulas específicas para diabetes, fundamentado en 2 estudios puntuales realizados por León y col (9) en el año 2003 y Mesejo y col (10) en el 2005;sin embargo, esta sociedad aún no ha recomendado su uso específicamente en pacientes diabéticos hospitalizados con hiperglicemia, y ha sugerido ampliar la cantidad de estudios (11), hasta la actualidad, el tema ha creado controversia y ha sido de gran interés para cierta cantidad de investigadores (7).
El estudio de los indicadores de la respuesta glicémica a los alimentos generalmente se realiza en sujetos sanos, con el fin de determinar un comportamiento metabólico que sirva de referencia para establecer comparaciones con los sujetos diabéticos (12). La selección adecuada de formulaciones específicas en la alimentación enteral del paciente diabético constituye una alternativa eficaz en la planificación dietética, como parte de su tratamiento, contribuyendo así al mantenimiento de la euglicemia y a la prevención de complicaciones.
En virtud de lo anteriormente expuesto, el objetivo de este estudio fue determinar el índice glicémico y el efecto del consumo de una fórmula con carbohidratos de liberación prolongada sobre la respuesta glicémica e insulina post-prandial en individuos sanos.
Sujetos: Se seleccionaron 21 sujetos sanos voluntarios (11 hombres y 10 mujeres), con edades comprendidas entre los 17 y 25 años; que asistieron a la Facultad de Medicina de la Universidad del zulia, a quienes se les realizó una historia médica y nutricional. Los sujetos cumplieron con los siguientes criterios de inclusión: estado nutricional normal (índice de Masa Corporal normal, oscilando entre 18.4 a 24.9 Kg/m2) utilizando la clasificación sugerida por la OMS (13) y con valores bioquímicos de glicemia e insulina basal y post-prandial, así como perfil lipídico normales. Fueron excluidos sujetos con: presencia de diabetes mellitus, glucosa en ayunas mayor de 100 mg/dl, dislipidemia, enfermedad renal, hipertensión arterial, mujeres en período de embarazo o lactancia, síndrome de ovario poliquístico, trastornos gastrointestinales, uso de medicación que afecte el vaciamiento gástrico como (antihistamínicos, anti-depresivos tricíclicos, fenotiazinas, antiácidos que contienen aluminio y los opiáceos); uso de laxantes o suplementos vitamínicos que interfieran en la digestión y/o absorción de alimentos (tales como aquellos que contengan fibra en su composición). Se excluyó del estudio también a las personas que siguieranun régimen de alimentación específico y aquellas que realizaran unaactividad física intensa mayor a 90 min por semana.
Diseño del Estudio: Se realizó un estudio cruzado en donde todos los sujetos fueron sometidos a 4 pruebas de consumo (2 para el alimento de referencia y 2 para la fórmula enteral), con un intervalo de 1 semana entre cada prueba, con diferentes secuencias. La primera sesión se dedicó al alimento de referencia, la segunda a la fórmula enteral y de forma inversa se hicieron las otras dos sesiones. El número de sujetos en el estudio así como el número de repeticiones de cada sesión fue realizado en cada sujeto de acuerdo con una de las consideraciones metodológicas para el protocolo de respuesta glicémica e índice glicémico publicadas en el 2009 (14). Todos los participantes leyeron y aceptaron firmar el consentimiento informado del proyecto de investigación. El protocolo fue aprobado por el Comité de ética del Centro de Investigaciones Endocrino -metabólicas “Dr. Félix Gómez”, Facultad de Medicina, Universidad del zulia.
Procedimiento: Los participantes acudieron al laboratorio en ayuno de 10 horas a las 7:00 a.m. durante 4 días distintos. El horario de asistencia por cada participante a cada sesión, así como el control de los minutos en la toma de las muestras fue supervisado por el investigador principal. Se tomaron muestras de sangre (0.5 ml) de forma capilar (por duplicado), antes del inicio de cada sesión para confirmar que los valores de glicemia estuvieran en entre los rangos esperados 70 - 100 mg/ dL. En caso de no tener los valores de glicemia requeridos, se dieron instrucciones a estos sujetos para que regresaran otro día a realizar su prueba. Una vez tomadas las muestras basales, al sujeto se le dio a consumir en un período estandarizado de 15 min, el producto enteral o pan blanco, este último junto a 250 ml de agua. Posteriormente, se obtuvieron muestras de sangre capilar a los tiempos 15, 30,45, 60, 75, 90, 105 y 120 min, para la medición de glucosa; muestras basales y post-prandriales venosas de 2 h para la medición de insulina (14).
Prueba de Alimentos: Con el fin de homogeneizar la cantidad de carbohidratos consumida antes de cada sesión, a cada sujeto se le realizó un registro de alimentos de 3 días, por un profesional de la nutrición; y se les instruyó para que el día an¬terior a la prueba consumieran un menú estandarizado de 2100 calorías para las mujeres y 2500 calorías para los hombres con una distribución de 13% de proteínas, 31% de grasas y 56% de carbohidratos para asegurar que todos estuvieran en las mismas condiciones para el día de la prueba.
Sólo se les permitió ingerir agua durante el ayuno, ningún alimento con cafeína, leguminosas, ni bebidas alcohólicas en la noche anterior; y se les solicitó no realizar esfuerzo físico las 24 h del día anterior a la prueba. Para las determinaciones bioquímicas iniciales y post-prandiales de inclusión en los sujetos (se les suministró un desayuno estandarizado) de 494,1 kcal,compuesto por 58 gr pan integral, 30 gr de jamón de pavo, 25 gr queso pasteurizado, y 200 ml de jugo de naranja. Para las pruebas con la fórmula, se seleccionó el pan blanco (Bimbo®)como alimento de referencia de acuerdo a la metodología empleada (14), en una cantidad de 96,15 g aportando 240 Kcal y 50 g de hidratos de carbono disponibles. La composición nutricional por cada 100 g de pan es de 249 kcal, 7,5 g de prot, 2,7 g de grasa total, grasa saturada 0,8 g, monoinsaturada 0,4 g, polinsaturada 1,1 g, 52 g de carbohidratos disponibles, 5,2g de azúcares totales y 377 mg de Na,información suministrada en el etiquetado del producto.
Alimento Experimental: El producto evaluado es una fórmula enteral en polvo, (Glucerna SR® Laboratorios Abbott), la cual fue suministrada a reconstitución de 89.29 g, en una cantidad de agua total de 370 ml, proporcionando 50 g de hidratos de carbono disponibles. El volumen final de fórmula utilizado fue de 416 ml con una dilución de 19,62%. Su aporte nutricional por cada 100 g de producto es de 424 Kcal, 21.15 g de proteínas, 15,38g de lípidos y 55,90 de carbohidratos disponibles. El aporte de fibra es de (3,6 g/100 g). La fórmula contiene maltodextrina, fructosa y maltitol como fuente de carbohidratos, contiene polisacáridos de la soya y fructo-oligosacáridos (FOS) como fibra dietética; la fuente lipídica es ácido oleico y aceite de soya; la fuente proteica es caseinato de calcio (98%) y proteína de soya (2%); y está suplementado en cantidades variables con vitaminas y minerales.
Análisis de las Muestras: Con el fin de evaluar los parámetros bioquímicos de inclusión a todos los pacientes se les tomó muestra de sangre en ayunas a partir de las 7:00 a.m. después de un ayuno nocturno de 10 horas para las determinaciones iniciales de glucosa, insulina y perfil lipídico, posteriormente de haber ingerido el desayuno estandarizado,se tomó una nueva muestra post-prandrial (2 horas después) para determinar glucosa e insulina. La glicemia y el perfil lipídico fue cuantificado a través de métodos enzimáticos (Human GMBH, Germany), los mismos incluyen: colesterol total (mg/dl), y triacilglicéridos (mg/dl). La insulina se midió con el método de radio inmuno-análisis utilizando un kit comercial (DRG); los coeficientes de variación intra e interensayo para el método fueron de 5,1% y 7,1%, respectivamente, con una sensibilidad de 1,2 LtIU/ml. Las muestras de glicemia capilar fueron determinadas con glucómetros de Marca® Optium Xceed y cintas reactivas denominadas Medisense Optium ® (Laboratorios Abbott).
Los valores de las áreas bajo la curva se utilizan para calcular el IG por medio de la siguiente ecuación:

Donde IG es el índice glicémico y AUC es el área bajo la curva. El IG es expresado como porcentaje(14).
Análisis Estadístico: Incremento del área bajo la curva: La respuesta glicémica postprandial fue evaluada como el incremento del área bajo la curva (IAUC) a las 2 h. El IAUC se calculó geométricamente utilizando el método trapezoidal (14). La IAUC para el alimento de referencia y para la fórmula fueron evaluadas individualmente para cada día de medición. Así se obtuvieron 2 IAUC para la fórmula y 2 para el alimento de referencia. Para el cálculo de las AUC, se utilizó el programa NCSS 2007. Los resultados son expresados como la media ± DE, se utilizó el ANOVA para medidas repetidas con el fin de evaluar globalmente las comparaciones entre las curvas de glicemia. Con el propósito de estudiar las diferencias en las concentraciones de glicemia en cada uno de los tiempos de la curva, se aplicó la prueba t de Student para muestras dependientes. La prueba no paramétrica U de Mann-Whitney fue utilizada para evaluar las diferencias en el área bajo la curva previa determinación de test de normalidad, considerándose significativo un valor de p<0,05. Todos los análisis se hicieron con el software SPSS Statistics 17.0.
Características de los sujetos: El protocolo inicial correspondía a 24 sujetos, 3 de ellos no fueron incluidos en el estudio, debido a: sensación de náuseas en uno de los sujetos durante la ingesta de los alimentos, otro de los participantes no logró consumir el producto de referencia por hipoglicemia debido a prolongación del período de ayuno, y un tercer sujeto, abandonó el estudio voluntariamente, finalmente 21 sujetos lograron completar todas las sesiones. La media ± (DE) de la edad, peso, estatura, IMC y circunferencia abdominal de los sujetos fue de 19,15 años ± (1,5); 60,7 Kg ± (9,0); 165,8 cm ± (10,6); 22,01 Kg/m2± (1,5) y 75,82 ± (4,5) respectivamente. La media ± (DE) de insulina, fue de 12,8 ± (4,0). En los valores de glicemia, colesterol y triglicéridos se observó una media ± (DE) de 86,94 mg/dl ± (7,2); 146 mg/dl ± (24,05); y 61,10 mg/dl ± (22,89) en forma respectiva, calificando a todos los sujetos participantes de este estudio como individuos sanos.
Respuesta Glicémica: El perfil glicémico basal y posterior a la ingesta del (PB) y de la (FE), así como las diferencias de tiempo se muestra en la figura 1. Los valores se encuentran expresados como media ± (DE). No existieron diferencias en las concentraciones de glucosa en ayuno para ninguno de los tratamientos. Ambos productos alcanzaron su pico máximo a los 30 minutos posterior a la ingesta .
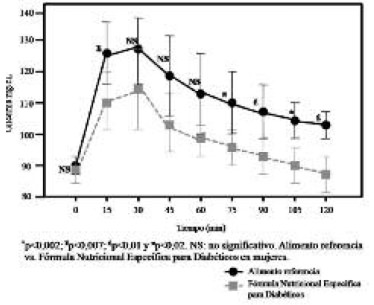
Los niveles de glicemia retornaron a un valor similar a la concentración inicial cerca del minuto 120 para el producto enteral, en tanto que para el pan blanco, los niveles de glicemia, al término del período prueba (120 min), no retornaron a la concentración de glucosa inicial con valores estadísticamente distintos al ayuno (p<0,001).La curva glicémica (mg/dl) fue significativamente más baja en el total de los sujetos a los 15, 30, 45, 60, 75, 90, 105 y 120 minutos para la fórmula específica (FE) comparada con el pan blanco (PB): p<0,03; p<0,009; p<0,002; p<0,002; p<0,001; p<0,007; p<0,001, p<0,001 respectivamente (Figura 1). Al categorizar por género, se aprecia que en la respuesta glicémica de las mujeres se distinguen niveles de glucosa en sangre significativamente más bajos para la fórmula que para el pan blanco a los 15, 75, 90, 105 y 120 minutos: p<0,007; p<0,02; p<0,01; p<0,02 y p<0,01 (Figura 2).
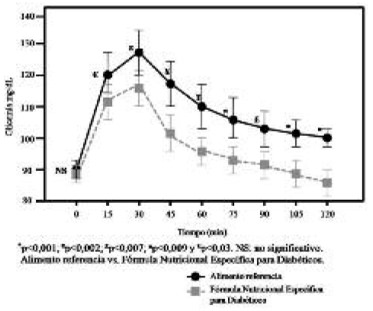
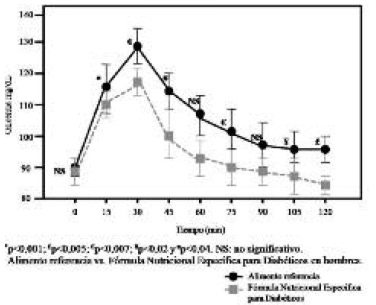
Así mismo, en el perfil glicémico de los hombres, se observa que la glicemia fue significativamente más baja para la fórmula enteral que para el alimento de referencia (pan blanco), en casi todo el periodo de prueba: p<0,001 al minuto 15; p<0,007 al minuto 30; p<0,04 al minuto 45; p<0,007 al minuto 75; p<0,02 al minuto p<0,005 al minuto 120 (Figura 3).
Área de Incremento bajo la curva, índice glicémico y comportamiento de la insulina plasmática: Como es esperable, el área bajo la curva del producto enteral 11718,20 ± 1112,38 fue significativamente menor que el alimento de referencia 13269,18 ± 1351,05 (p<0,001).(Tabla1).Al comparar por género, no se encontraron diferencias significativas (p>0,05) en ninguno de los dos alimentos. El índice glicémico de la fórmula enteral resultó en 63,33±(5,22)para el total de los sujetos, igualmente sin diferencias significativas entre género (p>0,05). (Tabla 1).

No hubo diferencias significativas en la media de insulina basal 13,7 μU/mL ± (3,4), ni post-.prandial de (2 h) 22,9 μU/mL ± (5,3) posterior a la ingesta de la fórmula enteral (FE) ni en las medias de insulina correspondientes al consumo del alimento de referencia (PB) con un valor de 12,64 ± (3,53) μU/mL (basal) y post-prandial 16,33 μU/mL ± (6,62) respectivamente. Tampoco se mostraron diferencias significativas entre ambos alimentos al comparar la media de insulina en el minuto 120.
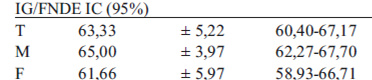
Los resultados de la presente investigación confirman que el comportamiento de la glicemia post-prandrial en sujetos sanos fue más disminuido y favorable, como era de esperarse, posterior a la ingesta de la formula evaluada (FE), en relación al producto de referencia (PB), así mismo se encontraron medias menores de IAUC en el perfil glicémico tras la ingesta de la (FE) al compararlo con la curva glicémica del (PB).El índice glicémico de la fórmula resultó intermedio y más bajo al compararlo con el índice glicémico del pan blanco reportado en la literatura(80-96).(15) Sin embargo, no se apreciaron diferencias significativas en las concentraciones de insulina plasmática en el minuto 120 posterior a la ingesta de ambos productos.Diversos estudios demuestran un mayor efecto del control de la glicemia post-prandrial en diabéticos tras la ingesta de las fórmulas específicas para diabetes (FED) comparado con fórmulas estándar sin fibra, con fórmulas isocalóricas o con cargas calóricas aún más bajas (8). El ensayo de Alish y col. (8) ha demostrado una menor variabilidad glicémica, junto a unos menores requerimientos de insulina. Los mecanismos implicados en reducir la glicemia post-prandial involucran en parte a la fibra dietética, principalmente la de tipo soluble, (16) la cual influye en la velocidad de absorción intestinal de glucosa; pues esta al entrar en contacto con el agua intestinal posee la capacidad de formar geles que dificultan la transferencia de la glucosa hacia las células intestinales (16). La principal fuente de fibra de las FED son usualmente las frutas y vegetales; y sus niveles son relativamente más altos que en las fórmulas estándar (8).
En un estudio se explica que el aumento en la viscosidad producido por la fibra, especialmente del tipo goma guar, betaglucano, psillyum, glucomannan, o pectina, reduce la respuesta post-prandrial y el índice glicémico (IG) de los alimentos así como se ha demostrado que la calidad de este componente, en lugar de la cantidad, ejerce una influencia más importante sobre la glucemia postprandial y el IG (17). De hecho, en una investigación con 121 alimentos de distinta composición, pero equivalente en el contenido energético, cantidades crecientes de fibra predijeron una relación positiva, en lugar de inversa entre la glicemia y la insulinemia(18). El total de fibra dietética de la fórmula evaluada en este estudio es de (3,6 g/100 g), derivada de los polisacáridos de la soya y fructooligosacáridos, de esta última fuente de fibra y su efecto sobre la variabilidad glicémica sería preciso mayor cantidad de estudios.
En otro contexto, a pesar del debate que existe sobre el uso y la cantidad de fructosa en las FED se conoce que el índice glicémico de la fructosa es bajo (IG= 15) (7), por tanto una de las razones para que la respuesta glicémica de la fórmula evaluada en este estudio haya resultado más disminuida, posiblemente se deba a la lenta velocidad de absorción de este carbohidrato comparada con el producto de referencia (PB) cuyo índice glicémico ha sido reportado entre (80 y 96), o con la sacarosa (con un IG = 59) (15). No obstante, existe cierto interés clínico en establecer la seguridad y la tolerancia de los niveles relativamente altos de grasa y de fructosa en las FED en pacientes con trastornos subyacentes de dismotilidad tales como el síndrome de colon irritable, trastornos en el metabolismo lipídico, y acidosis láctica (7).
En un estudio aleatorizado y controlado en pacientes diabéticos tipo 2, en donde compararon la respuesta glicémica de 2 fórmulas nutricionales líquidas específicas para diabéticos, la primera endulzada con edulcorante artificial (sucralosa), y la segunda con fructosa, encontraron una respuesta glicémica significativamente (P=0,1) inferior a favor del primer producto (20).
Por otra parte, en dos estudios separados aleatorizados, doble ciego que incluían 3 tratamientos cruzados en pacientes diabéticos; donde evaluaron el impacto de la cantidad y tipo de carbohidrato consumido, demostraron áreas bajo la curva y respuestas glicémicas más atenuadas para la fórmula edulcorada con fructosa en relación a la fórmula estándar; inclusive también resultó ligeramente más disminuida (no en forma significativa) al compararla con el resto de los tratamientos de distintos tipos de hidratos de carbono (21).
De igual forma, esta fórmula contiene uno de los polioles denominado maltitol. En uno de estos trabajos con FED edulcoradas con isomaltosa, han demostrado una reducción del perfil glicémico posterior a su consumo, y una respuesta glicémica similar a otras fórmulas de diversas fuentes de hidratos de carbono (21). Autores reportan que la isomaltosa, es de bajo índice glicémico (IG= 32), de lenta absorción, la cual posee una tasa de hidrolización de 20 -25% más lenta que la sacarosa (22). Sin embargo, por las posibles diferencias entre la molécula de maltitol e isomaltosa, se requieren más estudios que indaguen el efecto de la respuesta glicémica de los polioles en los productos destinados a diabéticos.
Otra de las fuentes de carbohidrato en esta fórmula es una molécula de maltodextrina modificada. Se ha reportado en FED con esta molécula, mayor resistencia a la digestión de la amilasa en el intestino corto (21). Por otra parte, nuestros resultados se correlacionan con los reportados por Gattas (12) en su investigación de 4 fórmulas enterales en sujetos sanos, evidenciando respuestas glicémicas más disminuidas, e insulinémicas elevadas, atribuido al tipo de proteína de las fórmulas. Al respecto, se conoce que las proteínas, debido al efecto de las incretinas tienen la capacidad de elevar la respuesta insulínica sin incidir sobre la respuesta glicémica (23). Estudios en sujetos sanos, han informado niveles de insulina plasmática ligeramente más altos, después de la infusión nasogástrica continua de una fórmula con aminoácidos, comparado con dietas isonitrogenadas e isocalóricas que contienen oligopéptidos o proteína entera (12).
De igual manera diversas investigaciones han demostrado el efecto beneficioso de las FED en parámetros metabólicos como la hemoglobina glicosilada, en fórmulas con alto contenido en ácidos grasos monoinsaturados, basado en el hecho de que la sustitución de los hidratos de carbono por este tipo de grasas producen una respuesta glicémica e insulínica más atenuada (7). Finalmente, sería de gran utilidad para el campo de la nutrición clínica determinar no solo el comportamiento de la glicemia e insulina plasmática sino también el índice glicémico de otras fórmulas poliméricas específicas para diabéticos; pues este indicador se ha considerado útil también en la prevención de enfermedades cardiovasculares en estos pacientes.
Limitaciones del estudio: Únicamente fueron medidoslos tiempos 0 min y 120 min en la muestra de sangre venosa, razón por la que no se logró cuantificar la curva insulínica completa, así como tampoco se realizaron pruebas con otro producto de referencia (solución glucosada), lo cual no permitió calcular el índice glicémico del pan blanco.En próximas investigaciones sería conveniente incluir ambos productos de referencia con este fin.
En este estudio la respuesta glicémica en sujetos sanos, posterior a la ingesta de la fórmula evaluada, resultó más baja con respecto a la del alimento de referencia en todos los tiempos de la curva, sin diferencias significativas en cuanto a género. El índice glicémico resultó en un valor intermedio al compararlo con los rangos de valores publicados en la literatura para el pan blanco,lo que presume que los carbohidratos que componen la fórmula son de una velocidad de absorción más lenta que el producto de referencia, produciendo una menor concentración de glucosa en sangre y una disminución más rápida de sus niveles durante las primeras 2 h; de igual forma no se observaron picos extremos o fluctuaciones en las concentraciones de glucosa, presumiendo un efecto prolongado en la saciedad, lo cual sería también interesante indagar. Así mismo, no fueron observadas diferencias significativas con respecto a los niveles de insulina post-prandrial en el minuto 120 tras el consumo de ambos productos, lo cual sugiere su uso posiblemente adecuado en los pacientes con Diabetes, sin embargo, por la tendencia a la alza en la insulina post-prandial con respecto a la fórmula, se recomiendan más estudios al suministrarla en sujetos con resistencia a la insulina o con hiperinsulinismo.
Es menester evaluar a futuro otras fórmulas enterales específicas con carbohidratos de liberación prolongada en sujetos diabéticos e incluso analizar la variabilidad glicémica e insulínica en largos períodos de consumo, con el fin de estudiar indicadores metabólicos como la hemoglobina glicosilada y correlacionarlo con la prevención de complicaciones en pacientes con esta patología.
Al Centro de Investigaciones “Dr. Félix Gómez”, al Departamento de Medicina de la Universidad de Córdoba, y al aporte técnico de Lcda. Michelle Angarita y del Dr. Edgardo Mengual por su colaboración en este estudio.
Recibido: 18-09-2015
Aceptado: 18-02-2016