El turbot es un pez plano (Scophthalmus maximus), es uno de los peces que se adapta muy bien al cultivo intensivo en granja. Es necesario conocer sus propiedades fisicoquímicas-bioquímicas-tecnológicas y cómo éstas cambian durante su almacenamiento una vez que han sido cosechados. El objetivo de este estudio fue evaluar la composición centesimal, propiedades bioquímicas, fisicoquímicas y funcionales, y cómo se ven influidas por el almacenamiento a 4ºC durante 16 días. Se determinó su composición proximal, electroforesis en geles de poliacrilamida desnaturantes (PAGE-SDS), estabilidad térmica proteica a través de calorimetría diferencial de barrido (DSC). Se evaluó pH, nitrógeno básico volátil total (NBV-T), pérdida por goteo, textura, capacidad de retención de agua (CRA), emulsificación (CE) y gelificación (CG). El análisis proximal fue: humedad 76,3%; proteínas 19,6%; lípidos 2,71%; cenizas 1,3%. Se encontraron dos transiciones térmicas (DSC) a 47,5°C (miosina) y 76,9ºC (actina). PAGE-SDS mostraron perfiles correspondientes a proteínas miofibrilares y sarcoplasmáticas y durante el almacenamiento no se vieron alterados. El pH cambió desde 5,9 a 6,6; las NBV-T variaron desde 20,0 a 39,5 mg NBVT/100 g músculo al día 16. CRA presentó valores de 10,5% y llegando al final a 58,1%, sin embargo no presentó CG. La CE y CRA aumentaron por el almacenamiento debido a cambios conformacionales de las proteínas. El esfuerzo de compresión fluctuó entre 111,2 a 106,0 N; el esfuerzo de cizalla fue disminuyendo en el tiempo de almacenamiento desde 148,6 a 95,2 N. La pérdida por goteo varió entre 1,7% a 2,5%. El estudio de almacenamiento refrigerado por 16 días, permitió concluir que el parámetro de frescura de NBV-T, sobrepasa el límite permitido de comercialización a los 14 días de almacenamiento, determinando de esa forma su vida útil.
Palabras clave: Turbot (Scophthalmus maximus); refrigeración, frescura, propiedades funcionales, calidad
The turbot (Scophthalmus maximus) is a kind of flatfish that is well adapted to intensive farm culture. After the harvest it is necessary to know the physicochemical, biochemical and technological properties and if during the refrigerated storage, changes of these properties are developed. The main objective of the study was the assessment of the proximal composition, the biochemical, physicochemical and functional properties, and how they are influenced during the 16 days storage at 4º C. Parameters such as centesimal composition, PAGE-SDS, and protein thermal stability through a DSC were carried out. pH, total volatile base-nitrogen (TVBN) dripping, texture, holding water capacity (WHC), emulsification (EC) and gelification (GC) were also determined. Results for the proximal composition were: humidity 76,3%; fat content 2,71%; proteins 19,6%; and ashes 1,3%. Two different thermal transitions at 47,5°C (myosin) and 76,9°C (actin) were observed. The PAGE-SDS showed profiles corresponding to myofibrilars and sarcoplasmatic proteins, which presented no changes during the storage. pH experimented an increase from 5,9 to 6,6; TVB-N showed a variation from 20,0 to 39,5 mg TVB-N/100 g of muscle at the day 16. The WHC started with a 10,5% and ended in 58,1%; no GC was observed. The increase of the EC and WHC during the storage was due to conformational changes of proteins. The compression force presented a fluctuation between 111,2 and 106,0 N and the shear strain decreased during the storage from 148,6 to 95,2 N. The dripping showed a variation between 1,7% and 2,5%. According to the results of the storage during 16 days at 4ºC, the NBV-T content determined a shelf life of 14 days.
Key words: Turbot (Scophthalmus maximus); refrigeration, freshness, functional properties, quality.
Departamento de Ciencia de los Alimentos y Tecnología Química, Facultad de Ciencias Químicas y Farmacéuticas, Universidad de Chile. Fundación Chile. Inspectorate Griffith Chile S.A. Chile
El turbot o rodaballo (Scophthalmus maximus) de cultivo, es comercializado principalmente como frescorefrigerado y en menor cantidad como productos vivos y congelados, es un recurso proveniente de la acuicultura, al que se hace interesante conocer sus características tecnológicas, propiedades bioquímicas, fisicoquímicas y su estabilidad en el tiempo de almacenado durante la refrigeración. La distribución geográfica del turbot se extiende desde el norte de África hasta el Atlántico norte (Noruega), incluyendo el mar Mediterráneo (1).
El deterioro del músculo de pescado magro durante su almacenamiento o elaboración es principalmente el resultado de la desnaturalización sus proteínas miofibrilares (2, 3, 4). El grado de deterioro de un producto marino fresco-refrigerado, puede ser evaluado mediante una inspección visual, determinación de índices químicos y bioquímicos para determinar la frescura en pescados como el pH, nitrógeno básico volátil total (NBV-T) (5). En la carne de pescado recién eviscerada se advierte una reacción débilmente alcalina (pH 7,0 a 7,4); en el transcurso del proceso del rigor mortis se alcanzan valores tan bajos como 5,9 a 6,3, los cuales durante el almacenamiento llegan a la neutralidad y la sobrepasan (pH 7,0 a 8,0) (6). Dentro de los índices bioquímicos objetivos para determinar el estado de frescura de los peces están las bases volátiles totales: donde se determina, principalmente, la presencia de amoníaco, trimetilamina y dimetilamina, y se expresa como NBVT (5, 6, 7). El máximo permitido por la legislación chilena es de 30 mg/100 g (8). Conociendo las propiedades fisicoquímicas, bioquímicas, funcionales y de frescura es posible establecer las condiciones de almacenamiento adecuadas de una determinada especie, así como también alternativas tecnológicas de procesamiento. Dado el planteamiento anterior, el objetivo de este estudio fue caracterizar bioquímica, fisicoquímica y funcionalmente filetes de turbot recién cosechados y sus modificaciones durante el almacenamiento a 4°C.
Materia prima: El turbot (Scophthalmus maximus), fue proporcionado por la empresa Granjamar S.A con 12 h de sacrificio, desde sus centros de cultivo ubicados en Tongoy-Chile, al Laboratorio de Tecnología de Alimentos del Departamento de Ciencia de los Alimentos y Tecnología Química de la Facultad de Ciencias Químicas y Farmacéuticas de la Universidad de Chile. Se recibieron las muestras en cajas de poliestireno expandido y cubiertos con hielo, donde se procedió a la evisceración y fileteado. El peso promedio de los individuos fue de alrededor de 1,5. El rendimiento obtenido para los procesos de evisceración y fileteado fue de 25,9 %. Posteriormente los filetes fueron dispuestos en bolsas plásticas previamente rotuladas para sus respectivos análisis y se almacenaron en refrigeración a 4°C hasta su análisis. El tamaño de muestra para cada estudio fue de 18 individuos, se realizó este estudio en dos oportunidades. En cada cinética realizada se hizo un seguimiento durante 16 días, tomando muestras cada dos días. Cada parámetro fue medido en triplicado.
Los contenidos de materia seca a 105ºC (método 945.15), cenizas (método 920.153), proteína cruda (método 945.18) usando el factor 6,25 y extracto etéreo (método 945.16), se evaluaron según lo descrito por la AOAC (9).
El proceso de extracción realizado se basó en la técnica descrita por Suzuki (2) y Kawashima et al. (10). Las proteínas sarcoplasmáticas de la carne de turbot se obtuvieron lavando el músculo con amortiguador fosfato de sodio de fuerza iónica I=0,05 y pH=7,5, solubilizando así las proteínas sarcoplasmáticas (PSS). Luego las proteínas miofibrilares (PMS) se obtuvieron solubilizando el insoluble de la anterior extracción con una solución amortiguadora de I=0,5 y pH=7,5. Cada etapa de solubilización fue seguida por una centrifugación a 10.000 g durante 30 minutos a 4°C. La proteína del sobrenadante (PSS y PMS) fue cuantificada por el método descrito por Layne (11), posteriormente fueron sometidas a electroforesis en geles de acrilamida en condiciones desnaturantes (PAGE-SDS) con o sin condiciones reductoras.
Para el análisis electroforético se prepararon geles de poliacrilamida al 12 % (p/v) en presencia de dodecilsulfato sódico de acuerdo a Laemmli (12). Se prepararon geles de 3 mm de espesor y 6 cm de altura. Se dejaron polimerizar a temperatura ambiente, posteriormente se agregó el gel concentrador de 2 cm de altura, al 4 % (p/v) de poliacrilamida, en presencia de SDS, dejándolo polimerizar a temperatura ambiente. Para la corrida del gel se utilizó una solución amortiguadora de trizma base-glicina; pH 8,2. En cada bolsillo de la electroforesis se inyectó aproximadamente 8 μg de proteína y en un bolsillo adicional se agregó 3 μL de una solución que contenía una mezcla de proteínas estándar preteñidas: miosina (205 kDa), beta.-galactosidasa (116 kDa) b-fosforilasa (97 kDa), albúmina de suero bovino (66 kDa), ovoalbúmina (45 kDa), anhidrasa carbónica (29 kDa) y a-lactoalbúmina (14 kDa) (Bio-Rad, USA).
Adicionalmente se inyectaron de la misma forma muestras adicionadas de 2-mercaptoetanol (2-ME). La electroforesis se realizó aplicando 15 mA mientras la muestra atravesó por el gel concentrador y 40 mA hasta que el frente del colorante alcanzó el final del gel. Se procedió a tinción de las proteínas en los geles según lo descrito por Weber y Osborn (13).
Se utilizó el calorímetro diferencial de barrido (DSC) Metler Toledo, el cual fue calibrado entre 10 y 100ºC. Luego se pesaron entre 10 y 15 mg en una cápsula la cual fue sellada herméticamente; como referencia se utilizó una cápsula con aire. A continuación se procedió a explorar la muestra utilizando una razón de calor de 10ºC/min a un flujo energético de 0,1 a 0,2 mcal/seg. A través del software del equipo se calcularon las temperaturas máximas de desnaturalización y las áreas de las endotermas. El método de medición para la determinación de los termogramas se basó en lo descrito por Hastings et al. (14).
Se determinó pH de acuerdo según Woyewoda et al. (15). El nitrógeno básico total fue determinado a través de la Norma Chilena NCh2668.Of2001(16). La pérdida por goteo (“dripping”) fue evaluado de acuerdo a Wierbicki y Deatherage (17) modificada, se utilizaron cilindros de 2 cm de alto por 2 cm de diámetro, los cuales se colocaron sobre un papel filtro Whatman Nº 2 en el cual se recibe el liquido exudado, la compresión realizada en los cilindros fue del 90 % a una velocidad de 12,7 cm/min, siendo el parámetro medido la diferencia de peso en el papel filtro Whatman Nº2 antes y después de la compresión; la fuerza de compresión utilizada en esta medición fue un parámetro también registrado para su análisis.
Se determinó la capacidad de retención de agua (CRA) del músculo de turbot, de acuerdo a lo descrito por Swift y Ellis (18). El resultado se expresó como porcentaje de aumento del peso de pescado. La capacidad de emulsificación (CE) fue determinada de acuerdo a la técnica descrita por Webbs et al. (19). La capacidad de gelificación (CG) se determinó de acuerdo a Cheng et al. (20) y Suzuki (2). Las propiedades texturales se evaluaron midiendo la fuerza de compresión (CS), fuerza de cizalla (SS), de acuerdo a Lee y Toledo (21) y según a Owusu-Ansah y Hultin (22).
Los resultados obtenidos fueron analizados con el software Statgraphics plus ver 4.0, mediante el cual se realizó un análisis de varianza (p<0,05) y comparación múltiple de medias por el test de Duncan.
En relación a la composición química de los filetes de turbot, éstos presentaron un contenido de humedad de 76,3±2.2%, proteínas 19,6±0,2%, extracto etéreo 2,7±0,1 y cenizas 1,3±0,0. Los valores obtenidos en este estudio son similares a los entregados en la literatura (23), se describen valores de humedad entre 76,8 a 79%, proteínas entre 18,1 a 20,3%; extracto etéreo entre 1,5 a 2,5 % y cenizas entre 1,2 a 1,4%.
El perfil electroforético en condiciones desnaturantes de las PSS de turbot se presenta en la Figura 1a en la cual se pueden observar alrededor de 18 polipéptidos, las principales bandas encontradas fueron: A: 85,1 kDa; B: 71,2 kDa; C: 58 kDa; D: 34,7 kDa; E: 31 kDa; F: 25,5 kDa; G: 14,6 kDa y H: 6,7 kDa. Por otra parte en la Figura 1b se observa las PSS en presencia de 2-ME, cuyas principales masas moleculares fueron: A: 103,4 kDa; B: 50,7 kDa; C: 38,4 kDa; D: 18,5 kDa; E: 8 kDa y F: 2,8 kDa. Se observan bandas con masas moleculares menores y también en inferior cantidad que en las condiciones reductoras, para las proteínas sarcoplasmáticas, lo cual está señalando que existen algunos polipéptidos estabilizados por puentes disulfuro. En este estudio no se encontraron cambios en los perfiles de las proteínas sarcoplasmáticas. Mackie et al. (24) observaron cambios muy leves en los perfiles proteicos de las proteínas sarcoplasmáticas separadas por PAGE-SDS en pescados, al igual que Aubourg et al. (25) en PS de turbot refrigerado. Los cambios en la composición de las proteínas sarcoplasmáticas pueden ocurrir a consecuencia del cambio en el pH del músculo y la disminución en la capacidad de retención de agua, causando que proteínas solubles puedan ser lixiviadas hacia fuera.
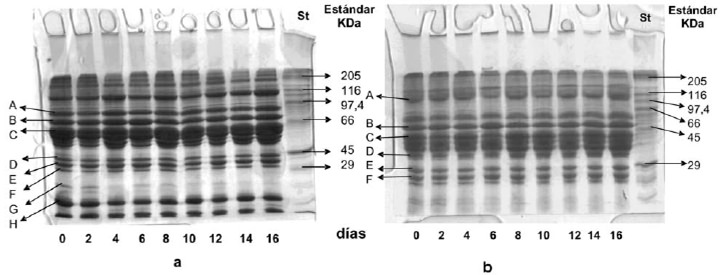
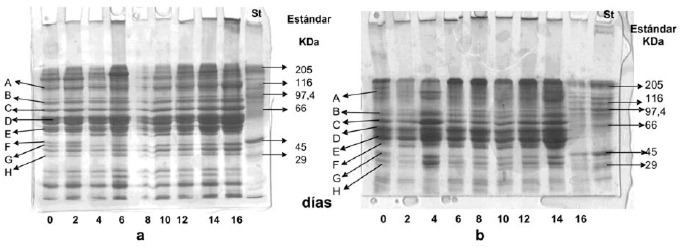
En la figura 2a se observa la PAGE-SDS de PSM, donde se encontraron los siguientes polipeptidos principales: A: 120,6 kDa; B: 83,3 kDa; C: 75 kDa; D: 63 kDa; E: 52,7 kDa; F: 38,7 kDa; G: 35,6 kDa y H: 28,3 kDa. Por otra parte en la Figura 2b se observan alrededor de 15 polipéptidos principales cuyas masas moleculares fueron: A: 146,6 kDa; B: 87,9 kDa; C: 72,6 kDa; D: 62,3 kDa; E: 51,2 kDa; F: 41,5 kDa; G: 31,3 kDa y H: 21 kDa. Se observó también que al término del almacenamiento la intensidad de las bandas fue menor en relación al resto de los días de almacenamiento, este comportamiento fue similar al reportado por Aubourg et al. (25)
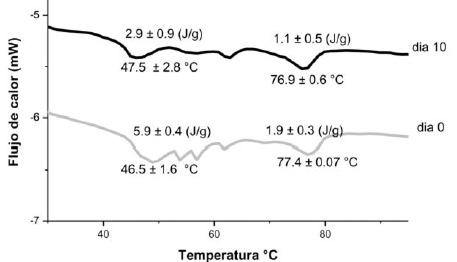
La calorimetría diferencial de barrido (DSC) ofrece un método directo para el estudio de transiciones térmicas de proteínas musculares (26). Es importante destacar que para el análisis de las propiedades térmicas los resultados que entrega el DSC son endotermas que permiten conocer la temperatura de desnaturalización o de transición térmica (Td), el área de la endoterma (A), siendo esta la unión de los extremos de la endoterma, y la cooperatividad, esta última se analiza mediante el ancho que presentan las endotermas en su altura media (27). En la Figura 3 se puede observar las endotermas presentadas por el músculo de turbot al inicio y en el día décimo del almacenamiento refrigerado, se observa claramente, en ambas fechas de estudio, dos transiciones endotérmicas. La primera transición térmica presentó una temperatura de desnaturalización de 47,5 + 2,8 °C en el día 0 y de 46,5 + 1,6 °C al día 10. Para la actina si se registró un aumento en la temperatura de transición de aproximadamente 0,5 °C presentando ésta, por lo tanto, mayor estabilidad térmica. Las áreas de la endoterma disminuyeron durante el almacenamiento refrigerado para la miosina y actina desde 5,9 + 0,4 (J/g) hasta 2,9 + 0,9 (J/g) y desde 1,9 + 0,3 (J/g) hasta 1,1 + 0,5 (J/g), respectivamente (Figura 3). Del termograma se observa también que los picos tienden a ser menos definidos en el día 10, con respecto al día 0, lo cual sería señal de pérdida de cooperatividad entre las proteínas durante el almacenamiento (27).
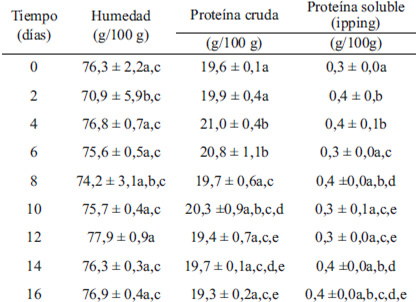
Se controló el contenido de humedad y proteínas durante todos los tiempos del almacenamiento en refrigeración. En la Tabla 1, se puede observar que el contenido de humedad tuvo pocas variaciones a lo largo de este estudio y fluctuó entre 70,9 + 5,9 g/100 g y 77,9 + 0,9 g/100 g. En cuanto al contenido proteico este varió entre 19,3 + 0,2 g/100 g y 21,0 + 0,5 g/100 g. Se encontraron diferencias significativas entre los días 4 y 6 y el resto de los tiempos de este estudio, excepto por el día 10, el que a su vez, difiere de los días 12 y 16. Las variaciones en el contenido de proteínas durante el tiempo de almacenamiento pueden deberse a la pérdida de proteínas sarcoplasmáticas por exudación por goteo. La Tabla 1 muestra además la variación de las proteínas solubles provenientes del exudado de filetes de turbot a través de los 16 días de este análisis. Se observa que en el día 8 disminuye el contenido de proteínas totales aumentando las proteínas sarcoplasmáticas, a su vez, en el día 10 aumentan la proteínas totales y disminuyen las sarcoplasmáticas. En los últimos días de este estudio la tendencia mostrada por ambos resultados de proteína cruda y soluble (proveniente del “dripping”) es a la disminución de las proteínas totales y al aumento las proteínas solubles. En la Tabla 2 se puede observar un aumento del valor de pH de los filetes de turbot hasta el día 4 para luego disminuir y tender a estabilizarse en los últimos días de este estudio. Los valores de pH fluctuaron entre 5,9 + 0,5 en el tiempo 0 y 6,6 + 0,1 en el día 16. El pH en productos marinos en el momento posterior a la muerte tiende a disminuir, debido a que se utiliza la vía glicolítica en el músculo, con la consiguiente producción de ácido láctico (28).
El metabolismo post-mortem de los compuestos nitrogenados en la carne de pescado, es el principal responsable de la gradual pérdida de frescura de los músculos y de apariencia de signos de putrefacción. Al analizar la Tabla 2 se observa que existen diferencias significativas entre los tiempos 0 y 2 y el resto de los días de este estudio, además los días 4 y 6 presentaron diferencias significativas con los días 8 y 16. Todos los tiempos difieren del día 16. Se aprecia un paulatino aumento de los valores hasta el día 14, a partir del cual, el aumento es más drástico. En el tiempo 0 se registró un valor de 20,04 + 1,95 mg NBV-T/100g músculo para las bases volátiles totales terminando este estudio con 39,5 + 2,3 mg /100g músculo el día 16.
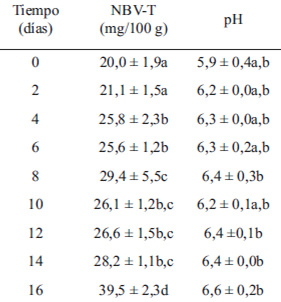
Por otra parte al evaluar la pérdida por goteo o “dripping” de los filetes de turbot almacenados por 16 días a 4ºC se puede observar en la Figura 4 que la pérdida de agua de los filetes muestra una tendencia ascendente hasta el día 10 y descendente en los últimos días de estudio, la muestra fresca presentó un dripping de 1,7+0,4% y en el día 16 un 1,6+0,5%. Se obtuvo el valor máximo en el día 10 con 2,5 + 0,3%. Junto con disminuir este parámetro disminuye también la fuerza máxima aplicada a las muestras en cada día de estudio (Figura 4b), los valores de la fuerza aplicada al inicio y final de este estudio fueron 148,6±27,3 N y 95,2± 7,3 N respectivamente. El menor valor se registró el día 10 con un valor de 83,7±12,4 N.
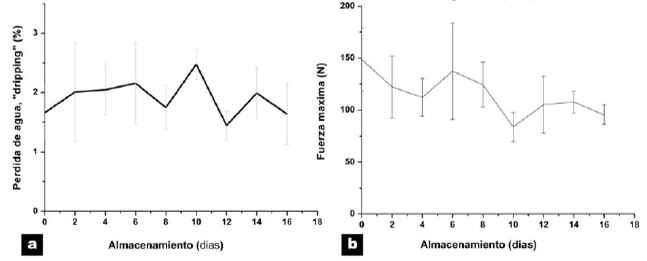
En la Figura 5 se pueden observar los resultados de CRA. Las proteínas de turbot, a tiempo cero presentaron un valor de 105±1% de CRA y tendiendo a aumentar durante el tiempo del almacenamiento llegando a valores de 144±4% en el día 16 de almacenamiento, lo cual está señalando que esta propiedad es significativamente favorecida (p<0,05) durante el almacenamiento bajo estas condiciones. Al comparar estos resultados frente a otros estudios se puede indicar que el músculo de turbot presenta una mediana CRA, ya que análisis efectuados en distintas especies presentan valores superiores a los encontrados en el presente estudio como para la carne de jibia (Dosidicus gigas) (29); o similares a los encontrados en reineta (Brama australis) (30).
Para la propiedad de capacidad emulsionante de las proteínas de turbot se registraron variaciones en los valores de 1.481,6+83,4 en el día 0 y de 3.001,2+22,0 g de aceite emulsionado/g proteína total en el día 16. La tendencia de esta propiedad es a mantenerse estable hasta el día 12 a partir del cual comienzan a aumentar, que al igual que la CRA estaría indicando que para favorecer esta propiedad es necesario cierto grado de desnaturalización de las proteínas. Los valores de CE para turbot son altos y están dentro de lo que se ha descrito para algunas especies de proteínas de origen marino como la jaiba (Homalaspis plana) (31) y superiores en relación a la reineta (30) y a la jibia (29). Por otra parte el músculo de turbot no presentó capacidad gelificante, sus proteínas formaron geles agregados opacos.
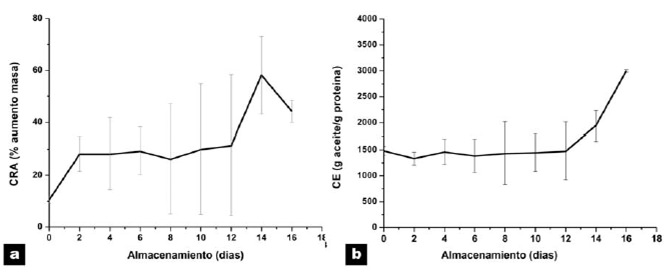
En cuanto a las propiedades texturales se evaluaron el esfuerzo de compresión y de cizalla durante todo el tiempo de almacenamiento en refrigeración. En la Figura 6a se presenta la variación del esfuerzo de compresión promedio a través del tiempo, en filetes de turbot refrigerados a 4ºC. Los valores encontrados en el tiempo 0 y en el final del estudio fueron 111,2+34,9 N y 106,0+7,7 N, y se puede observar que los valores en general van disminuyendo, aun cuando se puede decir que no siguen una tendencia definida. Por otra parte en la Figura 6b se muestra el comportamiento de los filetes de turbot con respecto al esfuerzo de cizalla durante su almacenamiento refrigerado. Se observa que en general los valores disminuyen con el transcurso del tiempo excepto en los días 4 y 6 donde los valores aumentan incluso sobre el resultado inicial (47,0+12,6 N). En el día 8 se registra una disminución en los resultados con un posterior aumento hacia el día 10 para luego disminuir hasta el día 16 en el cual se registraron los valores promedio más bajos con 26,6+6,3 N. El valor más alto se encuentra en el día 4 con un promedio de 54,1 + 3,5 N.
El turbot (Scophthalmus maximus) es un pescado con bajo contenido graso y con un buen aporte proteico lo que lo hace muy saludable y nutritivo. El análisis de los perfiles proteicos (PAGE-SDS) no presentó diferencias para la composición de las proteínas miofibrilares y sarcoplasmáticas de los filetes de turbot durante los 16 días de almacenamiento refrigerado. Los autores Aubourg et al. (25) no encontraron variaciones en los perfiles electroforéticos con SDS al extraer proteínas sarcoplasmáticas y miofibrilares durante su almacenamiento refrigerado, excepto en una banda en la zona de 20 kDa, cosa que no ocurrió en este estudio. Por otra parte se puede decir que las proteínas de turbot (tanto las sarcoplasmáticas como las miofibrilares) poseen polipéptidos que están unidos por puentes disulfuro. En cuanto a la estabilidad térmica de sus proteínas se encontró que la miosina tiene una temperatura de desnaturalización de 47,5+2,8 °C, esta transición está compuesta por varias superpuestas subtransiciones resultantes de la desnaturalización térmica de diferentes dominios de miosina (14, 25, 32). La segunda transición correspondiente a la actina que tuvo un máximo de 76,9 + 0,6 °C en el día 0 y de 77,4 + 0,07 °C al día 10, la transición de la actina ocurre a una mayor temperatura presentando esta proteína una mayor estabilidad térmica (14). Estos resultados son concordantes con otros autores (26, 30) que han descrito transiciones térmicas más bajas para la miosina y más altas para la actina. A través de DSC, y considerando la entalpía de desnaturalización se puede observar un grado de desnaturalización de las proteínas encontradas al día 14 del almacenamiento, dado que el área bajo la curva (entalpía) se ve reducida en un 51% para la endoterma correspondiente a la miosina y en un 42% para la transición correspondiente a la actina. Coincidente con este grado de desnaturalización el parámetro de frescura de NBV-T sobrepasa el límite permitido de comercialización a los 16 días de almacenamiento, y el pH aumentó a valores muy cercanos a la neutralidad. Por otra parte se produce un “dripping” constante del orden promedio de 1,9% de pérdida por goteo, la fuerza utilizada para evaluar el “dripping” tendió a disminuir, lo cual está demostrando un deterioro del músculo de turbot durante su almacenamiento.
Ésta pérdida de estructura evaluada a través del DSC coincide también con cambios significativos encontrados en las propiedades funcionales de CRA y CE las cuales se ven favorecidas asociadas a un grado de desnaturalización de las proteínas. Finalmente la fuerza de compresión fue irregular probablemente debido a las membranas que rodean las fibrillas del músculo de pescado, no así la fuerza de cizalla que tendió a disminuir con el tiempo de almacenamiento refrigerado. Se puede inferir que el almacenamiento refrigerado de filetes de turbot produce ablandamiento en sus tejidos. Dado que el músculo de turbot forma agregados proteicos y no un gel, se recomienda si se quiere seguir el estudio de esta propiedad la adición de agentes gelificantes y/o la purificación de las proteínas miofibrilares. De acuerdo a los índices estudiados en esta investigación el turbot puede ser consumido hasta el día 14 en condiciones de refrigeración, este resultado coincide con el estudio realizado por Özogul et al. (33) y Aubourg et al. (25) quienes determinaron un límite de consumo entre 12 a 15 días almacenado en hielo.
Recibido: 27-01-2011
Aceptado: 15-05-2011