Los frutos maduros de tres especies de algarroba procedentes de Bolivia (Prosopis chilensis (Molina) Stunz, P. alba Grisebach y P. nigra (Grisebach) Hieronymus) y una de Brasil (P.juliflora (SW) DC) fueron estudiadas para determinar algunos factores nutricionales y antinutricionales. P. nigra presentó los niveles mas elevados de proteína bruta (11,33 g/100g materia seca-MS), cenizas (4,12 g /100g MS) y P. juliflora los menores niveles de lípidos (0,79 g /100g MS), proteína bruta (8,84g / 100g MS), fibra alimentaria (40,15 g/100g MS), el nivel más elevado de azúcares no reductores (52,51 g/100g MS) y la mayor digestibilidad* proteica in vitro (66,45%). La cantidad de inhibidor de tripsina (0,29 a 9,32 UTI / mg MS) fue inferior al de la soya cruda, en la cual la P. juliflora se destacó. Con relación a la saponina, hemaglutinina y polifenoles, los niveles encontrados son considerados bajos. Los niveles encontrados de nitrato son más elevados que los reportados en arvejas y frijoles, siendo la P. chilensis la que presentó el mayor valor (2,92g NO3 - /kg MS). Los niveles de fitatos en las muestras variaron de 1,31 a 1,53 g/100 g MS.
Palabras clave: Prosopis sp., fruto de algarroba, harina, nutriente, antinutriente.
The mature fruits of three species of algarroba found in Bolivia (Prosopis chilensis (Molina) Stunz, P. alba Grisebach y P. nigra (Grisebach) Hieronymus) and of one of Brazil (P. juliflora (SW) DC) were analysed for some nutritional and antinutritional factors. P. nigra showed the highest levels of crude protein (11.33 g/100g dry matter-DM) and ashes (4,12 g/100g DM). P. juliflora presented the lowest levels of lipids (0.79 g/100 g DM), crude protein (8.84 g/100 g DM) and dietary fiber (40.15 g/100g DM), and the highest levels of non reducing sugar (52.51 g/100 g DM) and in vitro protein digestibility (66.45%). Trypsin inhibitors concentration (0.29 to 9.32 UTI / mg DM) was inferior to that of raw soy; P. juliflora presented the higher values. Regarding saponin, hemagglutinin and poliphenol values, the levels found are considered low. As for nitrates, the levels found were higher than those reported for peas and beans, with P. chilensis presenting the highest value (2.92 g NO3 -/kg DM). The levels of phytate varied from 1.31 a 1.53 g/100 g.
Key words: Prosopis sp., algarroba pod, flour, nutrient, antinutrient.
Universidad Federal de Lavras, Lavras- MG, Brasil, Universidad Autónoma Gabriel René Moreno (UAGRM), Santa Cruz de la Sierra, Bolivia
En Bolivia existe un árbol llamado cupesí, el cual recibe también los nombres de algarroba, mesquite, huarango, tacco y ong, perteneciente a la familia Fabaceae, la cual agrupa varias especies entre ellas Prosopis chilensis, P. alba y P. nigra y otras que crecen en la zona del Chaco, región que es compartida con Argentina y Paraguay. En la región nordestina de Brasil existe otra especie llamada algarrobeira (P. juliflora). Tanto en Brasil como en Bolivia, estas especies son encontradas de forma silvestre en regiones con poca precipitación.
Los frutos de las Prosopis spp. son considerados como importantes recursos alimenticios para humanos y animales en regiones áridas y semiáridas del mundo, con un contenido de proteinas entre 11 y 17 g/100g MS teniendo como aminoácidos limitantes tirosina y metionina/cistina y de 13 a 34 g/100g MS de carbohidratos, siendo el principal azúcar la sacarosa (1). Bravo et al. (2) indican en la pulpa de la vaina del P. pallida, niveles en g / 100 g MS, de proteína: 4,01, extracto etéreo: 0,71, cenizas: 3,67 . Los frutos de la algarroba P. chilensis presentan contenido de proteína de 11,48 g / 100 g MS y carbohidratos de 59 g/100 g MS (3).
Las leguminosas en general presentan factores antinutricionales y otras sustancias nocivas a la salud que imposibilitan la utilización de todo su potencial nutritivo por el organismo (4). De esta forma, granos no convencionales con uso potencial en la alimentación, deben ser analizados en dietas animales antes de su utilización en dietas humanas.
A pesar de que la harina de la vaina del Prosopis sea ampliamente utilizada en la elaboración de bebidas, dulces y substitutos del café (1,2,5), los trabajos relacionados al estudio de los antinutrientes en la harina son muy escasos. Las semillas de P. chilensis presentan niveles de fenoles libres totales mayores que muchas variedades de arvejas y niveles elevados de ácido fítico (6). Por otro lado, la mayoría de las ovejas alimentadas exclusivamente con los frutos de algarroba mueren (7).
El objetivo de este trabajo fue caracterizar los nutrientes y antinutrientes de la harina integral del fruto de tres especies de algarroba procedentes da Bolivia y una del Brasil.
Se utilizaron los frutos (vainas y semillas) de tres especies de algarroba procedente de Bolivia, Prosopis chilensis (Molina) Stunz, P. alba Grisebach y P. nigra (Grisebach) Hieronymus y una especie procedente del Brasil: P.juliflora (SW) DC.
Los frutos maduros de las algarrobas (P. chilensis, P. alba e P. nigra) fueron recogidos a mano entre los meses de octubre 2006 y febrero 2007 en Santa Cruz de la Sierra, Cordillera y Vallegrande en la región suroeste de Bolivia, y las de P. juliflora en Campina Grande, Paraiba, Brasil. Los frutos separados en 5 repeticiones fueron sometidos a secado en estufa de circulación de aire a 50oC por 72 h ± 24 h en el Laboratorio de Bromatología de la Facultad de Salud Humana de la Universidad Autónoma Gabriel René Moreno (Santa Cruz de la Sierra, Bolivia) y de Bioquímica del Departamento de Química de la Universidad Federal de Lavras (Lavras, Minas Gerais, Brasil).
Los frutos secos fueron procesados en molino de cuchillo del Laboratorio de Bioquímica del Departamento de Química de la Universidad Federal de Lavras (UFLA) y del Centro de Investigación Agrícola Tropical (CIAT-Santa Cruz de la Sierra, Bolivia), obteniéndose harina integral del fruto de la algarroba (HIFA).
La determinación del contenido de humedad, proteínas, extracto etéreo, cenizas, fibra alimentaria total (FA), fibra soluble (FS) y fibra insoluble (FI) se realizó de acuerdo con la metodología especificada por la AOAC (8).
El contenido de azúcares fue determinado utilizando el método de Somogy-Nelson (9, 10).
La digestibilidad proteica in vitro fue realizada mediante una combinación de dos métodos (11,12) utilizándose una cantidad de muestra proporcional a 8 mg de nitrógeno y una digestión con pepsina en medio ácido por una hora seguida de una digestión con pancreatina en medio neutro por tres horas. La digestibilidad encontrada de la caseína fue considerada como patrón.
La saponina fue extraída con etanol por agitación continua, a temperatura ambiente. La cantidad de saponina fue determinada por la reacción de la saponina con el anisaldehído, en medio ácido, produciendo un compuesto de color rojo, cuyo pico de absorbancia ocurre en 430 nm (13). La digitonina fue utilizada como patrón.
La actividad hemaglutinante fue determinada, mediante extracción de las hemaglutininas de las harinas empleándose solución salina, en agitación a temperatura ambiente (14). El análisis fue realizado en placa de micro titulación, haciéndose una serie de diluciones en la base 2 y, adicionando una suspensión de eritrocitos 2% (sangre humana A, Rh+), siendo los resultados expresados en número de unidades hemaglutinantes (UH), que es calculado a partir del inverso del título de la mayor dilución, en la base 2, que aun presentó aglutinación visible. Por ejemplo: considerando una dilución 24, el título es igual a 1/16, y el volumen de la muestra utilizado en el ensayo de 100μL, la UH es de 16 UH / 100 μL.
La extracción fue realizada con solución de NaOH a 0,1 mol L-1 en agitación continua. Después del centrifugado, una alícuota del sobrenadante fue usada en el ensayo enzimático empleando BApNA (bensoil-DL-arginina-p-nitroanilida) como substrato y la enzima tripsina. Si existe inhibidor en la muestra, este inhibe la acción de la tripsina sobre el BApNA. La lectura fue realizada a 410 nm. La actividad del inhibidor de tripsina se expresa en términos de unidad de tripsina inhibida (UTI) (15).
La extracción de los polifenoles fue realizada con metanol 50 mL / 100 mL en reflujo por tres veces consecutivas. Los extractos de cada extracción fueron reunidos, evaporados hasta volumen de 25 mL y sometidos a determinación de polifenoles según Folin-Denis, usando ácido tánico como patrón (16).
El método utilizado en la determinación del nitrato se basa en la formación de un complejo por la nitración del ácido salicílico sobre condiciones altamente ácidas, el cual puede ser leído en espectrofotómetro a 410 nm en soluciones básicas (pH > 12), y la absorbancia del material es directamente proporcional a la cantidad de nitrato presente sin la ocurrencia de la interferencia de iones amonio, nitrito o cloro (17).
El ácido oxálico fue extraído en caliente con ácido clorhídrico, precipitado y cuantificado por la titulación del oxalato de calcio con permanganato de potasio (18).
El fitato fue extraído con HCl por una hora a temperatura ambiente, siendo el pH ajustado a 6,0 y la muestra centrifugada. El extracto fue eluído a través de una resina de intercambio aniónica para remover los fósforos inorgánicos y otros compuestos interferentes. El contenido de fitato fue medido usando el reactivo de Wade. Se utilizó el fitato de sodio (SIGMA) como patrón, realizando la lectura a 500 nm (19,20).
Se realizó un diseño completamente aleatorizado, con 4 tratamientos y 5 repeticiones. El análisis estadístico de los resultados fue realizado con el programa computacional SISVAR versión 4.6 (build 62). Cuando el análisis de varianza mostró diferencia significativa, se hizo la comparación entre medias por la prueba de Tukey a 5% de probabilidad (21).
En la Tabla 1 se presentan los resultados de la composición centesimal de la harina del fruto de diferentes especies de algarroba.
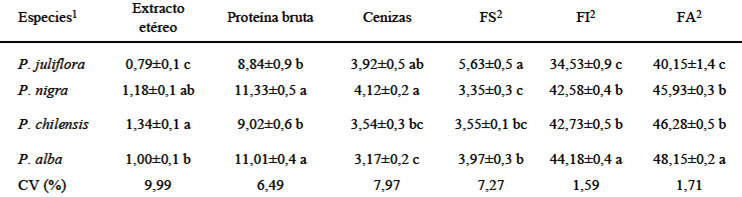
Con relación al extracto etéreo, los valores indican diferencia significativa entre las diferentes harinas, siendo que la harina de P. juliflora presentó la menor proporción 0,79g / 100g materia seca-MS y la P. chilensis la mayor 1,34 g/100g MS. El contenido de proteína bruta indicó niveles variables, la P. juliflora y la P. chilensis presentaron los menores valores y estadísticamente iguales entre ellos 8,84 y 9,02 g / 100g MS respectivamente, y para P. alba (11,01 g/100g MS) y P. nigra (11,33 g/100 g MS) reportaron valores mayores e iguales estadísticamente. Los resultados de las cenizas mostraron diferencia significativa para la P. nigra y la P. alba con valores de 4,12 y 3,17 g/100g MS, respectivamente. Las fibra alimentaria, FA, que comprende la la fibra insoluble y soluble, presentó niveles mas elevados en las algarrobas bolivianas que en la brasilera (P. juliflora), destacándose la harina de P. alba con un valor de 48,15 g/100 g MS. La harina de P. juliflora mostró el nivel mas elevado de FS y menor de FI. Entre la P. nigra y P. chilensis no existe diferencia significativa en la FS, FI y FA, y en FI la P. alba alcanzó el mayor nivel con 44,18 g / 100 g MS.
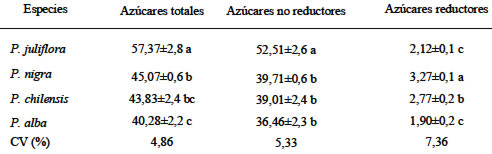
En relación con los azúcares, la P. juliflora se destacó con cantidades mucho más elevadas que las de Bolivia, confirmado por el mayor valor de azúcares no reductores (52,51 g / 100 g MS) (Tabla 2). Las HIFA de Bolivia presentaron un nivel menor de estos azúcares, pero, fueron estadísticamente iguales entre si.
En la Tabla 3 son presentados los resultados de los factores antinutricionales y de la digestibilidad proteica in vitro de la HIFA de diferentes especies de algarroba. Los niveles encontrados de saponina y hemaglutinina son considerados bajos, aunque la P. nigra presentó el mayor nivel de saponina (0,16 g saponina / 100 g MS) y la P. juliflora la mayor actividad hemaglutinante (1,0 UH / 100 μL). El contenido de inhibidor de tripsina de la harina de las algarrobas fue estadísticamente diferente entre las especies y varió de 0,29 (P. chilensis) a 9,32 (P. juliflora) UTI / mg MS.
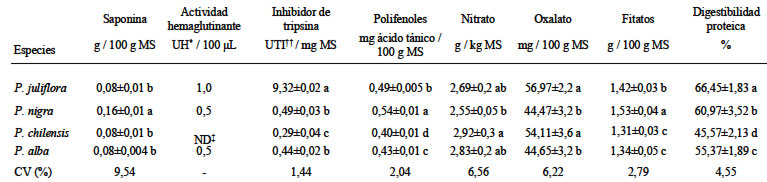
Los resultados encontrados de polifenoles variaron de 0,40 a 0,54 mg de ácido tánico / 100g MS, siendo estos valores estadísticamente diferentes entre las harinas estudiadas. En el caso del nitrato los valores mostraron diferencia significativa solamente entre las especies P. chilensis (2,92 g NO3- /kg MS) y P. nigra (2,55 g NO3- /kg MS). Los resultados encontrados de fitato en la HIFA mostraron niveles de 1,31 a 1,53 g/100 g MS, correspondiéndole a la harina de P. nigra el valor mas elevado. Con relación a la digestibilidad proteica in vitro, los valores variaron de 66,45% a 45,57%, el primero de ellos alcanzado por la P. juliflora.
Los resultados de la composición centesimal de las HIFA mostraron variabilidad entre las especies. Se observó un bajo contenido de extracto etéreo. En un estudio con la pulpa de la P. alba y P. pallida (22) se encontraron niveles de extracto etéreo de 2,2 y 0,8 g/100g MS, respectivamente. Los resultados del presente trabajo están entre los valores citados.
Según estudios anteriores (1), los frutos de Prosopis velutina presentaron contenido de proteína bruta de 12g / 100g MS; en otro estudio (5) se relatan niveles de 9,7 ± 0,43 g/ 100g MS para P. alba. Analizando P. juliflora (23), reportaron 9,88 g/100g MS para la harina de los frutos. Por tanto, los valores encontrados de proteína en las especies estudiadas se asemejan a los reportados en la literatura.
Prokopiuk et al. (22), indican un contenido de cenizas en la pulpa de P. Alba de 4,21 g/100g MS, siendo éste valor mayor al obtenido en la harina integral del fruto de P. Alba. Silva et al. (23) informan para la P. juliflora (23) de 3,82 g/100 gMS, resultado éste muy semejante al encontrado en el presente trabajo (3,92 g/100 g MS).
Trabajos realizados con estas especies (2,23) solo reportan resultados de fibra bruta, la cual subestima el verdadero aporte de las harinas en fibra alimentaria. Otros trabajos (5,22) indican tenores de fibra alimentaria para la harina de pulpa de P. alba que revelan contenidos bastante menores (21,00 a 35,66 g/ 100g MS) comparados con la harina aquí estudiada.
El aporte de fibra alimentaria de la HIFA es muy superior a la reportada para el acai (24) (20,00 a 30,90 g/100g), fresas, higos, guayabas y dátiles (25), así como harina de trigo integral y afrecho de arroz (26), son señalados como fuentes de fibra, lo cual indica que la harina integral del fruto de algarroba es una rica fuente de fibra alimentaria.
En relación con los azúcares, la P. juliflora presenta cantidades mucho más elevadas de azúcares no reductores que las de Bolivia (52,51 g/100g MS) (Tabla 2); este valor fue menor al reportado en la caracterización de harina de la pulpa de algarroba (59,98 g/100g MS) (23). Cuando se comparan los azúcares totales de este trabajo con los presentados para la harina de sorgo (27) con tenores de 56,84 a 68,85 g/100g MS, se observa que son próximos a P. juliflora y menores en las harinas provenientes de Bolivia. Estos valores de azúcares encontrados nos permiten afirmar que este fruto presenta una gran perspectiva para su industrialización, ya sea como materia prima para la producción de alimentos destinados a humanos o en la producción de combustible biológico a partir de la fermentación de los frutos y obtención de alcohol.
Con relación a los antinutrientes, comparando los valores encontrados de saponina en la harina del fruto de la algarroba con los reportados en la quinua (28), en las formas silvestres y las variedades amargas, estas presentaron contenido máximo de 2,8 g /100 g MS, que, comparado con las exigencias actuales del mercado que fijan como valor límite 0,05 g/100 g, es extremamente alto. En otro trabajo (29) fueron reportados valores de 2.16 y 1.32 g /100 g MS en los granos de arroz y de frijoles, respectivamente, siendo estos valores mucho mayores a los encontrados en las harinas de este trabajo. Altas dosis de saponinas en el torrente sanguíneo pueden ser peligrosas, ya que pueden provocar hemólisis (30).
Se detectaron valores bajos de actividad hemaglutinante en las especies P. juliflora, P. nigra y P. alba, mientras que P. chilensis no mostró actividad. El simple hecho de presentar actividad hemaglutinante baja no nos permite descartar la posibilidad de estar frente a una lectina tóxica. Las lectinas disminuyen la absorción de nutrientes, provocan pérdida de proteína, rápida pérdida de peso e inhibición de crecimiento (31); además, muestran capacidad de inhibir varias enzimas intestinales (32).
El contenido de inhibidor de tripsina de las HIFA fue inferior al encontrado en frijoles silvestres, 28 UTI / mg de muestra (33), siendo que la P. juliflora mostró valores parecidos al del fríjol cultivado, 9 a 15 UTI / mg de muestra (34), y las demás especies presentaron valores menores. La presencia de este antinutriente muestra la especificidad de inhibir las enzimas proteolíticas y, consecuentemente, reduce la digestión proteica de los alimentos, disminuyendo la ganancia de peso y crecimiento de los animales (35).
La concentración de polifenoles fue estudiada en 20 familias de frijoles comunes (36), encontrando tenores de 257,91 a 1.446,80 mg ácido tánico /100g MS, siendo estos extremadamente altos comparados con los resultados alcanzados para las HIFA. Los polifenoles, son mencionados con frecuencia como los mayores limitantes del valor nutritivo de leguminosas, ya que en estudios con animales alimentados con dietas ricas en polifenoles presentaron reducción de la ingesta de alimentos y bajo cociente de eficiencia proteica (37).
En el caso de nitrato, un estudio con espinacas (38) mostró un contenido medio de nitrato en espinaca producida en invierno de 3,79 g NO3 - /kg materia fresca (MF) y en las otras estaciones entre 4,12 y 4,33 g/kg MF, niveles éstos mucho más elevados que los encontrados para las algarrobas.
El nivel de ácido oxálico en las HIFA fue inferior al encontrado en la espinaca (820 mg/100g MF), y superior a los de coliflor (6 mg/100 g MF), col (7,3 mg/100 g MF), manzana con cáscara (3 mg/100g MF), té negro (0,69 mg/100 g MF) y escarola (10 mg/100 g MF) (39). La presencia de oxalato en alimentos ha sido asociada a la reducción de minerales esenciales como el calcio, además de afectar la absorción de hierro, magnesio y zinc (40).
En un estudio con mezclas de trigo, maíz, cáscara de huevo y hojas de yuca (41), se encontraron contenidos de fitato de 1,61 a 2,25 g/100 g MS; y otro estudio con harina estabilizada de cáscara de arroz (42) alcanzó valores de 7,53 g/100 g MS, mayores a los encontrados en este estudio. Saharan et al. (29) reportaron en granos de frijoles, 1.01 g/100 g MS, valores menores a los de la harina de algarroba. La capacidad que presenta el ácido fítico de formar complejos insolubles con minerales puede interferir en la biodisponibilidad de algunos de ellos como zinc, calcio y hierro, contribuyendo de esta forma a una disminución del valor biológico de los alimentos (43).
Un trabajo anterior (7) indica una digestibilidad mayor para P. juliflora (74%) y para P. nigra (62,16%) y P. alba (62%), valores semejantes a los encontrados en este trabajo.La P. chilensis mostró la menor digestibilidad proteica in vitro (45,57%), la cual es menor a la reportada en un estudio realizado al momento de la cosecha (3) (71,18%) y que disminuye con el tiempo de almacenamiento sin protección, alcanzando una digestibilidad de 30%.
Entre las HIFA estudiadas, la P. nigra y P. alba se destacaron por su contenido en proteína, fibra e bajos niveles de los antinutrientes estudiados, mientras que la P. juliflora se destacó en su composición de azúcares totales.
En el caso de las sustancias antinutricionales, las estudiadas en el presente trabajo no representan un riesgo para la población, ya que los valores encontrados no interfieren en la utilización nutricional de las mismas, una vez que estos tienden a disminuir durante el procesamiento de los alimentos. Otros parámetros deben ser estudiados para determinar el potencial nutracéutico y tecnológico del fruto de la algarroba como nuevo substituto de alimentos tradicionales destinados a poblaciones especificas, aprovechando su potencial en fibra y dulzura natural.
A Capes-Coordenação de Aperfeiçoamento de Pessoal de Nível Superior por la beca de Doctorado PEC-PG al primer autor.
A la Universidad Autónoma Gabriel René Moreno (Santa Cruz de la Sierra, Bolivia) por permitir la realización del Curso de Doctorado al primer autor.
Recibido: 15-04-2008
Aceptado: 11-09-2008