En Costa Rica, cerca del 25% de la producción de leche nacional es utilizada en la elaboración de queso tierno no pasteurizado, y el consumo de este producto es aproximadamente de 4 a 5 kg anuales per cápita. Este alimento ha sido involucrado en brotes debidos a Listeria monocytogenes. Dado lo anterior, se aisló e identificó esta bacteria a partir de muestras de queso blanco no pasteurizado provenientes de dos zonas tradicionalmente productoras y expendedoras de dicho producto. Se recolectaron 110 muestras de queso a partir de las cuales se aislaron 27 cepas de L. monocytogenes. Las cepas fueron caracterizadas mediante pruebas bioquímicas y serológicas, además se les realizaron pruebas de susceptibilidad a los antibióticos, hemólisis en tubo e invasión en células Hela. El 85% de las cepas evaluadas fueron sensibles a todos los antibióticos analizados, no obstante, cuatro cepas (15%) presentaron patrones de resistencia a diversos agentes, incluyendo estreptomicina, kanamicina, cefalotina y tetraciclina. También, se encontraron patrones de resistencia múltiple. El 88,9% de los aislamientos estudiados fueron positivos para la prueba de hemólisis en tubo, y el 22,2% presentaron porcentajes de invasión iguales o superiores a la cepa de origen clínico usada como control. Cabe destacar que todas las cepas con capacidad de invasión fueron también susceptibles a todos los antibióticos usados. Los resultados encontrados ponen de manifiesto la presencia de L. monocytogenes en queso blanco de origen costarricense. También se evidencia un alto porcentaje de susceptibilidad a los antibióticos de uso común para los casos de listeriosis. Por otro lado, pone de manifiesto que el queso blanco puede ser transmisor de cepas con capacidad de invasión y por ende, potencialmente patógenas al hombre.
Palabras clave: Listeria monocytogenes, queso, invasión, resistencia a antibióticos.
In Costa Rica, almost 25% of the national milk production is used for the elaboration of non pasteurized soft cheese, and the annual intake of this product is around 4-5 kg per capita. This product has been identified as the source of food borne outbreaks due to Listeria monocytogenes. Given that, the isolation and identification of this bacterium from non pasteurized soft cheese samples coming from two producer zones of Costa Rica was performed. 110 cheese samples were collected, from which 27 L. monocytogenes strains were isolated. These were characterized using biochemical and serological tests, also, susceptibility to common used antibiotics, test tube hemolysis and invasion in Hela cells trials were performed. 85% of the strains evaluated were sensible to all the antibiotics analyzed, nevertheless, four strains presented resistance to different agents, including streptomycin, kanamycin, cephalotin and tetracycline. Also, multiple resistance patterns were found. 88,9% of the studied isolates were positive for the test tube hemolysis trial; 22,2% presented invasion percentages higher than the clinical origin strain used as control. It is important to point out that all the invasive strains were completely susceptible to the antibiotics tested. The results found demonstrate the presence of L. monocytogenes in Costa Rican soft cheese samples. Also, demonstrate its high percent of susceptibility to common use antibiotics. Same time, invasion trials show that soft cheese may be a source of invasive and potentially pathogenic strains for human being.
Key words: Listeria monocytogenes, cheese, invasion, antibiotics resistance.
Facultad de Microbiología, Universidad de Costa Rica. Centro de Investigación en Enfermedades Tropicales
El género Listeria está conformado por bacilos Gram positivos, no esporulados, aerobios o anaerobios facultativos y móviles de 10 a 25ºC (1). Está dividido en seis especies, de las cuales, L. monocytogenes y L. ivanovvi son consideradas patógenas, siendo L. monocytogenes el agente causal de la listeriosis (2).
Este microorganismo presenta una amplia distribución en el ambiente. Se ha aislado a partir de diversas fuentes incluyendo suelo, vegetación, ensilaje, materia fecal, agua y aguas residuales entre otras. Es una bacteria capaz de resistir y crecer en condiciones ambientales adversas (3) incluyendo las temperaturas de refrigeración (4)
Los cuadros de listeriosis son causados en su mayoría por la ingesta de alimentos contaminados, (5,6,7) destacándose los productos listos para consumir que soportan el crecimiento de esta bacteria, tienen un tiempo de conservación prolongado en condiciones de refrigeración y se consumen sin tratamiento. (2).
Una de las particularidades de esta bacteria, es que presenta diferencias de virulencia entre las mismas cepas (8,9).
Los mecanismos de variabilidad de la virulencia de este microorganismo no se conocen en su totalidad y además, no existe aún un marcador que permita diferenciar los aislamientos virulentos de los avirulentos (10).
Por otro lado, a pesar de que los aislamientos clínicos de esta bacteria usualmente muestran susceptibilidad a un amplio rango de antibióticos y que desde 1988 quedó demostrada la emergencia de un patrón de resistencia (11), existe poca información respecto a los patrones de sensibilidad que presentan las cepas de esta bacteria aisladas a partir de alimentos y que no han sido consideradas como causantes de enfermedad (12,13).
Dentro de la industria láctea, esta bacteria es de especial importancia ya que diversos derivados han sido involucrados en brotes, aparte de que ha sido aislada en varios ambientes dentro de la misma (14-16), dada su capacidad de formar biopelículas (10). El queso fresco es especialmente vulnerable a contaminación con Listeria, dado su alto contenido de humedad, alta disponibilidad de nutrientes, concentración de sal de 1-3% y especialmente, el hecho de que se consume sin recibir ningún tratamiento térmico (17).
Dado lo anterior y considerando que en Costa Rica, alrededor del 25% de la producción de leche es utilizada en la elaboración de queso tierno no pasteurizado, y que el consumo de este producto es aproximadamente de 4 a 5 kg anuales per cápita (17), se aislaron, identificaron y caracterizaron cepas de Listeria monocytogenes obtenidas de quesos que se expenden en el Área Metropolitana de San José, Costa Rica, tomando en consideración algunas de sus características patognomónicas como son su capacidad de invasión y su resistencia a diversos antibióticos.
Las muestras alimenticias seleccionadas fueron adquiridas en lugares asociados a la producción y venta de queso fresco, en la zona norte del país y en Santa Cruz de Turrialba, durante los meses de abril a diciembre, 2007. De cada sitio seleccionado se tomaron por lo menos 10 muestras, para un total de 110 muestras.
Se siguió la metodología descrita en el Manual de Bacteriología, Food and Drug Administration, 1995 (18) para determinar la presencia/ausencia de esta bacteria en 25 g. Brevemente, 25 g de cada muestra fueron enriquecidos en 225 ml de caldo de Listeria e incubados a 30 °C por 48 horas. Posteriormente, se inocularon placas de agar Oxford a partir del caldo del enriquecimiento, las cuales fueron incubadas por 48 horas a 35 °C. Las colonias típicas fueron confirmadas por la prueba de luz de Henry, morfología, motilidad, hemólisis, prueba de CAMP (Christie, Atkins and Much-Petersen) y utilización de xilosa y ramnosa. Además, se realizó una caracterización serológica utilizando el antisuero tipo anti-O polivante (serotipos 1,4), (Bacto®).
Se utilizó el método de difusión en disco (19), con agar Mueller-Hinton complementado con sangre, se emplearon discos impregnados con antibiótico de la marca Oxoid con los siguientes 9 antibióticos: Ampicilina (10 μg), Tetraciclina (30 μg), Gentamicina (10 μg), Estreptomicina (10 μg), Kanamicina (10 μg), Cloranfenicol (30 μg), Cefalotina (30 μg), Eritromicina (15 μg), y Rifampicina (5 μg).
Los ensayos de invasión con células Caco-2 se realizaron como se ha descrito previamente en la literatura (20) con algunas modificaciones leves, incluyendo el uso de células HeLa en lugar de Caco-2. Se utilizó éstas dada su mayor disponibilidad y facilidad de cultivo y mantenimiento, aparte que está claramente establecido en la literatura la capacidad de L.monocytogenes de infectarlas (21)
Brevemente, las cepas de L. monocytogenes fueron cultivadas durante una noche a 30°C sin agitación. Monocapas confluentes de células HeLa (cervical cáncer cells, Henrietta Lacks) fueron inoculadas con 2 x107 las células/pozo de L. monocytogenes (análisis en placa de seis hoyos). Las monocapas de células HeLa inoculadas fueron incubadas por 30 minutos a 37°C, seguido por tres lavados con PBS (buffer de sal y fosfatos) y luego se añadió medio fresco sin antibióticos. Se agregó medio de cultivo con 150 ug/ml de gentamicina a los 45 minutos post inoculación para eliminar las bacterias extracelulares. A los 90 minutos post inoculación, las monocapas de HeLa fueron lavadas tres veces con PBS, y estas se lisaron luego por la adición de agua destilada estéril fría y pipeteo vigoroso. Las bacterias intracelulares fueron enumeradas por medio de siembra por expansión de la suspensión de células lisadas en las placas de agar infusión cerebro corazón. La eficacia de la invasión fue medida como el porcentaje del inóculo recuperado por la enumeración de bacterias intracelulares. Una cepa de origen clínico (HNN23), aislada a partir de un paciente con meningitis por L. monocytogenes fue utilizada como control de invasión, y medio sin inocular se incluyó como control en cada análisis de invasión.
El ensayo de hemólisis se realizó según la metodología descrita por Ellner y Marth (22). Brevemente, las colonias sospechosas son inoculadas en caldo infusión cerebro corazón, al cual se le incorpora eritrocitos bovinos y se incuban a 35ºC por 48 h. Transcurrido este período, se evalúa la presencia de hemólisis en el sobrenadante.
Se logró aislar, a partir de diversas muestras de queso tierno, un total de 27 cepas de L. monocytogenes, las cuales fueron completamente identificadas como esta especie desde el punto de vista bioquímico y serológico (aglutinaron el suero polivalente). Doce de estas cepas (44,4%) provienen de la zona norte del país y 15 (55,6%) provenientes de la zona de Santa Cruz de Turrialba.
El 85% (n = 27) de las cepas evaluadas fueron sensibles a todos los antibióticos analizados, no obstante, 4 cepas presentaron multi resistencia (Tabla 1). Una de estas era originaria de la zona norte del país y mostró resistencia a estreptomicina, kanamicina y cefalotina. Las otras tres cepas, fueron originarias de Santa Cruz de Turrialba, y presentaron resistencia a tetraciclina, la segunda a tetraciclina y cloranfenicol, y la tercera a cloranfenicol y rifamcipina.
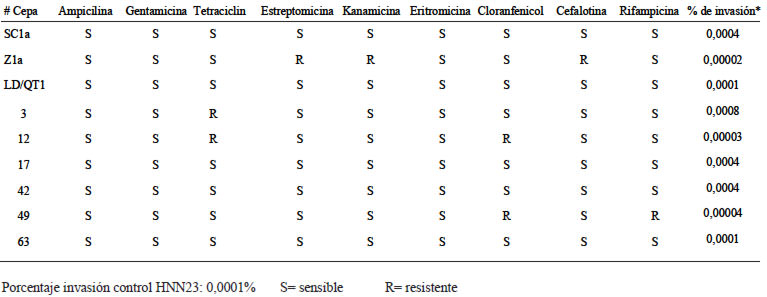
Al realizar el análisis de invasión de las cepas de L. monocytogenes aisladas a partir de queso fresco se encontró que 6 de éstas (22,2%), provenientes de ambas zonas del estudio, presentaron porcentajes de invasión iguales o superiores a la cepa clínica utilizada como control (>0,0001), destacándose una cepa proveniente de la zona norte del país, con un porcentaje de invasión muy alto (0,004%) comparado con las demás. Cabe destacar que no se observó ninguna asociación con respecto al lugar de origen de las muestras.
Por otro lado, es importante destacar que, todas las muestras con características invasivas, fueron susceptibles a todos los antibióticos evaluados.
El 88,4% de los aislamientos evaluados presentaron hemólisis en el sobrenadante del tubo, así como destrucción de los eritrocitos.
La presencia de L. monocytogenes en queso blanco producido en Costa Rica ha sido demostrada por diversos autores, los cuales reportan frecuencias que varían entre 10 y un 45% de positividad (22,23). A nivel mundial, su frecuencia oscila también entre 0% reportado en Italia y Nueva Zelandia, hasta un 43%, reportado en España, con una media del 9% (8).
La gran dispersión de estos datos coincide con el hecho que la mayoría de los casos de listeriosis humana son esporádicos y la fuente generalmente no se conoce. No obstante, se considera que los alimentos contaminados son la principal vía de transmisión y de estos, los asociados con mayor frecuencia son los productos listos para consumir, con prolongados tiempos de conservación en refrigeración. (3).
El tratamiento de primera elección de esta infección se basa en un esquema de beta lactámicos como ampicilina y aminoglicósidos como gentamicina. Los antibióticos de segunda elección incluyen la ciprofloxacina, eritromicina y rifampicina, y la combinación de trimetoprim y sulfametoxazol (24,25).
Con respecto a la respuesta de esta bacteria ante estos antibióticos, a nivel mundial se considera que su resistencia es baja (24), tal y como se encontró en el presente estudio (85% de sensibilidad). No obstante, es importante destacar que se encontró 2 cepas (7,4%) resistentes a tetraciclina, uno de los antibióticos para los que se encuentran reportados en la literatura algunos de los mayores niveles de resistencia (11). Desde 1988 se detectó la emergencia de cepas de L. monocytogenes resistentes a antibióticos (26) y de igual manera, se ha descrito resistencia a uno o más antibióticos, tal y como se reportó en al menos 3 cepas del presente estudio (24,267. Esta resistencia múltiple ha sido asociada a la presencia de plásmidos auto-transferibles, posiblemente originados en cepas de Enterococcus y Streptococcus (9,24, 28).
La trascendencia de lo anterior estriba en que L. monocytogenes demuestra la capacidad de adquirir resistencia a antibióticos y su potencial diseminación, lo cual posee una gran importancia sanitaria, sobre todo tomando en cuenta la ubicuidad de esta bacteria.
En cuanto a la virulencia de esta bacteria, aún se desconoce si es dependiente de la capacidad del microorganismo de invadir los enterocitos o las células M en las placas de Peyer del huésped. Diversos estudios han sugerido que algunas cepas son más virulentas que otras (29,30) y se ha encontrado que aunque la gran mayoría de las cepas tiene los genes de virulencia en sus genomas, no siempre los expresan. Los mecanismos de variabilidad de la virulencia de la L. monocytogenes aún no se dilucidan totalmente y además, no existe, hasta la fecha, un marcador que permita diferenciar los aislamientos virulentos de los avirulentos (31).
Dentro de estos marcadores de virulencia, fue la actividad hemolítica de los aislamientos el primer factor estudiado, ya que el grado de hemólisis es una prueba indicativa de la expresión activa del gen hly (32). La listeriolisina O (LLO) es la hemolisina responsable de la hemólisis tipo B que caracteriza a las colonias de L. monocytogenes en agar sangre y en el presente trabajo, 88,9% de los aislamientos presentaron este tipo de hemólisis.
Diversos trabajos han demostrado que las escasas cepas no hemolíticas de este patógenos suelen ser avirulentas debido a que, aunque llegan a ser invasivas, son incapaces de escapar de la vacuola fagocítica. No obstante, éste es un tema polémico, ya que como lo establecen López et al., un solo factor de virulencia puede estar atenuado y aún así, el aislamiento puede ser patógeno (31).
La invasividad a células de origen humano también ha sido utilizado como marcador de virulencia para L. monocytogenes. Varias líneas celulares han sido utilizadas para este tipo de prueba, entre ellas las Caco (20). La invasión de L. monocytogenes a estas células es promovida por la proteína internalina A (33), a diferencia de otras líneas celulares como las Hela y Vero donde es promovida por la internalina B (34). El 22,2% de las cepas evaluadas presentaron un porcentaje de invasión superior a la cepa control, poniendo de manifiesto que los alimentos pueden ser transmisores de cepas con capacidad de invasión y por ende potencialmente patogénicas.
Con los datos anteriores, se demuestra la presencia de L. monocytogenes potencialmente patógena en derivados lácteos de origen costarricense por lo que es importante hacer un llamado a las autoridades en salud con el fin de monitorear la presencia de esta bacteria en alimentos listos para su consumo, y promover técnicas de procesamiento que ofrezcan alimentos más seguros para los consumidores, con el fin de disminuir la morbilidad y mortalidad asociada a esta bacteria.
Los autores agradecen la valiosa colaboración de las doctoras Mariela Rojas, Carolina Arguedas y Gabriela Carrillo. Este proyecto recibió financiamiento de la Vicerrectoría de Investigación, Universidad de Costa Rica, proyecto 803 A6 037.
Recibido: 08-10-2008
Aceptado: 27-02-2009