A proteína C-reativa (PCR) é uma proteína de fase aguda que tem sido associada ao risco aumentado para doenças cardiovasculares. Diversos estudos têm demonstrado associação entre acúmulo de gordura corporal e níveis elevados de PCR. O objetivo deste trabalho foi verificar a associação entre medidas de adiposidade, variáveis demográficas e bioquímicas com os níveis de PCR em uma população rural. A população foi constituída por indivíduos com idade maior ou igual a 18 anos de ambos os sexos e pelo menos dois anos de residência no local. Foram excluídos mulheres grávidas, indivíduos diabéticos e indivíduos com PCR acima de 10mg/l. A coleta de dados incluiu variáveis antropométricas, demográficas, de estilo de vida e bioquímicas. Os dados foram analisados por meio do STATA 9.0. Dos 536 participantes, 50,37% eram do sexo masculino, a idade variou entre 18 e 94 anos com média de 43,34 anos. A prevalência de sobrepeso e obesidade foi significativamente maior no sexo feminino. Na análise bivariada o IMC, circunferência da cintura, RCQ, idade, educação, pressão arterial sistólica e diastólica, colesterol total, LDL-c, HDL-c, triglicérides, insulinemia de jejum e HOMA-IR correlacionaram-se significativamente com o lnPCR. As variáveis que se mantiveram associadas com o lnPCR, após ajuste do modelo de regressão linear múltipla foram IMC, idade, sexo, insulinemia de jejum e HDL-c. A associação independente de tradicionais fatores de risco para as doenças cardiovasculares (idade, sexo, IMC, insulina de jejum e HDL-c) com a PCR evidencia uma estreita relação entre tecido adiposo, doenças cardiovasculares e inflamação.
Palavras chave: Antropometria, proteína C-reativa, população rural, obesidade, doenças cardiovasculares, tecido adiposo, fatores de risco.
Acute-phase proteins as C-reactive protein (CRP) have been associated with cardiovascular diseases. Recent studies have shown the relation between body fat and elevated serum levels of CRP. This study verifies relation between adiposity measures, demographic and biochemical variables with CRP serum levels in a rural population. The study was conducted among individuals aged 18 or more, both sexes and at least two years of residency in the place of study. Pregnant women, diabetic and CRP over 10mg/l individuals were excluded. Data collection included anthropometric, demographic, lifestyle and biochemical variables. Data was processed in STATA 9.0. From the 536 subjects, 50.37% were men. Age varied from 18 to 94, age mean was 43.34. Overweight and obesity prevalence were significantly higher among women than men. Bivariate analysis found significant correlations between lnCRP and the following variables: BMI, waist circumference, WHR, age, education, systolic and diastolic blood pressure, total cholesterol, LDL-c, HDL-c, triglycerides, fasting insulin and HOMA-IR. After adjusting for confounding variables in multiple linear regression analysis only BMI, age, sex, fasting insulin and HDL-c remained significantly associated with lnCRP. The independent association of traditional risk factors for cardiovascular disease (age, sex, BMI, fasting insulin and HDL-c) with PCR evidences a close relationship between adipose tissue, cardiovascular diseases and inflammation.
Key words: Anthropometry, C-reactive protein, rural population, obesity, cardiovascular diseases, adipose tissue, risk factors.
Departamento de Enfermagem Materno-Infantil e Saúde Pública, Escola de Enfermagem, Universidade Federal de Minas Gerais, Minas Gerais, Brasil
Apoio financeiro:
Fundação de Amparo à Pesquisa de Minas Gerais (FAPEMIG), National Institute of Health (NIH)
A prevalência de obesidade vem aumentando em populações de todo o mundo, sendo hoje considerada uma epidemia global (1). Nos países latino-americanos, observouse um aumento marcante da prevalência de obesidade, principalmente na população de baixo nível sócio-econômico (2).
A prevalência de obesidade na área rural brasileira tem aumentado significativamente nos últimos anos (3). Estudos realizados no meio rural indicam que o aumento de peso nessa população pode ser atribuído à incorporação dos hábitos de vida urbanos, como o aumento do consumo calórico (4) e diminuição do esforço físico, que contribuem para o desequilíbrio do balanço energético e favorecem o ganho de peso corporal (5).
A obesidade está relacionada à comorbidades e mortalidade aumentada, especialmente por doenças cardiovasculares e diabetes (6). Atualmente, as doenças cardiovasculares são apontadas como a principal causa de morte e a maior causa de incapacidade produtiva em adultos de todo o mundo (7). O excesso de gordura corporal, principalmente a gordura visceral, é um importante preditor para eventos cardiovasculares (8).
Estudos epidemiológicos têm apontado que elevações discretas das concentrações de PCR, mesmo ainda dentro da faixa de referência, podem prever o aparecimento de doenças cardiovasculares (9) e diabetes (10, 11).
A PCR é um marcador sensível de inflamação que desempenha papel importante no desenvolvimento e progressão da aterosclerose (12). A síntese de PCR ocorre no fígado e é fundamentalmente modulada pela IL-6, embora a IL-1 e TNF-α também participem desta modulação (13). Atualmente, sabe-se que o tecido adiposo, além de atuar como estrutura de proteção e sustentação, apresenta intensa atividade endócrina e metabólica (14). Dentre as diversas substâncias secretadas pelos adipócitos, tem-se a citocina pró-inflamatória IL-6 (15), sendo o tecido adiposo responsável pela produção de aproximadamente 30,0% dessa citocina (16). Diversos estudos evidenciaram a associação entre o acúmulo de tecido adiposo e o aumento dos níveis de PCR (17, 18).
O reconhecimento de que o tecido adiposo é um órgão metabolicamente ativo, que pode gerar um estado de inflamação crônica de baixa intensidade, abriu novas perspectivas de pesquisas para elucidar as relações entre medidas de adiposidade e marcadores inflamatórios como a PCR. Assim, frente ao aumento da prevalência de obesidade também em populações da área rural é necessária a verificação dessas relações para este grupo populacional. Este trabalho teve o objetivo de verificar a associação entre medidas de adiposidade, variáveis demográficas e bioquímicas com os níveis séricos de PCR em duas comunidades rurais da região do Vale do Jequitinhonha – MG.
Foi realizado um estudo epidemiológico de base populacional e delineamento transversal nas comunidades de Virgem das Graças e Caju, respectivamente, áreas rurais dos municípios de Ponto dos Volantes e Jequitinhonha, ambas localizadas no Vale do Jequitinhonha, região nordeste de Minas Gerais. Essas comunidades foram escolhidas por serem locais onde se realizam diversos projetos de pesquisa e de extensão relacionados ao controle de parasitoses intestinais em convênio com instituições nacionais e internacionais (19). A população estudada constituiu-se de indivíduos com idade maior ou igual a 18 anos, de ambos os sexos e pelo menos dois anos de residência no local. Foram excluídos mulheres grávidas, indivíduos diabéticos e indivíduos com valor de PCR acima de 10 mg/l, por ser um valor indicativo de alteração transitória dos níveis de PCR, devido, possivelmente, a uma infecção e/ou estado inflamatório agudo (20).
O presente estudo foi aprovado pelo Comitê de Ética e Pesquisa em Seres Humanos da Universidade Federal de Minas Gerais segundo o parecer n. ETIC 144/04. Todos os participantes foram informados sobre os objetivos do estudo bem como de seus direitos como participantes e assinaram um termo de consentimento livre e esclarecido.
Os participantes do estudo responderam a um questionário contendo aspectos demográficos e de estilo de vida. Ao final da entrevista foi realizada uma avaliação clínica que consistiu na aferição de medidas antropométricas e hemodinâmicas, além de coleta de sangue para a realização de exames bioquímicos.
A aferição da pressão arterial foi realizada seguindo-se todos os passos preconizados no VII Relatório da Joint National Committee (21). A aferição foi realizada três vezes com intervalos de dois minutos entre cada procedimento, sendo o valor final determinado pela média das três.
Todas as medidas antropométricas foram realizadas em triplicata por antropometristas treinados de acordo com recomendações padronizadas (22), sendo considerada na análise o valor médio entre elas. O peso foi aferido em uma balança digital (Modelo PL 150, Filizola Ltda., Brasil) com aproximação de 0,1 kg, estando o indivíduo sem sapatos e com roupas leves. A altura foi aferida através de uma fita métrica inextensível fixada em uma parede sem rodapé a uma distância de 50 cm do chão com aproximação de 0,1 cm. Os indivíduos foram posicionados em pé, com os pés juntos, olhando para frente, em posição de Frankfurt. O índice de massa corporal foi calculado utilizando a equação IMC = peso (kg)/ altura (m)2 e classificado segundo pontos de corte propostos pela Organização Mundial de Saúde (23). A circunferência da cintura foi aferida com uma fita métrica inelástica, posicionando-a no ponto médio entre a última costela e a parte superior da crista ilíaca. Aferiu-se a medida com aproximação de 0,1 cm ao final de uma expiração normal (23). A circunferência do quadril foi aferida no local de maior protuberância da região glútea com aproximação de 0,1 cm. A razão cintura-quadril (RCQ) foi obtida através da equação RCQ = circunferência da cintura/ circunferência do quadril.
Amostras de sangue foram obtidas por meio de punção venosa com o participante em jejum de 12 horas. A coleta e a centrifugação da amostra sanguínea ocorreram no local da pesquisa. O soro e o plasma de cada indivíduo foram separados em tubos de ensaios devidamente identificados e enviados ao laboratório no mesmo dia da coleta, seguindo as especificações técnicas recomendadas. No laboratório, as amostras de soro e plasma foram armazenadas em um refrigerador a -20º C. As concentrações do colesterol total, triglicérides e glicose foram determinadas por um método enzimático colorimétrico utilizando o analisador COBAS MIRA PLUS (Roche Diagnostics). A concentração HDL-c também foi medida por um teste enzimático colorimétrico, após precipitação das frações LDL-c e VLDL-c pelo ácido fosfotungstico e cloreto de magnésio. Níveis de LDL-c foram calculados por aplicação da equação de Friedwald (24). As concentrações de PCR e insulina foram determinadas por método de alta sensibilidade quimioluminescente usando o analisador IMMULITE 2000 (EURO/DPC). O método é sensível para detectar valores de PCR acima de 0,1 mg/l e valores de insulina acima de 2 μU/ml. O índice de resistência à insulina foi avaliado pelo método Homeostasis Model Assessment (HOMA-IR) a partir da equação HOMA-IR = insulinemia de jejum (mU/l) x glicemia de jejum (mmol/l)/ 22,5 (25).
Os dados foram processados e analisados por meio do programa STATA versão 9.0 e, para efeito de interpretação, o limite de erro tipo I foi de até 5% (p=0,05). Para caracterizar a população, foram apresentadas tabelas de freqüência e tabelas de medidas de tendência central e dispersão das variáveis, segundo o sexo. As variáveis que apresentaram distribuição simétrica, foram descritas por meio de média ± desvio padrão e aquelas que apresentaram distribuição fortemente assimétrica, foram descritas por meio da mediana (intervalo interquartílico). Para comparar as diferenças entre as freqüências e as médias foram utilizados os testes Quiquadrado e t-Student respectivamente. O teste de Mannwhitney foi utilizado para comparar os postos das observações que não apresentavam simetria na distribuição. Para as correlações entre variáveis contínuas de interesse foi calculado o coeficiente de correlação de Pearson. Os valores de PCR, variável dependente de interesse, sofreram transformação logarítmica a fim de reduzir a assimetria da distribuição. Para medir a associação entre as variáveis independentes e o logaritmo neperiano de PCR (lnPCR) foi calculado o coeficiente de correlação de Pearson. A regressão linear múltipla foi utilizada para avaliar o efeito das variáveis independentes sobre os níveis de lnPCR. A significância do modelo final foi avaliada pelo teste F da análise de variância (ANOVA) e a qualidade do ajuste pelo coeficiente de determinação ajustado (R2 ajustado). Os resíduos foram avaliados segundo as suposições de normalidade, variância constante e independência.
A população foi constituída por 536 indivíduos sendo 270 (50,37%) do sexo masculino e 266 (49,63%) do sexo feminino. A Tabela 1 apresenta as características demográficas e de estilo de vida de segundo o sexo. A idade variou entre 18 e 94 anos com uma média de 43,34 anos. Para o sexo masculino a média de idade foi 43,57 e para o sexo feminino 43,12 (p = 0,764). Observou-se que 69% das pessoas viviam com cônjuge; 75,19% eram de cor não branca; 23,51% ingeriam bebida alcoólica e 34,7% eram analfabetos. Aproximadamente um terço da população era tabagista, entre os que fumavam 71,51% eram do sexo masculino e 28,49% do sexo feminino com uma média de 6,68 e 7,43 cigarros/dia para o sexo masculino e feminino respectivamente.
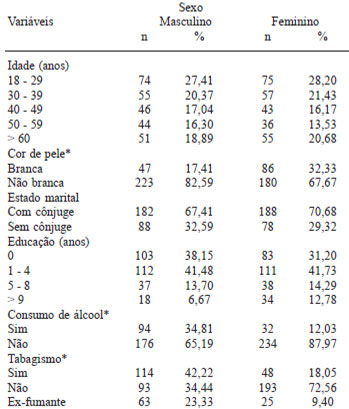
Os valores de PCR variaram de 0,09 a 9,94 mg/l com mediana de 2,23 mg/l. A Tabela 2 apresenta as características hemodinâmicas, antropométricas e bioquímicas da população de acordo com o sexo. Não houve diferença estatisticamente significativa entre a pressão arterial sistólica e diastólica, circunferência da cintura e glicemia de jejum. Observou-se maiores níveis de IMC, circunferência do quadril, insulinemia de jejum, HOMA-IR, triglicérides, colesterol total, LDL-c, HDL-c e PCR para o sexo feminino.
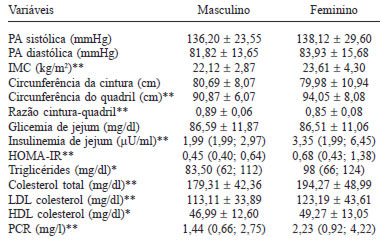
Observou-se que 12,22% dos homens e 23,11% das mulheres apresentavam sobrepeso (p=0,000) e, 2,22% dos homens e 8,33% das mulheres apresentavam obesidade (p=0,000).
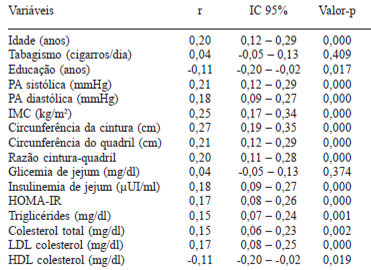
A Tabela 3 apresenta a relação entre níveis de PCR e as variáveis estudadas. Os valores de idade, pressão arterial sistólica e diastólica, IMC, circunferência da cintura e do quadril, RCQ, insulinemia de jejum, HOMA-IR, triglicérides, colesterol total e LDL-c correlacionaram-se positivamente com o lnPCR. As variáveis educação e HDL-c apresentaram correlação inversa com o lnPCR. Não houve associação entre tabagismo e os níveis séricos de lnPCR.
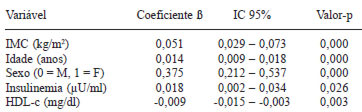
Após o ajuste do modelo de regressão linear múltipla, as variáveis IMC, idade, sexo, insulinemia de jejum e HDL-c foram independentemente associadas com o aumento do lnPCR na população estudada (Tabela 4). As variáveis independentes contempladas nesse modelo explicaram, aproximadamente, 20% da variação nos níveis de lnPCR (R2ajustado=0,197).
Nesse trabalho foram associados indicadores de adiposidade, variáveis demográficas e bioquímicas com a inflamação crônica de baixa intensidade avaliada por meio da PCR em duas comunidades da área rural. Ressalta-se que a população foi composta por indivíduos adultos não diabéticos, sendo a maioria de cor de pele não branca e com um baixo nível de escolaridade. Os valores médios de IMC e RCQ assim como a prevalência de sobrepeso e obesidade foram maiores para os indivíduos do sexo feminino. Estes resultados estão de acordo com estudos nacionais que revelam que na área rural brasileira o problema de excesso de peso é mais expressivo para o sexo feminino quando comparado ao sexo masculino (3).
Neste estudo todas as variáveis indicadoras de adiposidade foram positivamente correlacionadas com o aumento dos níveis de PCR. Corroborando os nossos resultados, recente trabalho evidenciou correlação significativa entre medidas de adiposidade e PCR (26). Outro estudo envolvendo 1088 indivíduos não diabéticos também evidenciou forte associação entre IMC e PCR e entre circunferência da cintura e PCR (27). Nossos resultados demonstraram que após análise multivariada o IMC continuou significativamente associado com os níveis de PCR. Em estudo realizado com 16.616 participantes do NHANES III observou-se que após ajuste pelas potenciais variáveis confundidoras os homens obesos e mulheres obesas possuíam respectivamente 2,13 e 6,21 vezes a chance de ter os níveis de PCR elevados quando comparados aos não obesos (28).
A PCR, avaliada por meio de técnica de alta sensibilidade, é um reconhecido marcador de inflamação crônica subclínica que tem sido associado ao desenvolvimento de doenças cardiovasculares (29, 9). A PCR é produzida pelos hepatócitos sob estímulo de citocinas pró-inflamatórias como a IL-6 (12), a qual é referida como a principal reguladora da produção de PCR pelo fígado (30). Níveis elevados de PCR podem ser atribuídos, entre outros fatores, a um aumento da expressão desta citocina pelo tecido adiposo (16). Tais resultados sugerem que o risco aumentado para as doenças cardiovasculares em indivíduos com excesso de peso, pode ser explicado, em parte, pelo estado inflamatório de baixa intensidade gerado pelo acúmulo de gordura corporal.
A inflamação crônica subclínica está intensamente relacionada com o desenvolvimento e progressão da aterosclerose. Estudos indicam que a PCR desempenha um papel importante nos diferentes estágios da aterosclerose (31). Alguns dos mecanismos podem ser explicados pelos efeitos proinflamatórios e proaterogênicos da PCR nas células endoteliais que levam ao aumento da expressão de moléculas de adesão celular (32), de proteína quimioatraente de monócito-1 (33), inibidor de ativação do plasminogênio-1 (34) e diminuição da produção de óxido nítrico (35) e prostaciclina (36). Além disso, a PCR ativa o sistema do complemento (37) e contribui para a formação das células gordurosas nas lesões ateroscleróticas devido à capacidade de agregar moléculas de LDL-c (38).
A idade foi positivamente correlacionada com os níveis de lnPCR e se manteve associada com a mesma após análise multivariada. Em estudo envolvendo 1172 homens aparentemente saudáveis a idade foi um dos principais determinantes da concentração de PCR, visto que ela explicou cerca de 10,0% da variância nos níveis de PCR (39). O sexo também foi significativamente associado com o lnPCR indicando que as mulheres apresentavam níveis de lnPCR maiores que os homens. Em estudo realizado com 6101 indivíduos participantes do Dallas Heart Study foi demonstrado que as mulheres possuíam níveis de PCR significativamente maiores que os homens mesmo após ajuste por IMC e pelos tradicionais fatores de risco cardiovasculares (40).
Outro resultado importante foi a correlação entre os níveis plasmáticos de insulina e a resistência à insulina avaliada por meio do índice HOMA com o aumento nos níveis de PCR, corroborando os resultados encontrados no The Minoh Study (41). Em análise multivariada a insulinemia de jejum permaneceu significativamente associada com o aumento da PCR. Resultados encontrados no The Chennai Urban Rural Epidemiology Study evidenciaram aumentos nos níveis de marcadores inflamatórios como PCR e IL-6 de acordo com o aumento do grau de intolerância à glicose (42). Outros estudos demonstram que em indivíduos não diabéticos os níveis de PCR estão positivamente associados com medidas de resistência à insulina, tais resultados sugerem uma possível relação entre inflamação crônica subclínica e resistência à insulina (27, 43).
Após análise multivariada dos dados observou-se associação significativa entre HDL-c e PCR. Diversos estudos evidenciaram associação inversa e independente entre HDLc e PCR sugerindo que baixos níveis de HDL-c podem favorecer o processo inflamatório (44, 45). Em recente trabalho envolvendo 10.059 indivíduos saudáveis foi evidenciado, pela análise de regressão linear múltipla, que idade, sexo, IMC, HOMA, HDL-c e triglicérides foram preditores independentes para o aumento dos níveis de PCR (46).
Algumas limitações devem ser consideradas para este estudo. A primeira deve-se ao fato de não ter sido utilizada uma população com comprovada representatividade da população rural brasileira, podendo, em parte, restringir a validade externa dos resultados encontrados. A segunda limitação é intrínseca ao delineamento do estudo, por se tratar de um estudo transversal, a falta de comprovação de temporalidade nas associações encontradas nos impede uma relação mais segura de causalidade entre as variáveis envolvidas. Nossos resultados, no entanto, corroboram os resultados encontrados em importantes estudos longitudinais e, além disso, os ajustes multivariados excluem, em grande parte, a possibilidade de que as associações encontradas sejam explicadas por outros fatores que não os incluídos no modelo. Acreditamos então que em populações de indivíduos adultos, não diabéticos, com baixo nível socioeconômico e educacional e residentes em área rural, o aumento da idade, do IMC e da insulinemia de jejum, o sexo feminino e a diminuição do HDL-c podem ser bons preditores para caracterizar uma condição de inflamação subclínica.
Em conclusão, neste estudo evidenciamos que a adiposidade, avaliada por meio do IMC, constituiu-se um preditor independente para o aumento dos níveis séricos de PCR. Esse resultado vai ao encontro com a teoria de que o excesso de tecido adiposo é capaz de gerar um estado de inflamação crônica de baixa intensidade. Ressalta-se ainda que a associação independente de tradicionais fatores de risco para as doenças cardiovasculares (idade, sexo, IMC, insulina de jejum e HDL-c) com a PCR evidencia uma estreita relação entre tecido adiposo, doenças cardiovasculares e inflamação, no entanto, novos estudos são necessários a fim de esclarecer ainda mais as relações encontradas.
Recibido: 29-04-2008
Aceptado: 29-07-2008