La yoduria o eliminación urinaria de yodo (EUI) es un método efectivo para detectar el déficit en su ingesta. En 121 embarazadas se midió yoduria en dos muestras (matutina y vespertina) con el método turbidimétrico modificado por Pino. Se consideró normal una EUI =150 ug/l. En las mujeres con EUI<100ug/l se investigó la función tiroidea. De 121 embarazadas la yoduria fue normal en 75, en las que la yoduria matinal no fue diferente a la vespertina (matutina: 305.2± 7.0 vs vespertina: 319.2± 8.8; NS). No hubo diferencia entre las yodurias de los diversos trimestres. En 46 embarazadas (36.9%) la yoduria fue baja sin diferencias entre la matutina y vespertina (matutina: 88.12 ± 5.07 μg/l vs 88.7± 6.2 μg/l; NS), al igual que entre las yodurias matutinas y vespertinas en los tres trimestres de embarazo. De las embarazadas con yodurias <100ug/l, el 45% presentó alteraciones de la función tiroidea. No hubo diferencias significativas respecto a la edad entre las embarazadas con baja y normal EUI. La determinación de yoduria matutina y vespertina permitió detectar un mayor número de embarazadas con baja ingesta de yodo y orientó para la búsqueda de disfunción tiroidea que no se hubiera detectado por no contar nuestra Provincia con un Programa de screening para hipotiroidismo gestacional.
Palabras clave: Yoduria matutina y vespertina, ingesta de yodo, disfunción tiroidea gestacional.
The urinary iodine excretion (UIE) assay is an effective method to detect reduced iodine intake. UIE was measured in two different samples (morning and evening) from 121 pregnant women, with a turbid-metric method modified by Pino (normal value =150 ug/l). Furthermore, thyroid function was evaluated in pregnant women with UIE <100 ug/l. From 121 pregnant women, the UIE was normal in 75 with similar morning and evening samples (morning: 305.2± 7.0; evening: 319.2± 8.8; p: NS). The UIE did no showed differences in different trimesters and in morning and evening samples. The UIE was low in 46 women (36.9%), without significant differences between morning and evening (morning: 88.12 ± 5.07 μg/l; evening: 88.7± 6.2 μg/l; p: NS). Normal or low UIE were not influenced by the age of pregnant women and 45% of pregnant women with UIE <100ug/l showed impaired thyroid function. Morning and evening study of UIE allowed us to detect a higher number of pregnant women with low iodine intake. This study let us to find thyroid function abnormalities likes a screening method, because in our state there is not a public screening program for gestational hypothyroidism.
Key words: Morning and evening urinary iodine excretion; gestational thyroid dysfunction
Facultad de Ciencias Exactas y Naturales de la Universidad Nacional de La Pampa, Servicio de Endocrinología y Diabetes Hospital Lucio Molas, CEDIE Buenos Aires. Argentina
Proyecto de investigación (Nº 61) financiado por la Secretaria de Ciencia y Técnica de la Facultad de Ciencias Exactas y Naturales de la Universidad Nacional de La Pampa (UNLPam).
El embarazo es uno de los estados de mayor requerimiento de hormonas tiroideas. Vermiglio (1) demostró que las embarazadas con déficit en la ingesta de yodo, tienen aumento en la TSH, y compromiso de la función tiroidea (2), evidenciado por el incremento de la tasa de hipotiroidismo, número de abortos y muerte fetal. Investigadores del Perú (3) observaron que la leche de vaca que provenía de la sierra tenía menor contenido de yodo que la proveniente de la zona marítima, por lo que la ingesta de yodo en los niños variaba de acuerdo al tipo de leche que se ingería.
El diagnóstico y tratamiento precoz del déficit de yodo previene las alteraciones en la mielinización y sinapsis neuronales en cerebro y cerebelo fetal, que comprometen el coeficiente intelectual y el índice de desarrollo psicomotor del recién nacido (1,4-7). Si la ingesta de yodo es adecuada, es normal la síntesis de hormonas para las demandas maternofetales (4) de hormonas tiroideas.
Nosotros determinamos en los años 2002 y en 2003 que el 6.4% y el 8.9%, respectivamente, de los neonatos de la población hospitalaria de Santa Rosa (La Pampa, Argentina) tenían valores de TSH>10 mUI/ml, considerados por la WHO/ICCDD como indicadores de déficit leve de yodo (DDI) (8). Posteriormente, se determinó que el 10.6% de los escolares evaluados en esa ciudad y el 17.6% de una población aledaña tenían bocio, y una menor eliminación urinaria de yodo (EUI) que los de Buenos Aires (9), aunque dentro del rango normal.
La ingesta de yodo recomendada en la embarazada es de 200-250μg/día para que no tenga DDI (10) y prevenga la disminución de tiroxina plasmática la cual provocaría alteraciones en el desarrollo fetal (11). Teniendo en cuenta que la ingesta de yodo puede ser estimada mediante una yoduria cuyo valor debe ser mayor de 150μg/l (12), el objetivo del presente trabajo fue evaluar la utilidad de la determinación de yoduria matutina y vespertina como método de selección para la detección de embarazadas con baja ingesta de yodo en una región yodo-deficiente.
Se determinó la EUI en 121 embarazadas de distinto nivel socioeconómico, de ámbitos hospitalario y privado, en Santa Rosa, (La Pampa, Argentina), durante los años 2005-2006. Se recolectó en distintos trimestres, una muestra de orina matutina (con 8 horas de ayuno) y vespertina (entre las 17hs y 19hs), y se analizó por triplicado la EUI según método turbidimétrico modificado por Pino (13). Para el análisis de los datos se consideró ingesta disminuida de yodo a uno o dos de los valores de EUI <150 μg/L (12). Sin embargo, teniendo en cuenta que al momento de la realización del estudio el punto de corte de EUI en embarazadas era <100μg/l (menor al actualmente recomendado por WHO/UNICEF/ICCIDD) (13), la evaluación de la función tiroidea se llevó adelante solamente en aquellas mujeres con valores de EUI por debajo de 100μg/l, a quienes se les determinó por técnica electroquimioluminiscencia hormona estimulante de la tiroides (TSH, valor normal: 05-4.2 mUI/ml), tiroxina libre (T4L, valor normal: 09-1.9 ng/dl), anticuerpos anti-peroxidasa (TPO, hasta 34 UI/ml), antitiroglobulina (Anti-Tg, normal hasta 115 UI/ml).
Se clasificó como hipotiroidismo clínico: TSH>4 mUI/ml y T4L<0,9 ng/dl; hipotiroidismo subclínico: TSH>4 mUI/ml y T4L normal e hipotiroxinemia: TSH normal y T4L<0.9 ng/d (l1)4. En todas las pacientes se investigaron los antecedentes personales y familiares: edad, multiparidad (>4 embarazos) y consanguíneos con enfermedad tiroidea. Se excluyeron las embarazadas con antecedentes previos de hipotiroidismo.
Para el estudio estadístico se utilizó la prueba T de Student mediante el programa Graphpad Prism versión 5.0. Los datos están expresados como la media ± error estándar de la media. Se consideró estadísticamente significativo un p valor < 0.05.
La yoduria normal matutina no fue diferente a la vespertina (matutina: 305,2± 7.0 vs vespertina: 319.2± 8.8; NS). Las yodurias en forma trimestral tampoco mostraron diferencias significativas (Fig. 1). Una yoduria disminuida en al menos una de ambas muestras recolectadas se determinó en 46 embarazadas (38,65%), correspondiendo 17 al primer trimestre, 20 al segundo y 9 al tercero. Utilizando como método de selección solamente la evaluación de la yoduria matinal, pudieron detectarse 28 casos de embarazadas con EUI <150ug/L. Por su parte, mediante la evaluación de la yoduria vespertina pudieron detectarse un número similar de embarazadas con EUI <150ug/L (28 Casos). Como se objetiva en la Figura 1, las yodurias disminuidas tienen una media próxima a los 100 μg/l, sin embargo solamente 10 de estas embarazadas presentaron ambas yodurias disminuidas (mañana y tarde) por lo que 18 mujeres hubieran quedado sin diagnóstico de no haberse realizado la determinación de la EUI en dos momentos diferentes del día. En las embarazadas con yoduria disminuida la yoduria matinal no fue distinta a la vespertina (matutina: 88,12 ± 5.07 μg/l vs 88.7± 6,2 μg/l; NS). En 5 embarazadas las determinaciones fueron menores de 50 μg/l (2 matutinas y 3 vespertinas); en 31 fue entre 50-99 ug/l (17 matutinas y 14 vespertinas) y en 19 fue entre 100 y 149 ug/l (8 matutinas y 11 vespertinas) (Figura 1). Tenían antecedentes de multiparidad 9 de 46 embarazadas con EUI baja (media ± ES: 2,32±1,57; 19.56%) y en 15 embarazadas de 75 con normal EUI (media ± ES: 2,32± 1.57; 20%).
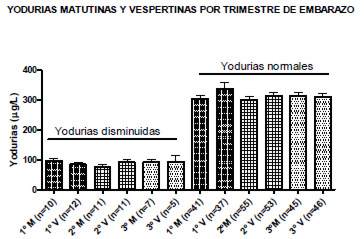
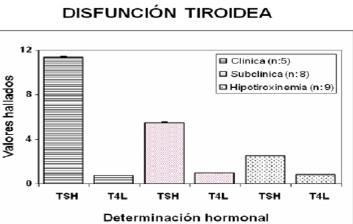
En total 22 embarazadas mostraron alteración funcional tiroidea (Figura 2); 5 con hipotiroidismo clínico, 8 subclínico y 9 con hipotiroxinemia. De ellas 6 tenían signos de autoinmunidad. Si observamos la yodurias<100ug/l, el 45% (15 embarazadas) tenían disfunción tiroidea. La edad no fue un factor determinante en la EUI (media ± ES; normal: 25.3± 0.8 años vs. baja: 26.6 ± 0.9 años). El 37% de las embarazadas con EUI baja y el 33,3% con yoduria normal tenían antecedentes familiares de enfermedad tiroidea.
La población materno-infantil es especialmente vulnerable a la carencia de yodo y se considera que durante el embarazo este déficit, al igual que los anticuerpos anti tiroideos o el bocio materno, son factores de riesgo para el desarrollo de hipotiroidismo gestacional (15). Este conocimiento justifica y brinda mayor valor a la búsqueda de métodos diagnósticos de bajo costo para determinar la ingesta de yodo en esta población. A diferencia de otros investigadores (16-17) que midieron la EUI en embarazadas en una muestra al azar, en este estudio se efectuó screening de la ingesta de yodo, en dos muestras de orina. La determinación de yoduria vespertina permitió detectar un mayor número de embarazadas con baja ingesta de yodo que si se hubiera efectuado únicamente una sola medición. Vanacor et al. (18) consideran que la yoduria vespertina es la que mayor relación tiene con la yoduria de 24 h y probablemente es la que permita determinar la suficiencia de yodo en sujetos con hábitos alimentarios similares. Sin embargo, es importante destacar que, en el presente estudio, la determinación de la yoduria en dos momentos diferentes del día permitió detectar 18 casos más de ingesta disminuida de yodo que la que hubiéramos detectado en caso de haber realizado una única determinación, ya sea ésta matutina o vespertina. Encontramos con las dos yodurias que el 38,6% de las embarazadas tenían baja ingesta de yodo, a diferencia de 28% detectado por Ardawi et al (19) y 21.9% por Prieto et al. (16) a partir de una muestra de orina al azar. Sin embargo, estos autores realizaron una única determinación por paciente, lo que pondría de manifiesto las posibles ventajas de analizar más de una muestra por paciente con el objetivo de detectar un mayor número de embarazadas en riesgo.
No se halló al igual que Vermiglio et al. (1,) diferencia al comparar el diagnóstico de déficit en la ingesta de yodo según el trimestre de embarazo, en discordancia con lo informado por Kung et al (17). .La baja prevalencia de DDI en el primer trimestre, se debería a la baja demanda fetal de este oligoelemento y a que el eje hipotálamo-hipofiso-tiroideo fetal es inmaduro, dependiendo el feto del aporte materno de hormonas tiroideas20. Posiblemente, la mayor demanda de T4 fetal sea suplida por el aumento de la deiodinación transplacentaria mediante la deiodinasa Tipo II y III que desdobla la T4 en T3 (21-22).
En las embarazadas detectadas con EUI menor 100ug/l se guió la pesquisa para disfunción tiroidea mediante determinaciones hormonales. Se encontró que el 45% de las embarazadas con EUI <100ug/L tenían disfunción tiroidea, y a diferencia de otros autores (1,24-25) no se incrementó la prevalencia de hipotiroxinemia e hipotiroidismo subclínico con las semanas de gestación, lo que puede estar relacionado con el número de pacientes estudiados. La restricción de yodo aumenta la estimulación tiroidea que se manifiesta en el 30% con bocio, disminución de T4L o hipotiroxinemia (14). Con el transcurso de la gestación la hipotiroxinemia parecería ser la primera expresión de déficit en la ingesta de yodo, más frecuente que el hipotiroidismo clínico o el subclínico (20-26,28). Se determinó al igual que Ortega y col (29) que el 12% de las pacientes con baja EUI presentaban anticuerpos anti-tiroideos positivos. La enfermedad tiroidea autoinmune se incrementa en las regiones donde el consumo de yodo en la mujer embarazada es inadecuado para atender sus crecientes necesidades de T4, provocando alto riesgo materno fetal, por el pasaje placentario de anticuerpos (26,22,30-31).
La suplementación materna con tiroxina desde el primer trimestre de embarazo, debe mantener una TSH entre 0.5 y 2.0 mUI/ml y la T4L en el tercio superior de los límites normales (20), puesto que disminuye las complicaciones materno-fetales, asegura una adecuada embriogénesis y favorece el neurodesarrollo fetal (1,4-5,26-28,32). Por ello diversos autores (4-5,11) aconsejan prevenir la deficiencia materno-fetal aportando yodo desde el primer trimestre de embarazo administrando tabletas de 200-300 ug de yoduro de potasio o yodato potásico o mezcladas con vitaminas y minerales (20). Zimmerman (28) y Trimarchi et al (33) indican que la profilaxis por corto tiempo con sal yodada en las embarazas no corrige preventivamente la hipotiroxinemia materna y por lo tanto el déficit en la ingesta de yodo requiere tratamiento con tiroxina (33).
Consideramos por nuestro estudio que es conveniente implementar la medición de EUI en dos muestras de orina en embarazadas, porque permite diagnosticar baja ingesta de yodo y probable disfunción tiroidea. La EUI es un método incruento, de bajo costo y comprobada eficacia con alto beneficio para la salud materno-fetal, en Provincias como la nuestra que no cuentan con un Programa de Screening obligatorio para diagnóstico de hipotiroidismo gestacional. Debe efectuarse un estudio caso/control para determinar la mayor prevalencia de disfunción tiroidea en embarazadas con yoduria menor a 150 ug/l, ya que no fue el principal objetivo de nuestra investigación, y por ello en el momento del estudio no se realizaron determinaciones hormonales a todas las evaluadas sino a la que detectábamos una yoduria <100ug/L. Al igual que otros autores (23,34) consideramos de imperiosa necesidad la supervisión por las autoridades provinciales de la calidad del enriquecimiento de la sal de mesa con yodo, ya que la ingesta de sal no enriquecida adecuadamente o directamente no enriquecida, explicarían las bajas yodurias encontradas en nuestras embarazadas.
Al Bioquímico Ricardo FERNANDEZ ORSI y la Técnica Mariela MAIER por el análisis de las muestras. A la Enfermera Silvia ZAPATA por su colaboración en el control de las pacientes.
Recibido: 21-07-2009
Aceptado: 16-09-2009