Las enfermedades de origen alimentario son muy importantes a nivel mundial y su frecuencia es persistentemente alta a pesar de diversos esfuerzos enfocados en disminuir su morbilidad y mortalidad. Listeria monocytogenes es uno de los agentes causantes de este tipo de enfermedad. Dentro de la industria láctea, esta bacteria es de especial importancia, ya que, tanto la leche cruda como derivados han sido involucrados en brotes, siendo el queso fresco un alimento especialmente vulnerable a la contaminación con esta bacteria. La identificación tradicional de este género es lenta, laboriosa y poco sensible. El método de la reacción en cadena de la polimerasa (PCR) podría permitir el obtener resultados precisos y exactos en menor tiempo, razón por la que el objetivo de este estudio fue el optimizar un procedimiento para la detección de L. monocytogens en queso fresco, así como determinar los límites de sensibilidad, especificidad y valor predictivo de la prueba. Para lograr este objetivo, se evaluaron 76 muestras de queso blanco procesado (45 muestras inoculadas, 31 sin inocular como control negativo). La validación de la técnica fue realizada en 50 muestras de queso fresco no pasteurizado. El aislamiento tradicional de esta bacteria se siguió según la metodología descrita en el Compendium of Methods for the Microbiological Examination of Foods. La reacción de PCR para la detección de Listeria monocytogenes se basó en la metodología descrita por Poutou usando los iniciadores característicos del género y del gen de la listeriolisina O, específico de especie. Se determinó que el periodo óptimo de incubación para el caldo de enriquecimiento selectivo fue de 48 horas, y se obtuvo un 100% de sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo. La validación de la técnica demostró la especificidad de ésta en cuanto a detectar únicamente la especie L. monocytogenes, no así otras especies que aparecen con relativa frecuencia en matrices y ambientes alimentarios.
Palabras clave: Listeria monocytogenes, PCR, validación, sensibilidad, especificidad.
Food borne diseases are very important worldwide and their frequency is still high despite the different efforts focused in diminishing their morbidity and mortality. Listeria monocytogenes is one of the agents associated in this kind of diseases. In the lactic industry, this bacteria is important since raw milks as well as dairy products have been associated in outbreaks, being fresh cheese one of the most vulnerable products to the contamination with this bacteria. The traditional identification of the bacteria is done by a laborious, time consuming and low sensitive technique and the polymerase chain reaction may allow more precise and exact results in shorter time. For this reason the objective of the present study was to optimize the procedure to determine the sensitivity and specificity limits for the detection of L. monocytogenes from fresh cheese and the predictive value of the test. In order to achieve this objective, 76 pasteurized cheese samples were evaluated (45 samples were artificially inoculated at the lab and 31 were used as negative controls). The validation of the technique was done in 50 samples of non pasteurized fresh cheese. Traditional culture isolation was performed according to the methodology described in Compendium of Methods for the Microbiological Examination of Foods. PCR reaction for the detection of L. monocytogenes was based on the methodology described by Poutou,using primers characteristic of the genus and the listeriolisine O gene that is specie’s specific. The optimal incubation period determined for the selective enrichment broth was of 48h, and a 100% sensitivity, specificity, predictive value (positive and negative ) were obtained by PCR. The technique validation showed the specificity of the test in the detection of only the L. monocytogenes species, and not other genus or species that may appear in food matrixes or in food environments.
Key words: Listeria monocytogenes, PCR, validation, sensitivity, specificity.
Centro de Investigación en Enfermedades Tropicales. Facultad de Microbiología, Universidad de Costa Rica. Costa Rica
Las enfermedades de origen alimentario son una realidad, tanto en países industrializados como en aquellos en vías de desarrollo y su frecuencia es persistentemente alta a pesar de diversos esfuerzos enfocados en disminuir su morbilidad y mortalidad (1). Listeria monocytogenes es uno de los agentes causantes de este tipo de enfermedad. Se trata de un bacilo Gram positivo con una distribución ubicua, incluyendo agua, suelo y alimentos, entre otros (2) y asociado a cuadros de meningitis, encefalitis, septicemia y abortos (3). Epidemiológicamente, este agente produce un bajo número de casos anuales y de baja morbilidad, no obstante, la mortalidad asociada es una de las más altas, variando entre 13 y 34% (4,5).
Varios brotes de listeriosis han sido asociados a productos alimenticios comerciales contaminados, tales como leche y derivados, vegetales y productos cárnicos, ya que en estos, la bacteria es capaz de multiplicarse aún a temperaturas de refrigeración, ante la presencia de altas concentraciones de sal y bajo pH (6). De la misma manera, esta bacteria ha sido aislada de varios ambientes dentro de las industrias alimentarias, pudiendo sobrevivir largo tiempo dentro de las mismas (7-9).
Dentro de la industria láctea, esta bacteria es de especial importancia, ya que, tanto la leche cruda como diversos derivados han sido involucrados en brotes, como es el caso de la leche pasteurizada, queso suave, leche saborizada y mantequilla entre otros (10,11). En la mayoría de los casos, se asocia su presencia a contaminación cruzada post proceso, ya que la bacteria es lábil a los tratamientos con altas temperaturas.
El queso fresco es especialmente vulnerable a contaminación con Listeria, dado su alto contenido de humedad, disponibilidad de nutrientes, concentración de sal de 1-3% y especialmente, la ausencia de procesos térmicos insuficientes en su industrialización. (12). Mundialmente, el porcentaje de positividad señalado para este tipo de producto varía entre 0% reportado en Italia y Nueva Zelandia, hasta un 43%, reportado en España, con una media del 9% (13).
En Costa Rica el queso fresco es un producto de amplio consumo. Cerca de una cuarta parte de la producción nacional de leche es dedicada a su elaboración y el consumo per cápita estimado oscila entre 4 y 5 kg anuales (14).
A nivel mundial existen diversas políticas con respecto al nivel de tolerancia de esta bacteria en alimentos listos para su consumo, no obstante, cada día mayor número de países adoptan una tolerancia cero (15,16). La identificación tradicional de este género a partir de alimentos resulta lenta, laboriosa y poco sensible en algunos casos. El método de la reacción en cadena de la polimerasa (PCR) podría permitir el obtener resultados precisos y exactos en menor tiempo, razón por la que el objetivo de este estudio es el evaluar esta técnica para la detección de L. monocytogens a partir de queso fresco, así como determinar los límites de sensibilidad, especificidad y valor predictivo de la prueba.
El proyecto se realizó en el Laboratorio de Microbiología de Alimentos de la Facultad de Microbiología durante los meses de enero 2009 a marzo 2010.
Para la determinación de la sensibilidad, especificidad, valor predictivo positivo y negativo de la técnica de PCR, se evaluaron 76 muestras de queso blanco procesado (46 muestras inoculadas, 31 sin inocular como control negativo), las cuales fueron adquiridas en expendios comerciales dentro del Área Metropolitana de San José, Costa Rica. El límite de detección se obtuvo a partir de cinco muestras de queso blanco pasteurizado e inoculado artificialmente en el laboratorio.
La validación de la técnica fue realizada en 50 muestras de queso fresco no pasteurizado, también adquirido en el Área Metropolitana.
Para la optimización de la técnica de PCR, se utilizó un cultivo joven de 24-48 horas en caldo tripticasa soya de L. monocytogenes ATCC 19116. De la misma manera, y para la determinación de la especificidad de la prueba de PCR se utilizaron cultivos jóvenes de Staphylococcus aureus ATCC 25922, Escherichia coli ATCC 25923, Pseudomonas aeruginosa ATCC 15442, L. innocua ATCC 33091 y Salmonella enteritidis ATCC 13076.
A partir de cada una de las muestras de queso evaluadas, se realizó un aislamiento de L. monocytogenes según la metodología descrita por Pouch (2001). Brevemente, se realizó un enriquecimiento selectivo utilizando caldo Listeria en una proporción 1:10. Este fue incubado 48 h a 35ºC. Posteriormente, se procedió a realizar un aislamiento en Agar Oxford, el cual fue incubado a 35ºC por 24-48h. Las colonias sospechosas (redondas, café oscuras y umbilicadas) fueron confirmadas mediante pruebas bioquímicas. Éstas incluyeron además tinción de Gram, luz de Henry, movilidad, utilización de xilosa y ramnosa, oxidasa, catalasa y prueba de CAMP.
La extracción de ADN de cada una de las cepas descritas se realizó según la metodología descrita por Holmes & Quigley (1981) la cual hace uso de buffer STET, lisozima y calor como agentes desnaturalizantes (18).
Se procedió a inocular 1,0 mL de la cepa de L. monocytogenes ATCC 19116 en muestras de 10 g de queso blanco pasteurizado. A cada una de éstas se le agregó 90 mL de caldo Listeria el cual fue incubado a 35ºC por 24 h y 48 h para determinar el tiempo óptimo de incubación del caldo selectivo para realizar la técnica de PCR. A partir del cultivo en caldo, se extrajo ADN según el método descrito por Holmes & Quigley como se mencionó anteriormente.
La reacción de PCR para la detección de Listeria monocytogenes se basó en la metodología descrita por Poutou y colaboradores (19). Los iniciadores utilizados LI11 (5’ CTCCATAAAGGTGACCCT3’) y U1 (5’CAGCMGC CGCGGTAATWC 3’) corresponden al ADNr 16S, tienen un tamaño de 938 b y son característicos del género, los iniciadores Lf (5’ CAAACGTTAACAACGCAGTA3’) y Lr (5’ TCCAGAGTGATCGATGTTAA 3’) corresponden al gen hlyA de la listeriolisina O, su tamaño es 750 pb y son específicos de especie.
La mezcla de trabajo (25 μL) fue constituida con 12,5 μL de master mix (0,05 U/μL de Taq polimerasa en buffer de reacción, 4mM MgCl2, y 0,4mM de cada dNTP, que incluyen: dATP, dCTP, dGTP y dTTP), 7,5 μL de agua bidestilada libre de nucleasas, 1,0 μL de cada imprimador (Lf, Lr, U1, LI1) y 1 μL del ADN bacteriano extraído . Como control positivo se utilizó ADN extraído de L. monocytogenes ATCC 19116, y como control negativo agua bidestilada estéril libre de nucleasas. La reacción se llevó a cabo en un termociclador THERMO® PxE 0,5 y las condiciones de termociclaje fueron de 94ºC por 1 min, seguido por 35 ciclos a 94ºC por 30s, 52ºC por 20s y 74ºC por 30 s, seguido de un paso final de extensión de 8 minutos a 74ºC.
Para la visualización de los productos de PCR se utilizaron geles de agarosa al 2% conteniendo bromuro de etidio en una concentración de 0,5 μg/mL. La corrida electroforética de los productos de PCR se realizó a 80 voltios por 35 minutos. Los productos fueron visualizados bajo luz ultravioleta utilizando un lector Uvitec BTX-26-M y fotografiados con una cámara digital Uvitec, Cambridge.
La reacción de PCR para la amplificación del segmento ARN16s se basó en la metodología descrita por Muyzer (20). Esta amplificación se realizó con el fin de confirmar la extracción de ADN bacteriano a partir de las muestras. Los iniciadores utilizados fueron 341f (5’CCTACGG GAGGCAGCAG3’) y 926r (5’ CCGTCAATTC(A/C)TTTGAGTTT3’). Las condiciones de termociclaje fueron 94ºC por 5 min, 30 ciclos de 94ºC por 60 s, 55ºC por 60 s, 72ºC por 60 s, un ciclo de extensión 10 minutos a 72ºC.
A partir de la cepa de L. monocytogenes ATCC 19116 en una concentración de 1010 UFC/mL (cuantificada en agar Oxford) se prepararon diluciones decimales en agua peptonada estéril (APE) al 0,1% de 10-1 a 10-9. De estas diluciones se inoculó 1,0 mL en 10 g de queso y se incubó a 35 C por 2 horas. Luego de esta incubación se procedió a agregar a cada muestra 90 mL de caldo Listeria el cual fue incubado a 35ºC por 48 h para realizar un enriquecimiento selectivo.
A partir de cada dilución enriquecida se hizo un aislamiento selectivo en Agar Oxford y la extracción de ADN descrita según la metodología de Holmes & Quigley (1981) para realizar la reacción de PCR.
Cada uno de los ADN extraídos de las cepas descritas en el punto 2 fueron enfrentados a los iniciadores utilizados para la detección de L.monocytogenes según la técnica de PCR descrita.
A partir de 76 muestras de queso fresco pasteurizado, se procedió a formar dos subgrupos: uno de 46 muestras el cual fue inoculado con L. monocytogenes ATCC 19116 (105 UFC/g) y un segundo subgrupo de 31 muestras utilizado como control negativo.
Ambos grupos fueron evaluados por la técnica de PCR y la de cultivo en placa con el fin de comparar los resultados obtenidos.
Se procedió a analizar 50 muestras de queso fresco adquiridas en el Área Metropolitana de San José, Costa Rica. Estas fueron transportadas en frío al Laboratorio de Microbiología de Alimentos de la Universidad de Costa Rica y analizadas mediante las técnicas de cultivo en plato y PCR optimizado según las metodologías descritas anteriormente.
A partir de los quesos inoculados y evaluados mediante la técnica de PCR se logró amplificar el patrón de bandas específico para L. monocytogenes de 938 y 750 pb.
Con respecto a la determinación del periodo óptimo de incubación para el caldo de enriquecimiento selectivo, en la Figura 1 se muestra que el de 48 horas fue el ideal, y que un período de 24 h de incubación no permite detectar la amplificación de las bandas específicas.
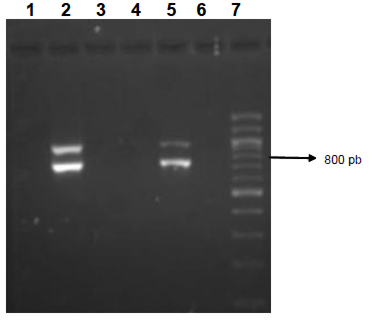
En cuanto a la especificidad de la técnica se observó inicialmente que había amplificación a partir de ADN de P.aeruginosa y S. aureus. Estas bandas desaparecieron al aumentar 1ºC la temperatura de anillaje.
La Figura 2 muestra los resultados obtenidos para el límite de detección de la prueba de PCR, el cual resultó ser de 10-9 UFC/g y de 10-6 UFC/g para la metodología de cultivo en placa.
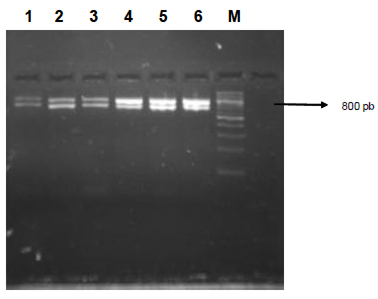
Los resultados de la evaluación de la técnica optimizada mediante la comparación con el estándar de oro de detección (método de cultivo) realizada en muestras de queso inoculadas y no inoculadas muestran una sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo del 100%, confirmándose la capacidad de la técnica de discriminar cepas de géneros diferentes, evitando falsos positivos, así como que los resultados obtenidos son satisfactorios, confiables y reproducibles, detectando muestras verdaderamente positivas.
Con respecto a la validación de la técnica de PCR para la detección de L. monocytogenes en queso blanco frente al método estándar, todas las muestras presentaron crecimiento bacteriológico, no obstante, únicamente se aisló colonias típicas (café oscuras, umbilicadas) en 32 (64%) de las mismas. El segmento de ARN16s usado como control de amplificación de ADN bacteriano fue positivo en todas las muestras. El PCR utilizado para la amplificación de L. monocytogenes, fue negativo para todas las muestras, de la misma manera que la cepas sospechosas identificadas bioquímicamente como L. innocua 22 (44%) y 10 (20%) como L. welshimeri.
La evalución del método de PCR para la identificación de L. monocytogenes en queso blanco no pasteurizado se realizó siguiendo la metodología utilizada por Poutou et al (19), obteniéndose la amplificación de las bandas características de L. monocytogenes (938 y 750 pares de bases), con lo cual se demuestra la funcionalidad de los iniciadores empleados. Otros autores han utilizado iniciadores distintos a los empleados en el presente trabajo para identificar tanto el género Listeria como la especie L. monocytogenes, pero su especificidad, comparada con los que amplifican fragmentos del gen de la listeriolisina O (hlyA), ha sido menor (21-24).
La evaluación del tiempo óptimo de incubación del medio de enriquecimiento selectivo (caldo Listeria) a 35ºC demostró que únicamente hubo amplificación en las muestras incubadas por 48 horas, lo que puede sugerir que a las 24 horas no hubo suficiente crecimiento para su detección. Esto contrasta con los resultados obtenidos por Torres et al. (5) quienes reportan que obtuvieron amplificación tanto en las muestras incubadas por 24 horas como en las de 48 horas. Tal situación podría explicarse con base a las diferentes matrices alimentarias evaluadas, ya que Torres y colaboradores validan el PCR para la detección de L. monocytogenes en carnes crudas de res y pollo, matrices totalmente diferentes en cuanto a composición y parámetros intrínsecos.
Los iniciadores empleados discriminaron bien entre todas las cepas bacterianas utilizadas (S. aureus ATCC 25922,E. coli, ATCC 25923, P.aeruginosa ATCC 15442, L. innocua ATCC 33091, y Salmonella enteritidis ATCC 13076). Cabe destacar que la selección de las bacterias evaluadas se basó en el hecho de que su frecuencia en queso blanco no pasteurizado es alta, tal y como ha sido demostrado por otros autores (25-26).
Esta alta especificidad también se corrobora durante la validación del la metodologia, cuando a nivel de cultivo se obtienen colonias con una morfología semejante a la de L. monocytogenes y que corresponden bioquímicamente a L. innocua y L. welshimer, pero la amplificación de las bandas específicas resulta negativa. Esta capacidad del método referente a discernir entre diferentes géneros bacterianos y aún entre especies del mismo género también fue reportada, a partir de diversas matrices alimentarias, por Scotter el al. (27).
De la misma manera, Poutou demostró una alta especificidad al enfrentar el ADN de 40 cepas bacterianas a los iniciadores utilizados en el presente trabajo, en el que únicamente 4 cepas de L. monocytogenes amplificaron las bandas de 938 pb y 750pb específicas para género y especie respectivamente; en tanto que cepas de L. innocua amplificaron solamente la banda de 938 pb mientras que las cepas restantes, distintas al género Listeria como, E. coli, P. aeruginosa y Salmonella spp entre otras no amplificaron ninguna de las bandas. (19). Este hallazgo resulta de suma importancia en los casos en que se da una asociación entre L. monocytogenes y otras especies del mismo género y con otros géneros bacterianos asociados (28).
El límite de detección obtenido para la PCR fue de 10-9 UFC/g, en contraste con el del método tradicional de cultivo el cual llegó hasta 10-6 UFC/g lo que permite deducir que el método propuesto posee una mayor sensibilidad que el segundo. Esta alta sensibilidad resulta muy deseable especialmente en productos de exportación, ya que es reconocido que a nivel mundial existen diversas políticas con respecto al nivel de tolerancia de esta bacteria en alimentos listos para su consumo, siendo cada día mayor número de países adoptan una tolerancia de cero (16).
La técnica de PCR evaluada en quesos frescos presentó una sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo de 100% en la detección de L. monocytogenes, superando el método tradicional del cultivo del cual se pudo demostrar su baja especificidad, y valor predictivo positivo. Resultados idénticos fueron obtenidos por Poutou et al. (19), Torres et al. (5) y Burbano (29) al obtener estos mismos valores en matrices alimentarias diferentes, incluyendo leches crudas, carne de res y pollo.
La validación de la técnica realizada a partir de quesos no pasteurizados y distribuidos de manera comercial pone de manifiesto la especificidad de la técnica en cuanto a detectar únicamente la especie L. monocytogenes, no así otras especies del mismo género que aparecen con relativa frecuencia en matrices y ambientes alimentarios pero que no representan un riesgo para la salud pública.
En lo que respecta al tiempo de análisis, Poutou et al. (19) reportan una reducción de los 5 días que tarda el método tradicional (cultivo) para obtener resultados presuntivos a 4 horas con el método alternativo (PCR) luego de tener extraído el ADN, lo cual coincide con la metodología que se optimizó en el presente trabajo. Esta rapidez de confirmación es un factor decisivo en la industria alimentaria ya que se deben de tomar decisiones rápidas en la liberación de los productos sospechosos de contener el agente patógeno. De la misma manera, el método optimizado permite una identificación a nivel de género en un tiempo mínimo, factor que se traduce en una mayor eficiencia en la liberación de lotes de alimentos.
Actualmente en Costa Rica la detección de L. monocytogenes se realiza, en la mayoría de los casos, mediante la técnica de cultivo en plato, lo cual se traduce en un tiempo prolongado antes de obtener un resultado final y de un costo considerable en medios de cultivo específicos. Los resultados obtenidos en la presente investigación ponen de manifiesto que la técnica de PCR optimizada para la detección de L. monocytogenes en queso fresco permite obtener resultados de una manera ágil y segura, metodología que se podría extender a otro tipo de matrices alimentarias y géneros bacterianos y así llegar a tener análisis más rápidos y eficientes.
Recibido: 28-07-2010
Aceptado: 25-11-2010