Los antioxidantes naturales presentes en los vegetales y en algunos animales han sido estudiados por su papel en la protección de diversas enfermedades como ciertos tipos de cáncer, enfermedades del corazón y la degeneración macular relacionada con la edad. Evidencia experimental sugiere que estos compuestos son importantes en la protección de macromoléculas biológicas contra el daño oxidativo. La búsqueda de nuevos y más eficientes antioxidantes al parecer va dirigida a los carotenoides, que han demostrado que a través de su consumo puede disminuir la incidencia de ciertas enfermedades. Además representan una fuente de provitamina A, y presentan una actividad antioxidante en la célula al actuar en la neutralización de especies reactivas de oxígeno y nitrógeno producidas como parte del metabolismo celular. Esta publicación tiene como objetivo revisar aspectos básicos y clínicos de investigaciones realizadas que asocian la ingesta de carotenoides con cáncer, enfermedades del corazón y la degeneración macular relacionada con la edad. Primero se identificaron los conceptos básicos sobre el papel que desempeñan los carotenoides en el metabolismo; posteriormente se revisó la evidencia clínica que muestra como la ingesta de carotenoides reducen ciertas enfermedades. Por último se discuten algunos de los resultados de investigaciones.
Palabras clave: Carotenoides, actividad antioxidante, especies reactivas de oxígeno y nitrógeno, prevención de enfermedades.
Natural antioxidant in vegetables, and in some animals have been studied by their action in the protection of a considerable number of diseases, such as, certain types of cancer, cardiovascular diseases, and age-related macular degeneration. Experimental evidences suggest that these compounds are important for protecting biological macro-molecules against oxidative damage. The search of new and more efficient antioxidants appears to be directed with carotenoids which have demonstrated that their consumption may reduce the incidence of certain diseases. In addition they represent a provitamin A source, and their actual antioxidant activity in the cell by participating in the neutralization of reactive oxygen species, and nitrogen produced, as a part of the cellular metabolism. This paper is focused to review basic and clinical aspects of investigations which have been associated with the intake of carotenoids with cancer, heart diseases, and age-related macular degeneration; the above all, we have tried to identify basic concepts of the role of the carotenoids and their metabolism; after that, we have reviewed clinical evidence that show how the intake of carotenoids reduces certain diseases. Finally, we discuss some of the results of investigation.
Key words: Carotenoids, antioxidant activity, reactive oxygen species and nitrogen, diseases prevention.
Departamento de Nutrición Animal. Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán.
México, D.F., México
Se realizó una revisión bibliográfica sobre los carotenoides y su función como antioxidantes con el objetivo de describir un tema que en la actualidad es de gran interés como las especies reactivas de oxígeno y nitrógeno. Se han llevado a cabo investigaciones que vinculan la ingestión de carotenoides con la prevención y/o disminución de riesgo e incidencia de ciertos tipos de cáncer, enfermedades cardiovasculares y degenerativas relacionadas con la edad. En este trabajo se presenta una visión general sobre conceptos, clasificaciones y características de los carotenoides como antioxidantes; se explican brevemente los mecanismos por los cuales se producen los daños de las especies reactivas de oxígeno y nitrógeno sobre el organismo y finalmente se abordan algunas investigaciones que vinculan a los carotenoides con la salud.
Desde el punto de vista químico, los carotenoides son tetraterpenos constituidos por unidades múltiples de isopreno con un anillo de ciclohexano sustituido e insaturado en cada uno de los extremos. Existen dos tipos de carotenoides: los carotenos, que no contienen oxígeno en sus anillos terminales y las xantofilas que si los tienen. Las funciones oxigenadas más comunes son los grupos hidroxi (OH) y epoxi (epóxidos 5,6- ó 5,8-). También se encuentran los grupos aldehído (CHO), ceto (C=O), carboxi (CO2H), carbometoxi (CO2Me) y metoxi (Ome). Se han aislado y caracterizado más de 600 carotenoides, pero este número es menor en los alimentos (1).
Los carotenoides son pigmentos liposolubles naturales sintetizados por las plantas, algas y bacterias fotosintéticas (2-5). Por su insaturación son sensibles al oxígeno, metales, ácidos, peróxidos, calor, luz y a las lipoxigenasas (6, 7). Algunos de éstos tienen la capacidad para actuar como provitamina A, dependiendo de la presencia de la β-ionona así como la conversión en retinol por los animales. Aproximadamente 50 de ellos serían precursores de vitamina A basándose en consideraciones estructurales. Virtualmente todas las muestras de alimentos carotenogénicos de plantas analizados hasta la fecha contienen β-caroteno como constituyente principal o menor. De esta manera, este carotenoide es importante por tener dos anillos de β-ionona al cual se le asigna un 100% de actividad. Otros carotenoides con actividad de provitamina A son: α-caroteno (50-54%), β-zeacaroteno (20-40%), γ-caroteno (50-52%), β-criptoxantina (50-60%) y β-apo-8’-carotenal (72%), mientras que las xantofilas zeaxantina, luteína, licopeno, astaxantina y violaxantina no son precursores de esta vitamina (8).
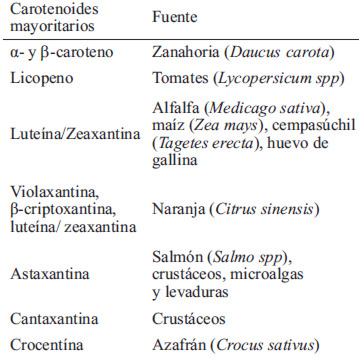
La característica distintiva de los carotenoides es el extenso sistema de dobles enlaces conjugados, denominado cadena poliénica. Esta parte de la molécula conocida como cromóforo es responsable de la capacidad de los carotenoides de absorber luz en la región visible y, en consecuencia, de su gran capacidad de coloración (1). En las verduras el contenido en carotenoides sigue el modelo general de los cloroplastos de todas las plantas superiores siendo de mayor a menos cantidad la luteína, β-caroteno, violaxantina, neoxantina, zeaxantina, β-criptoxantina y anteraxantina. En frutos las xantofilas se encuentran en mayor proporción, aunque en algunos casos, como en el jitomate, el licopeno es el más abundante. Se ha reportado que en ciertas frutas solo están presentes uno o dos carotenoides, este es el caso del género Capsicum (pimientos) que contienen capsantina y capsorubina (Tabla 1) (1, 9).
Los factores que influyen en la presencia de carotenoides son el genotipo, manejo precosecha, estado de madurez, así como las operaciones de procesado y conservación. Entre éstos la temperatura e intensidad de la luz tienen una gran influencia en el contenido de los carotenoides. Así mismo, se ha estudiado el efecto que las operaciones de procesado, cortado, lavado, envasado y conservación, tienen sobre el contenido de estas moléculas (10). Durante el procesamiento y almacenamiento la oxidación y los cambios estructurales al aplicar calor son los principales factores que los alteran. El empacado de alimentos congelados y esterilizados en atmósferas libres de oxígeno ayuda a mantener el contenido de carotenoides (4). Sin embargo, el tipo de suelo, riego y fertilización no afectan significativamente el contenido de éstos (1, 10-15).
Actualmente se habla de alimentos funcionales, es decir, aquellos que tienen grupos de compuestos quíque ejercen un efecto directo en la salud debido a que actúan directamente en la prevención o reducción de alguna enfermedad. Dentro de este nuevo esquema, se ha identificado un grupo químico que tiene la principal característica de actuar como antioxidantes (16). Éstos se han clasificado en dos sistemas: el enzimático (endógeno) y el no enzimático (exógeno). El primero se basa en una defensa que incluye a la superóxido dismutasa, catalasa, glutatión peroxidasa, tiorredoxina reductasa y al glutatión reductasa. La superóxido dismutasa permite la disminución del ión superóxido en peróxido de hidrógeno y cuya acumulación se evita por el sistema de catalasa/glutatión peroxidasa, transformándolo en oxígeno no molecular, agua y glutatión oxidado. Cuando este sistema se sobrepasa, se presenta una sobreproducción de iones superóxido (O2- •) y de peróxido de hidrógeno (H2O2), dando lugar al radical oxhidrilo (OH•) que es una molécula altamente reactiva alterando la estructura de proteínas, ácidos nucleicos y lípidos (Tabla 2) (16).

El segundo sistema es paralelo al primero y muy útil cuando éste se satura. Está formado por compuestos llamados depuradores de radicales libres; sin embargo, cuando se involucran a moléculas en las que el oxígeno ó nitrógeno son el elemento reactivo de su estructura, se les denomina especies reactivas de oxígeno y nitrógeno (ERON) (O2-, HO, NO), incluyendo en éstas a moléculas precursoras de los radicales libres (H2O2, HONO”-). Dentro de los depuradores de estas ERON más conocidos están los tocoferoles, ácido ascórbico, flavonoides (quercitina, luteolina, catequinas), antocianinas, ácidos fenólicos y carotenoides (1, 11, 12, 16,18-22).
Las funciones y acciones de los carotenoides están determinadas por las propiedades físicas y químicas de las moléculas. Primero, la geometría integral molecular (tamaño, tipo, presencia de grupos funcionales) es vital para asegurar que el carotenoide es afín con las estructuras celulares y subcelulares en la localización y orientación correcta que permite una eficiente función. Segundo, el sistema de dobles enlaces conjugados determina las propiedades fitoquímicas y reactividad química que forma la base de estas funciones. Además, las interacciones específicas con otras moléculas en la vecindad inmediata son cruciales para el funcionamiento correcto (23, 24).
Los carotenos son transportados en el organismo por el plasma, por lo que se ha considerado que algunos de ellos (α- o β- caroteno) podrían servir como biomarcadores para determinar la ingesta de vegetales y frutas y clarificar la relación dieta-enfermedad. Es el α-caroteno quien ha mostrado tener la mayor correlación con la ingesta (24-26). El mecanismo de acción de los carotenoides en la salud humana no se ha definido claramente. Una posible hipótesis es que los carotenoides, incluyendo pero no limitándose al β-caroteno, sirven como un supresor superóxido O2- • (forma altamente reactiva) y como antioxidante en la prevención del daño de las ERON a compuestos celulares críticos. Los carotenoides no actúan solos en este proceso ya que existe otro grupo de componentes dietarios y endógenos que también funcionan como antioxidantes. Debido a que los mecanismos que implican los efectos en la salud humana de estos agentes o sus combinaciones no están bien definidos, la presunción de que están actuando solamente como antioxidantes in vivo limita, más que expandir, el horizonte conceptual. Un mejor termino para cualquier efecto benéfico o adverso, que se puede establecer a partir de los estudios epidemiológicos es como “modulador fisiológico” (25-27).
Los carotenoides tienen la capacidad de inactivar algunas especies de moléculas en estado de excitación electrónica principalmente las debidas a reacciones fotosensibles. Como se sabe, la luz puede convertir moléculas a una forma electrónicamente excitada de vida corta, pero que pueden interactuar con otras de su misma especie para formar una molécula estable. Esta última es la que puede reaccionar con una gran variedad de moléculas para iniciar las reacciones fotoquímicas (1). En algunas circunstancias se pueden iniciar dos tipos de reacciones: 1) reaccionar con varias moléculas y generar ERON que pueden dar lugar a reacciones diversas y dañar a las células; y 2) reaccionar directamente con el oxigeno y formar una molécula de oxígeno singulete. Esta molécula es extremadamente reactiva capaz de iniciar la peroxidación de lípidos al reaccionar con ácidos grasos saturados, de inactivar proteínas y enzimas al reaccionar con aminoácidos como metionina, histidina, triptófano o tirosina o bien de oxidar residuos de guanina en el ADN o ARN. Se ha demostrado que los carotenoides son muy efectivos para la inactivación de (1O2); de esta manera los éstos pueden atrapar catalíticamente el (1O2) y evitar el daño fotoxidativo iniciado por esta molécula reactiva (22,23).
β-caroteno. Carotenoide con actividad de provitamina A, siendo 1 equivalente de actividad de retinol (EAR) (μg) igual a 1/12 μg de β-caroteno + 1/24 μg de otros carotenoides con actividad de provitamina A (28). Para hacer el cálculo de EAR para los carotenoides que actúan como provitamina A, deben tomarse en cuenta una serie de factores: tipo de carotenoide, matriz en la que se encuentre, tipo de proceso al que es sometido el alimento, interacciones entre carotenoides, grasa y fibra, el estado nutricional, edad e infección por parásitos (9). Esto ha traído como consecuencia el establecer procedimientos actualizados para el cálculo de los factores de conversión para los carotenos con actividad provitamina A (29).
El papel del β-caroteno en enfermedades coronarias ha sido objeto de una serie de estudios que proporcionan datos que en ocasiones son contradictorios por lo que se ha propuesto que dicha prevención se debe más al consumo de alimentos ricos en β-caroteno que al pigmento en particular. Otros estudios han reportado que su relación es más eficiente en la protección del riesgo de cáncer en piel como consecuencia de la radiación UV. Ya que el β-caroteno inhibe a las ERON y al oxigeno singulete producido por la peroxidación lipídica en los liposomas y en los sistemas biológicos, actuando como agente fotoprotector que bloquea las reacciones fotoquímicas en la epidermis las cuales involucran al oxigeno singulete y a radicales de oxigeno generados por la exposición UV (9, 30).
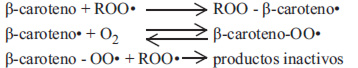
Burton (31) propuso que la acción del β-caroteno frente al radical peroxilo generaría otro radical con el carbono central estabilizado por resonancia (Tabla 3).
Licopeno. En relación con el metabolismo vegetal, el licopeno es quien dá inicio a la síntesis de otros compuestos, constituyendo la base molecular de los carotenoides. La fuente alimenticia más importante de licopeno es el tomate (Lycopersicum spp) y sus derivados (salsa, kétchup, jugo, etc.).
Estudios epidemiológicos sugieren que el consumo de licopeno tiene un efecto beneficioso en la salud humana reduciendo la incidencia de las patologías cancerosas, sobre todo de pulmón, tracto digestivo, cardiovasculares y del envejecimiento, y en el caso del hombre se concentra principalmente en la próstata, lo que podría explicar su acción preventiva en la aparición de cáncer en este órgano (32). Giovannucci et al. (33), realizaron un estudio con 48,000 sujetos durante seis años, en donde concluyeron que el consumo frecuente de tomate y/o subproductos, redujeron en un 45% las posibilidades de desarrollar este tipo de cáncer. Otros beneficios reportados por el consumo de licopeno son la reducción en la incidencia de patologías cancerosas de pulmón y tracto digestivo, así como enfermedades cardiovasculares (ECV).
Sin embargo, Howard et al (34-37), no pudieron asociar el consumo de licopeno con una disminución en el riesgo de cáncer de mama y las ECV en mujeres de edad madura. Estos investigadores sugieren que el licopeno dietario u otros fitoquímicos presentes en los productos del tomate con una base aceitosa u oleosa, proporcionan beneficios cardiovasculares; aunque estos resultados requieren la confirmación con otras cohortes donde se pueda asociar el consumo de licopeno y su concentración en plasma.
En 2005, el Journal of Nutrition publicó una serie de artículos sobre licopeno y su efecto en la salud, mencionando: 1) Las variaciones en los niveles de licopeno en plasma y el consumo de tomate en países europeos, 2) Investigaciones epidemiológicas sobre el licopeno y cáncer de próstata, 3) Consumo típico de licopeno, 4) Factores que modifican la biodisponibilidad, aumento y distribución de diferentes isómeros del licopeno, entre otros.
En relación al efecto del licopeno sobre los osteoblastos se ha publicado información que denota que no hay un consenso sobre su efecto: uno de ellos indica que estimula la proliferación celular y el otro no; sin embargo, ambos encontraron que tenía un efecto estimulador sobre la actividad de la alanina-fosfatasa (ALP), un marcador de diferenciación osteoblástica en células maduras. La discrepancia en el efecto del licopeno sobre la proliferación de las células puede ser diferente en especies o condiciones experimentales, por lo que se requieren más estudios para clarificar su acción sobre los osteoblastos (38,39).
Por otro lado, la ingeniería genética ha desarrollado plantas transgénicas de tomate con un mayor contenido de licopeno, fitoeno, y luteína (40).
Luteína/Zeaxantina. A diferencia de los carotenos, las xantofilas no poseen actividad provitamínica A. La zeaxantina es el estereoisómero de la luteína. Mediante una conversión enzimática, el organismo puede obtenerla a partir de luteína, cuya presencia en la naturaleza es mayor. Esta última actúa como filtro protector de las plantas frente a la luz azul del espectro por lo que se cree que en los tejidos humanos, como en la piel (30) y en la retina (9), actuaría de la misma manera.
Astaxantina. Es una xantofila presente en microalgas (Haematococcus pluvialis y Chlorella zofingiensis) en la levadura (Phaffia rhodozyma), crustáceos (camarón y langostino), peces (salmón) y algunas aves (flamingo) (41). En estos organismos la astaxantina se encuentra ligada a una proteína mediante enlaces no covalentes, formando compuestos estables e hidrosolubles de color azul-grisáceo o verdoso llamados carotenoproteínas(42). Al ser hidrolizados estos compuestos, ya sea por calentamiento (como sucede durante la cocción de los invertebrados comestibles), o por solventes orgánicos, se libera la astaxantina exhibiendo su característico color rojo-naranja. En algunos casos, el compuesto puede estar asociado firmemente con el material tegumentario como la quitina o el carbonato de calcio, impidiendo su completa extracción aún con solventes orgánicos (43). La astaxantina ha llamado la atención por su alto potencial bioactivo que incluye su actividad antioxidante, anticancerígena, antidiabética y antiinflamatoria y por sus efectos protectores en los sistemas gástrico, hepático, neurológico, cardiovascular, ocular y piel que en muchos casos es más potente que el de otros carotenoides (44-49).
Durante los últimos años (2005-2011), las pruebas epidemiológicas que apoyan un efecto protector de los carotenoides frente al desarrollo de enfermedades crónicas y degenerativas han crecido considerablemente. La hipótesis de que nutrientes antioxidantes (β-caroteno, luteína/zeaxantina, licopeno, astaxantina, entre otros) puedan jugar un papel preventivo frente al cáncer, enfermedades cardiovasculares, cataratas y degeneración macular por la edad se basa en pruebas experimentales que sugieren que estos compuestos funcionan como antioxidantes, moduladores de la respuesta inmune, modificadores de procesos inflamatorios y de transducción de señales en y entre células. Esto aunado a la distribución preferencial a determinados tejidos, permite el planteamiento de mecanismos biológicos por los cuales estos compuestos pueden disminuir el riesgo de enfermedades crónicas (7, 50-79).
Sin embargo, los carotenoides pueden perder su acción antioxidante a concentraciones altas o a una presión parcialmente alta de oxígeno (pO2) en los sistemas biológicos, por lo que han mostrado una tendencia a actuar como prooxidantes y los primeros en demostrar esta acción fueron Burton e Ingold (80).
Diversos estudios in situ han tratado de identificar la naturaleza de los productos provenientes de la oxidación de los carotenoides. La interacción del β-caroteno con el humo del cigarro en un sistema modelo ha producido principalmente el 1-nitro-β-caroteno y el 4-nitro-β-caroteno, quienes reaccionarían con el oxígeno formando radicales peroxilo. Estos compuestos estarían actuando con los lípidos provocando una alteración en el carotenoide o en pO2 que tendría una influencia en la concentración del radical peroxil-carotenoide o en la autooxidación del carotenoide. Sin embargo no hay suficiente evidencia que valide la hipótesis de que los carotenoides pueden actuar como prooxidantes en un sistema biológico, por lo que se puede considerar como una tendencia en la disminución de su actividad antioxidante (23).
Otras investigaciones mencionan que la actividad antioxidante de los carotenoides puede cambiar a actividad prooxidante, dependiendo del potencial redox de las moléculas de los carotenoides así como del medio ambiente en el que actúan. El potencial prooxidante de estos compuestos está determinado por varios factores, incluyendo oxígeno, concentración de carotenoides y sus interacciones con otros antioxidantes (81).
Con los resultados de las investigaciones realizadas hasta el momento quedan aun preguntas por resolver; sin embargo, con los datos disponibles en la actualidad es posible señalar que existe un efecto positivo entre los carotenoides y su acción preventiva de ciertos tipos de cáncer, enfermedades cardiovasculares y aquellas relacionadas con la edad.
Su acción prooxidante deberá definirse para poder establecer las condiciones adecuadas bajo las cuales se aseguren los efectos benéficos por el consumo de alimentos con alto contenido en carotenoides.
Recibido 15-08-2011
Aceptado: 14-10-2011