Los alimentos complementarios más utilizados son las dietas caseras. En el presente trabajo se evaluó la disponibilidad de hierro y zinc en una dieta infantil de consumo habitual conteniendo pan fortificado con diferentes fuentes de hierro: sulfato ferroso, bisglicinato ferroso, NaFeEDTA. También se utilizó pan sin fortificar con agregado de ácido ascórbico, citrato de sodio o Na2EDTA como promotores de la absorción, combinada con diversas bebidas. La dieta (papa, zapallo, sémola, pan y manzana) se combinó con agua, leche, té, bebida cola y bebida artificial a base de naranja. La dializabilidad (D) mineral, como indicador de la disponibilidad potencial fue determinada utilizando un método in vitro. El análisis estadístico se realizó utilizando ANOVA, con test de Tukey a posteriori.
No hubo diferencias significativas en la DFe entre las dietas del pan fortificado con sulfato o bisglicinato; con el NaFeEDTA aumentó significativamente (p<0,05). El aumento de la DFe fue mayor en las dietas que tenían panes con promotores que en las que tenían panes fortificados. La bebida a base de naranja aumentó la DFe, mientras que el té y la leche la disminuyeron significativamente (p<0,05). La DZn aumentó en forma significativa cuando el pan estaba fortificado con sulfato o NaFeEDTA, pero no cuando se fortificó con bisglicinato. El agregado de té o leche disminuyó la DZn mientras que la bebida a base de naranja la aumentó significativamente (p<0,05). En relación a los promotores, las mayores DFe y DZn se observaron en las dietas con el pan sin fortificar, con agregado de Na2EDTA.
Palabras clave: Alimentación complementaria, dializabilidad de minerales, fortificación de alimentos.
Home-made diets are the most frequently used complementary foods. In the present work we evaluated iron and zinc availability in a usually consumed infant diet containing either iron-fortified bread with different iron sources: ferrous sulfate, ferrous bisglycinate, NaFeEDTA. We also used non-fortified bread with absorption promoters: ascorbic acid, sodium citrate, Na2EDTA, combined with different beverages. The diet (potato, pumpkin, grits, bread, and apple) was combined with water, milk, tea, a soft drink and an orange-based artificial drink. Mineral dialyzability (D) as an indicator of potential availability was determined using an in vitro method. Statistical analysis was performed by ANOVA, and a posteriori Tukey test. There were no significant differences in FeD between diets with ferrous sulfate or ferrous bisglycinate fortified bread; in NaFeEDTA fortified bread it increased significantly (p<0.05). Iron D increase was greater in diets with bread containing absorption promoters than in those with fortified bread. The orange-based artificial drink increased FeD, while tea and milk decreased it significantly (p<0.05). Zinc D increased significantly when the bread was fortified either with ferrous sulfate or NaFeEDTA, but remained unchanged in diets with ferrous bisglycinate fortified bread. The addition of tea or milk decreased ZnD while the orange-based artificial drink increased it significantly (p<0.05). Regarding absorption promoters, the greater values both in FeD and ZnD were observed in diets with iron nonfortified bread containing Na2EDTA.
Key words: Complementary feeding, mineral dialyzability, food fortification.
Cátedra de Bromatología. Facultad de Farmacia y Bioquímica. UBA.
Instituto de Tecnología Alimentaria. Universidad Nacional del Litoral. Buenos Aires. Argentina
La Organización Mundial de la Salud (1) recomienda la incorporación de alimentos complementarios a partir del sexto mes de vida, momento en que la mayoría de los lactantes comienzan a consumir papillas semisólidas, como parte de su alimentación. Estos alimentos complementarios juegan un rol muy importante en la nutrición infantil. En Argentina, las dietas caseras se encuentran entre las variantes más usadas y más recomendadas por los pediatras.
Un aspecto muy importante de los alimentos complementarios se refiere a su digestibilidad, su aporte de proteínas de alta calidad y de minerales esenciales (2, 3). Es habitual que el hierro, calcio y zinc se encuadren entre los nutrientes críticos por encontrarse en niveles sustancialmente inferiores a los recomendados (1, 4).
Por otra parte, la fortificación de alimentos de consumo masivo es una de las estrategias costo-beneficio más utilizada para prevenir las deficiencias poblacionales de minerales. En Argentina, desde el año 2003, la harina de trigo se enriquece con sulfato ferroso, con el objetivo de disminuir la prevalencia de anemia en la población.
La disponibilidad de los micronutrientes, especialmente de los minerales, es particularmente importante ya que muchos componentes presentes en los alimentos / dietas, afectan su absorción y utilización, al igual que la forma química de los minerales de fortificación (5). Una opción adicional para mejorar la absorción del mineral propio de la matriz así como la del mineral de fortificación consiste en el agregado a los alimentos de promotores de la absorción mineral.
Las distintas fuentes de hierro usadas como fortificantes presentan ventajas y desventajas para su aplicación (6). Los compuestos de hierro utilizados comprenden a algunos que son solubles en agua, en ácidos diluidos, o insolubles en agua. Los compuestos de hierro solubles en agua o en ácidos diluidos tienen buena biodisponibilidad pero son también los más reactivos. Catalizan reacciones oxidativas que producen cambios en las características organolépticas de los alimentos (7). También se utilizan complejos de aminoácidos como el bisglicinato ferroso o el glicinato férrico, que además de poseer buena biodisponibilidad, no poseen las cualidades prooxidantes del sulfato ferroso (8).
En el caso de las dietas con importantes cantidades de inhibidores de la absorción del hierro, sería conveniente utilizar promotores de la absorción y/o fortificantes cuya biodisponibilidad sea superior a la del sulfato ferroso. En la actualidad existen tres fuentes que poseen este potencial, el NaFeEDTA, la hemoglobina y complejos de aminoácidos como el bisglicinato ferroso ya mencionado (9). La absorción del NaFeEDTA puede ser 2,5 veces mayor que la del sulfato ferroso, según la matriz alimentaria (10). Esto se debería a que los fitatos de los cereales tienen poco efecto inhibitorio sobre esta fuente (11). Sin embargo, en nuestro país el uso del NaFeEDTA como fuente de fortificación no está permitido. Por ello, sería una buena estrategia recurrir al agregado de diferentes promotores de la absorción para permitir que el hierro del sulfato ferroso estuviera más disponible para ser asimilado.
Para el caso del zinc la situación es muy similar a la del hierro. Si bien no es habitual que los alimentos de consumo masivo estén fortificados con zinc, sí lo están los destinados a lactantes o niños de la primera infancia, debido a que la deficiencia de este mineral provoca la detención del crecimiento, alteraciones del desarrollo cognitivo y problemas en el sistema inmune (1). Por otra parte, otros alimentos o bebidas habitualmente presentes en la dieta podrían afectar la absorción de estos minerales (12).
El objetivo del presente trabajo es el estudio de la disponibilidad de hierro y zinc en una dieta complementaria de consumo habitual conteniendo pan fortificado con diferentes fuentes de hierro: sulfato ferroso, bisglicinato férrico, NaFeEDTA, o bien pan sin fortificar con agregado de ácido ascórbico, citrato de sodio o Na2EDTA como promotores de la absorción, combinada con diversas bebidas.
Se elaboró una dieta infantil de consumo habitual (13) con los componentes y proporciones indicados en la Tabla 1. Los componentes utilizados en la dieta estaban cocidos, tal como se consumen. El pan empleado fue elaborado en el laboratorio. Se realizó una primera mezcla con procesadora doméstica, de los componentes sólidos: zapallo (Cucurbita moschata), papa (Solanum tuberosum L.), sémola de trigo (Triticum vulgare) preparada con caldo de verduras y manzana (Pirus malus L.), a excepción del pan. Posteriormente se tomaron 132g de esta mezcla y se le adicionaron 11g de pan y 68g de alguna de las bebidas. Con estos componentes se realizó la mezcla final que luego fue sometida al análisis.

Las bebidas ensayadas fueron: agua, leche, té, bebida cola (BC) y bebida artificial a base de naranja (BAN). Las condiciones de preparación para estas bebidas fueron: té (1 saquito/250 ml de agua ultrapura a ebullición), bebida artificial a base de naranja (24 g de polvo para preparar bebidas/300 ml de agua ultrapura).
El pan se fortificó con tres fuentes distintas de hierro: sulfato ferroso (SO4Fe), bisglicinato férrico y Na-FeEDTA. En todos los casos se obtuvo una concentración de 30 ppm de Fe en el pan que es el nivel de enriquecimiento obligatorio en Argentina.
La concentración de los promotores de la absorción en los panes fue de 300 ppm de ácido ascórbico (AA), 1,2% de citrato de sodio y 30 mg% de Na2EDTA.
Las relaciones finales Fe:promotor en cada uno de los panes fueron de 1:2 en el caso del pan con AA; 1:50 en el que tenía agregado de citrato y 1:1 en el pan con EDTA.
En el caso del AA, una relación 1:2 sería suficiente para ejercer el efecto promotor. En trabajos realizados previamente se pudo observar que esta relación incrementaba de manera significativa la DFe (14).
En estudios realizados en humanos se observó que la acción promotora del citrato no se evidenciaba a bajas relaciones molares Fe:promotor (1:10) pero sí lo hacía a elevadas concentraciones de citrato (1:50), siendo además dosis-dependiente (15, 16).
Para el EDTA se trabajó con una relación Fe:EDTA 1:1 que es suficiente para incrementar la biodisponibilidad de Fe en dietas ricas en fitatos (17). La ventaja del EDTA es su elevada constante de afinidad por el hierro, mayor que la que poseen este tipo de inhibidores. Esto asegura una buena competencia entre inhibidor y promotor. Por otra parte, cuando la relación EDTA:Fe es mayor a 1 hay una marcada disminución de la absorción de hierro (18).
La dializabilidad de los minerales (D) como un indicador de la biodisponibilidad potencial fue determinada por medio de un método in vitro (19), modificado por Wolfgor et al (20). El procedimiento involucra una digestión enzimática en condiciones que simulan las fisiológicas. Cada muestra fue homogeneizada para facilitar su posterior análisis. Alícuotas de 50 g de los homogeneizados fueron incubadas con 5 ml de una solución acuosa al 3% de α-amilasa, durante 30 minutos a 37º C con agitación. Luego, el pH se ajustó a 2 con solución valorada de HCl 6N, y se agregaron 1,6 ml de pepsina-HCl (16 g/100 ml en HCl 0,1N), incubándose la mezcla a 37º C durante dos horas, con agitación (digestión estomacal). Dos alícuotas de 15 g del digerido se colocaron en erlenmeyers con bolsas de diálisis (Spectrapore Molecular Weight cut-off 6000-8000) conteniendo 18,75 ml de buffer PIPES 0,15 M y pH variable. El pH del buffer a utilizar fue establecido luego de hacer ensayos previos en base a la matriz alimentaria en estudio (21), para obtener un pH final uniforme de 6,5 0,2, al final de la segunda incubación a 37º C. Después de una hora de incubación, cuando el pH alcanzó un valor mínimo de 4,5, se agregaron 3,75 ml de una mezcla de bilis-pancreatina (2,5% bilis y 0,4% pancreatina en NaHCO3 0,1N) prosiguiéndose la incubación durante dos horas a 37º C (digestión intestinal). Las bolsas de diálisis fueron removidas y enjuagadas con agua ultrapura y los dializados se transfirieron a tubos tarados y se pesaron. Los minerales dializados se determinaron por espectroscopía de absorción atómica (22, 23).
El contenido total de minerales de las muestras fue determinado en el digerido de pepsina por espectroscopía de absorción atómica previa mineralización con una mezcla HNO3 -HClO4 (50:50).
La dializabilidad mineral fue calculada como el porcentaje del mineral dializado con respecto a la concentración total de mineral presente en cada muestra.
Dializabilidad % del mineral =

El análisis estadístico se realizó utilizando ANOVA y Test de Tukey a posteriori (p< 0,05).
La concentración de hierro era de 0,20 mg% cuando la dieta contenía pan sin fortificar. Las dietas con pan fortificado con sulfato ferroso, bisglicinato férrico y NaFeEDTA contenían 0,45 mg%, 0,53 mg% y 0,44 mg%, respectivamente.
No hubo diferencias significativas entre las dietas del pan fortificado con sulfato ferroso o bisglicinato férrico, pero sí con el NaFeEDTA, donde el aumento fue muy significativo en todas las combinaciones estudiadas (p<0,05) (Fig.1).
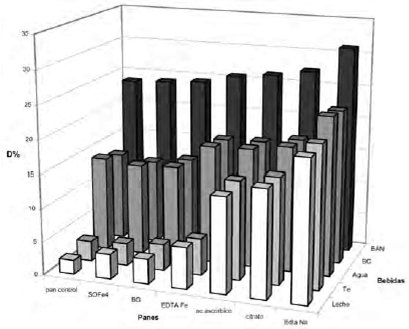
Al comparar los tres promotores se pudo observar que la mayor DFe se obtuvo en las dietas que contenían el pan con agregado de EDTA sódico (p<0,05). Entre las dietas que contenían ácido ascórbico o citrato de sodio no se observó ninguna diferencia significativa (Fig 1).
Por otra parte, el aumento de la D fue mucho más elevado en las dietas que tenían panes con agregado de promotores de la absorción que las que tenían panes fortificados (Fig 1).
Cuando se combinó la dieta con las diferentes bebidas se pudo observar que la bebida artificial a base de naranja era la que más aumentaba la DFe (Fig 1).
La bebida cola no produjo variación en la DFe con respecto al control con agua. En cambio, tanto el té como la leche la disminuyeron significativamente (Fig 1).
La concentración de zinc en las dietas estudiadas fue de 0,25 mg%.
Al analizar los valores de la DZn se observó (Fig 2) que no existía diferencia significativa entre las dietas con agregado de ácido ascórbico y citrato pero sí con la dieta que tenía agregado de Na2EDTA (p<0,05).
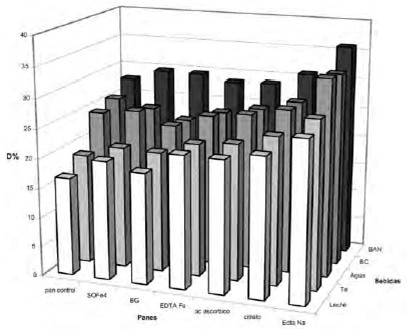
Sin embargo, en los panes fortificados con las distintas fuentes de hierro la DZn varió dependiendo de la bebida utilizada. (Fig 2). Si bien cuando la bebida empleada fue agua no existió diferencia significativa entre el control y las tres fuentes de hierro estudiadas, si comparamos las tres fuentes de hierro entre sí, se observó que al utilizar bisglicinato la DZn tendía a ser menor que cuando las fuentes eran sulfato ferroso y Na-FeEDTA (Fig 2).
Tampoco se pudo observar diferencia significativa en las dietas que tenían panes con ácido ascórbico o citrato de sodio y las dietas con panes con sulfato ferroso o EDTA Fe (Fig 2).
Cuando la dieta se combinó con las diferentes bebidas se observó que la inclusión de té o leche provocó una disminución de la DZn. Al agregar la bebida a base de naranja se observó un aumento significativo de la DZn (p<0,05). No se observó una variación significativa con el uso de bebida cola. (Fig 2)
En las dietas en las que la fuente de hierro era Na-FeEDTA, o el promotor utilizado era EDTA sódico, la DFe aumentaba de manera muy marcada.
La alta disponibilidad potencial del NaFeEDTA se puede atribuir a que el hierro en este quelato está más fuertemente ligado, que en el bisglicinato o sulfato ferroso, y también posee una constante de afinidad por el hierro mayor que los inhibidores presentes. De la misma manera, cuando el EDTA es utilizado como promotor, formaría complejos más estables que los que forma el Fe con los fitatos, que son los principales inhibidores en esta dieta. Estos resultados son concordantes con los observados en otros estudios (24, 25).
Sin embargo, hay que tener en cuenta que el EDTA posee una Ingesta Diaria Admisible (IDA) de 0-2,5 mg/kg/día (26). Por lo tanto debe considerarse la Ingesta Diaria Potencial (IDP) de este aditivo no sólo para controlar los niveles de adición aprobados por la legislación, sino también frente a la posibilidad de utilizar FeNaEDTA como fortificante de alimentos.
En un estudio realizado en Argentina en 2007, en un grupo de 199 niños de entre 3 y 18 años, la IDP obtenida fue de 0,04mg/Kg (27). En Argentina, los alimentos en los que se autoriza el agregado de EDTA son las bebidas sin alcohol y las mayonesas. Los resultados indican que la IDP está muy lejos del valor de la IDA, lo cual sería un buen comienzo para profundizar estudios y plantear la posibilidad de utilizar este compuesto ya sea como fortificante o como promotor.
El aumento de la DFe con la bebida artificial a base de naranja se atribuye a la presencia de los ácidos cítrico y ascórbico que son importantes promotores de la absorción del hierro. Cabe destacar que la acción del ácido ascórbico involucra la reducción del ion férrico a su forma ferrosa, mejor absorbida, la formación de quelatos solubles y estables con el hierro en el estómago y por ende el mantenimiento de su solubilidad cuando el alimento ingresa en el ambiente más alcalino del duodeno. Este último efecto se puede explicar por el hecho de que el ácido ascórbico forma complejos solubles con el hierro de los alimentos a pHs más bajos que los ligandos inhibitorios, es decir que actuaría a nivel estomacal donde las condiciones de pH son desfavorables para la formación de complejos con otros ligandos. Estos efectos, que ocurren en el tracto gastrointestinal, serían los mismos que explican el marcado incremento de la dializabilidad observada in vitro, en condiciones que simulan las fisiológicas (12, 28).
Por otra parte, la absorción de hierro en las dietas que contienen leche es afectada adversamente por la presencia de proteínas lácteas y calcio (29-30-31). La presencia de grupos fosfoserina en las subunidades de caseína, puede explicar la unión del hierro a péptidos de caseína insolubles y, por lo tanto, la disminución de la DFe y su biodisponibilidad.
En el caso del té, el efecto depresor sería causado por los polifenoles presentes, que son ligandos inhibidores de la absorción del hierro no hemínico. Estudios en ratas demostraron que los polifenoles forman complejos insolubles con el hierro y el zinc que precipitan y por lo tanto no pueden dializar. Estos complejos también pueden ser de un alto peso molecular lo que impediría tanto su diálisis como su absorción in vivo (32).
Existen evidencias de una alta correlación entre los estudios de dializabilidad de hierro in vitro y los estudios realizados en humanos (33).
El hecho de que no se observaron diferencias significativas en la dializabilidad de zinc en las dietas que tenían panes con ácido ascórbico o citrato de sodio y las dietas con panes con sulfato ferroso o FeEDTA, se debería a una competencia en la dializabilidad del hierro y del zinc, de tal manera que al haber mayor cantidad de hierro en el medio, la dializabilidad del zinc se vería afectada (34).
Tal como se indicó para el hierro, la inclusión de té o leche provocó una disminución de la DZn. Los polifenoles presentes en el té ejercerían un efecto inhibitorio sobre la absorción del Zn (35). En el caso de la leche el efecto inhibitorio se debería al calcio presente que, junto con los fitatos de la dieta, formarían complejos insolubles que impiden la absorción del Zn (36).
En la combinación con la bebida a base de naranja, el aumento significativo de la DZn se debería a que el ácido cítrico presente en esta bebida, es uno de los promotores de la absorción de zinc. Este forma de complejos con el ácido cítrico que lo mantendría soluble a pHs fisiológicos y así ejercería un efecto positivo sobre su absorción (37).
Los resultados permiten concluir que varios factores influyen sobre la biodisponibilidad potencial de hierro y zinc. La bebida utilizada en la dieta, la fuente de hierro empleada como fortificante o el promotor de la absorción mineral agregado en el pan son determinantes de la disponibilidad mineral.
Las dietas que contenían sales de EDTA como fortificante o promotor fueron las que presentaron mayores valores de DFe y Zn, por lo que su utilización parece promisoria. Si bien los resultados en este estudio fueron obtenidos utilizando métodos in vitro permiten tener una idea de la bioaccesibilidad de los minerales en las dietas evaluadas.
Proyectos PICTR0110 y UBACYTB063.
Recibido: 09-12-2010
Aceptado: 08-06-2011