En el presente trabajo se estudió el efecto de la administración subcutánea de 250, 500 y 750 μg (10.000, 20.000 y 30.000 UI, respectivamente) de vitamina D3 (calciferol)/día durante 8 días, sobre las concentraciones séricas de vitamina D3 y de 25-hidroxivitamina D3 (25-OH-D3) y sobre las concentraciones séricas y tisulares de Ca, Zn, Cu y Fe en 45 ratas macho Wistar, de 12 semanas de edad y con pesos entre 180 y 200 gramos. El grupo control estuvo integrado por 15 ratas Wistar sanas, con género, edad y peso similares a los animales tratados. La administración del calciferol a dosis altas produjo una hipervitaminosis D que se caracterizo por un aumento en el contenido sérico de la vitamina D3 y de 25-OH-D3, diversos signos clínicos (por ejemplo, anorexia, pérdida marcada de peso, diarreas sanguinolentas, conjuntivitis bilateral y muerte), hipercalcemia, hipocincemia, hipercupremia, hipoferremia y una alteración en la distribución tisular de Ca, Zn, Cu y Fe en comparación con los controles no tratados. La hipercalcemia y la inflamación son un hallazgo prominente en la hipervitaminosis D. La inflamación o la infección inducen cambios sistémicos, conocidos colectivamente como la respuesta de fase aguda. Entre las variadas alteraciones que produce esta respuesta encontramos hipoferremia, hipocincemia e hipercupremia. Es probable que estas respuestas estén mediadas, en parte, por la producción y liberación de citocinas como la interleucina 1, interferones (IFN-alfa), la interleucina 6 (Il-6) y el factor de necrosis tumoral (TNF). El desarrollo de la hipoferremia durante la inflamación requiere de hepcidina, un péptido rico en enlaces disulfuro, regulador del metabolismo del hierro, sintetizado en el hígado en respuesta a la liberación de Il-6 durante la inflamación/infección. En conclusión, nuestros resultados proporcionan evidencias que la administración de altas dosis de vitamina D, a corto plazo, determina diversos signos clínicos, produce un marcado aumento de las concentraciones séricas de la vitamina D3 y de 25-OH-D3 y una marcada alteración en las concentraciones séricas y tisulares de Ca, Zn, Cu y Fe, que dependen de las dosis inyectadas de vitamina D.
Palabras clave: Vitamina D3, calciferol, intoxicación, signos clínicos, hipercalcemia, hipocincemia, hipercupremia, hipoferremia, citocinas
In the present work the effect of subcutaneous administration of 250, 500 and 750 μg (10.000, 20.000 and 30.000 IU, respectively) of vitamin D3 (calciferol) daily for eight days, on serum concentrations of vitamin D3 and 25-hydroxyvitamin D3 (25-OH-D3) and on serum and tissue concentrations of Ca, Zn, Cu and Fe in 45 white male Wistar rats, aged 12 weeks and weighing 180-200 g, have been studied. The group control was integrated by 15 healthy rats with similar characteristics (strain, gender, age and weight) that treated animals. Administration of high doses of calciferol produced a hypervitaminosis D characterized by a significant (p<0.05) increase in serum vitamin D3) and 25-OH-D3, diverse clinical signs (such as, anorexia, marked loss of body weight, bloody diarrhea, bilateral conjunctivitis, and death), hypercalcemia, hypozincaemia, hypercupremia, hypoferraemia and an alteration in the tissue distribution of Ca, Zn, Cu and Fe as compared with untreated controls. Hypercalcemia and inflammation are prominent findings in hypervitaminosis D. Inflammation or infection induce systemic changes, collectively known as the acute phase response. Among the varied alterations that together produce this response are hypoferraemia, hypozincaemia and hypercupremia. It is likely that these responses are mediated, in part, by production and release of cytokines such as interleukin 1, interferons (IFN-alpha), interleukin 6 (Il-6) and tumor necrosis factor (TNF). The development of hypoferraemia during inflammation requires hepcidin, an iron regulatory hormone, a disulfide-rich peptide, produced in the liver in response to the release of Il-6 during inflammation/infection. In conclusion, our results provide evidence that short-term administration of high doses of vitamin D determined diverse clinical signs and produced a marked increase of serum vitamin D3 and 25-OH-D3 and a marked alteration in the serum and tissue concentrations of Ca, Zn, Cu, and Fe. These changes depend on the doses given of vitamin D.
Key words: Vitamin D3, calciferol, intoxication, clinical signs, hypercalcemia, hypozincaemia, hypercupremia, hypoferraemia, citokines
Departamento de Química. Facultad de Ciencias.
Escuela de Nutrición y Dietética. Facultad de Medicina. ULA. Mérida. Venezuela
Fisiológicamente, la vitamina D3 (VD3) no es biológicamente activa por sí misma y debe ser primero hidroxilada en el hígado muy probablemente por el CYP2R1, una enzima citocromo P450-monooxigenasa microsomal, para producir la forma plasmática de la vitamina D, la 25-hidroxivitamina-D3 (25-OH-D3). Este compuesto en concentraciones fisiológicas es biológicamente inactivo y debe ser convertido posteriormente en una forma hormonal activa, la 1,25-dihidroxivitamina-D3 (1,25-(OH)2-D3) para realizar las funciones fisiológicas de la vitamina D. La hidroxilación final de la vitamina D3 se realiza en las células tubulares proximales del riñón por el CYP27B1, una citocromo P450-monooxigenasa (1α-hidroxilasa) que requiere O2 molecular y ferrodoxina reducida, estrechamente regulada por las necesidades de calcio y fósforo (1).
Se conocen diversas interacciones entre estos metabolitos de la VD3 y el Zn, Fe y Cu, a tal punto que el estado nutricional del Zn modula la respuesta del 1,25-OH2-D3 frente al agotamiento corporal de Ca y de P (2), quizás por un efecto del metal sobre la actividad de la 1α-hidroxilasa renal. En ratas intoxicadas con Cu, la conversión de la 25-OH-D3 en 1,25-OH2-D3 está alterada. In vitro, la actividad de la 1α-hidroxilasa de la 25-OH-D3 está disminuida en las mitocondrias renales de los animales intoxicados con Cu (3). Heldenberg et al.(4) en niños con anemia ferropénica y concentraciones séricas bajas de 25-OH-D3, encontraron que el tratamiento con sales de hierro aumenta las concentraciones séricas de Fe y de 25-OH-D3, llegando a la conclusión que la carencia de hierro inhibe la transformación de la vitamina D en 25-OH-D3 y/o altera la absorción de la vitamina D a nivel intestinal, además la carencia alimentaria de Zn, por su parte, incrementa la concentración sérica de 25-OH-D3.
Los párrafos precedentes muestran la interacción tan estrecha entre estos elementos traza y la vitamina D. Tomando en consideración la hipótesis de que la administración de dosis altas de vitamina D3 (calciferol) produce un aumento marcado de las concentraciones séricas y tisulares de Ca, Zn, Cu y Fe, a partir de un modelo experimental se pretende evaluar la aparición de manifestaciones clínicas y la modificación de las concentraciones séricas y tisulares de estos elementos en relación a las diferentes dosis de calciferol administradas a ratas sanas. Por esta razón, en el presente trabajo se estudió el efecto de la administración de dosis altas de vitamina D3 (calciferol) sobre el contenido sérico y tisular de Ca, Zn, Cu y Fe en ratas blancas sanas. Simultáneamente se valoro el contenido sérico de vitamina D3 y de 25-OH-D3 y se investigo la presencia de manifestaciones clínicas determinadas por la hipervitaminosis D3.
El Protocolo fue aprobado por el Departamento de Nutrición, Escuela de Nutrición, Facultad de Medicina (ULA), que se encargó de velar por el buen uso y cuidado de los animales de laboratorio y avaló los procedimientos experimentales utilizados en estas ratas.
Se utilizaron 60 ratas blancas macho Wistar, de edad y peso uniforme (160-170 g) mantenidas en jaulas individuales de acero inoxidable, en el ambiente del Laboratorio, durante dos semanas, para las adaptaciones correspondientes. Se controló la temperatura y la humedad del cuarto entre 23-25°C y 55-67%, respectivamente. Todas las ratas se alimentaron con una dieta basal formulada en nuestro Laboratorio. Las ratas se alimentaron ad libitum y se les permitió el libre acceso al agua de bebida.
Al finalizar este periodo, los animales se distribuyeron al azar en 4 grupos, con 15 ratas en cada uno, sin que hubiese diferencias significativas previas entre los promedios de peso de los distintos grupos. Los grupos G1 al G3 (grupos tratados) recibieron diariamente inyecciones subcutáneas de 250 μg (10.000 UI), 500 μg (20.000 UI) y 750 μg (30.000 UI) de calciferol (Vitamina D3 Sigma; 25 μg = 1000 UI) disueltos en aceite de maíz, durante 8 días. Al grupo control (GC) se le administró por la misma vía, y durante el mismo lapso, aceite de maíz. A las 24 horas de administrada la última dosis de vitamina D o de aceite de maíz, según los casos, los animales se anestesiaron con éter etílico, en campana de vidrio y se les extrajo sangre por punción del seno retro-orbitario, mediante tubos de microhematocrito. Las muestras se recolectaron en tubos de centrífuga graduados, sin anticoagulante y después se centrifugaron a 2.500 rpm, durante 15 minutos, a fin de asegurar la pronta obtención de los sueros que se utilizaron para las determinaciones correspondientes. Después de extraer la sangre, los animales se decapitaron con una guillotina Harvard y se desangraron durante 1-3 minutos. Se practicó laparotomía mediana dejando al descubierto los lóbulos hepáticos y los riñones. Para minimizar la contaminación sanguínea, el hígado y el riñón derecho se perfundieron in situ a través de la vena porta y la arteria renal derecha, respectivamente, con una solución fría de sacarosa 0,25M (p/v) libre de metales. Al final del periodo de perfusión, el hígado y el riñón, se disecaron y se colocaron en un plato de Petri, colocado sobre hielo. De cada uno de los órganos, se pesaron trozos de 1 g, en balanza de precisión, que se prepararon y se sometieron a digestión ácida asistida por microondas, de acuerdo al método de Burguera et al. (5). La instrumentación y la técnica empleada para la determinación de los cationes en los sueros y en los digeridos ácidos se publicaron previamente (6). La vitamina D3 y su metabolito, el 25-OH-D3, se determinaron mediante HPCL líquida de alta resolución en fase reversa por detección de diodos, de acuerdo con la técnica descrita por Brunetto et al. (7).
Los resultados se expresaron como promedios y desviaciones típicas. Se asignó un valor de p<0.05 como valor de α para el análisis de dos colas. El tamaño de la muestra utilizado en este estudio confiere un poder estadístico del 0,85 y un nivel de detección de diferencia del 20% con una desviación estándar de 10. Las diferencias entre los valores séricos y tisulares de los cationes y la concentración de VD3 y de su metabolito, entre los grupos tratados y el control, se estimaron mediante el ANOVA de una vía y la prueba de Tukey post-ANOVA. El análisis de regresión lineal se utilizó para establecer las relaciones entre los diversos cationes séricos y tisulares, la concentración de VD3 y su metabolito y las dosis administradas de vitamina D. Toda p<0,05 se considero estadísticamente significativa. Los análisis se realizaron utilizando el paquete estadístico STATGRAPHICS PLUS 5.0.
Con la dosis de 250 μg de vitamina D3, el hallazgo más significativo fue la aparición de una diarrea mucosanguinolenta a partir de la segunda dosis en la gran mayoría de los animales experimentales; igualmente, se pudo observar pérdida del apetito y de peso. En este grupo ninguna rata falleció. El grupo de animales que recibió una dosis de 500 μg mostraron a partir de las 48 horas, una conjuntivitis concomitantemente con diarrea mucosanguinolenta, pérdida de peso, poliuria, letargia, debilidad muscular y vómitos hemorrágicos. En este grupo 2 ratas fallecieron al séptimo día de iniciada la administración del calciferol. En el grupo tratado con 750 μg de calciferol se observó a partir de las 24 horas: marcada diarrea mucosanguinolenta, disminución de la diuresis con emisión de orinas blanquecinas, pérdida exagerada de peso, malas condiciones generales, marcada conjuntivitis bilateral y hemorragias a nivel conjuntival. En este grupo se produjo la muerte de dos ratas en el octavo día de iniciada la administración de la vitamina
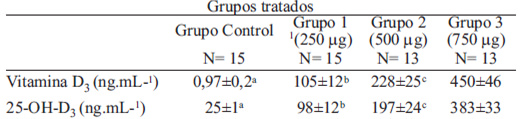
Concentración sérica de vitamina D3 y de 25-OH-D3 La concentración sérica de vitamina D3 y de 25-OH-D3 en las ratas tratadas con vitamina D3 se muestra en la Tabla 1. El análisis de regresión simple demostró que la vitamina D3 (r= 0,864) y la 25-OHD3 (r= 0,997) incrementan sus concentraciones séricas significativamente (p<0,05) en las ratas tratadas con calciferol. El análisis estadístico también demostró diferencias significativas (p<0,05) al comparar las concentraciones de la vitamina D3 y de la 25-OH-D3 entre los diversos grupos tratados y el grupo control; en este sentido, el incremento en las concentraciones de estos compuestos es directamente proporcional a las dosis administradas de vitamina D3.
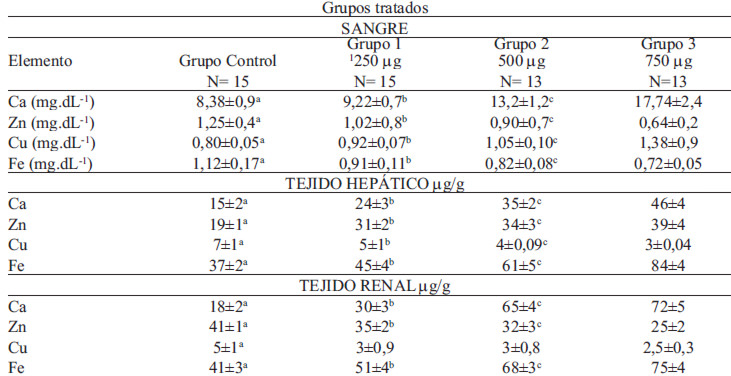
Las variaciones en las concentraciones séricas de los cationes en los animales tratados se muestran en la Tabla 2. El análisis de regresión simple demostró que el Ca (r= 0,965) y el Cu (r= 0,965) incrementan sus concentraciones significativamente (p<0,05) mientras que las concentraciones de Zn (r=-0,961) y Fe (r=-0,978) disminuyen (p<0,05) en los animales tratados. El análisis estadístico mediante el ANOVA de una vía demostró diferencias significativas al comparar las concentraciones séricas de los metales valorados entre el grupo control sano y los grupos tratados con vitamina D. La mayor variación de las concentraciones séricas de los metales valorados se encontró en los animales tratados con 30.000 UI de vitamina D3 (750 μg de colecalciferol). El análisis de regresión simple también demostró relaciones significativas y positivas entre Ca-Cu (r= 0,985), Ca-vitamina D3 (r= 0,937) y Ca-25-OH-D3 (r= 0,991) mientras la relación Ca con los elementos Zn y Fe (r=-0,997; r=-0,889, respectivamente) son significativas (p<0,05) e inversamente proporcionales.
La concentración hepática de Ca, Zn, Cu y Fe enel hígado de las ratas tratadas con vitamina D3 semuestra en la Tabla 2. El análisis de regresión simpledemostró que el Ca (r= 0,886), el Zn (r= 0,957) y elFe (r= 0,978) incrementan sus concentraciones significativamente(p<0,05) mientras que la concentraciónde Cu (r= -0,983) disminuye significativamente(p<0,05) en los animales tratados. El análisis estadísticomediante el ANOVA de una vía demostró diferenciassignificativas al comparar las concentracioneshepáticas de los metales valorados entre el grupo controlsano y los grupos tratados con vitamina D. Lamayor variación de las concentraciones séricas de losmetales valorados se encontró en los animales tratadoscon 750 μg de calciferol.
Las concentraciones de Ca, Zn, Cu y Fe en el riñón de las ratas tratadas con vitamina D3 se muestran en la Tabla 2. El análisis de regresión simple demostró que el Ca (r= 0,967%) y el Fe (r= 0,995) incrementan sus concentraciones (p<0,05) mientras que las concentraciones de Zn (r=-0,989) y de Cu (r= -0,873) disminuyen significativamente (p<0,05) en los animales tratados. El análisis estadístico mediante el ANOVA de una vía demostró diferencias significativas (p<0,05) entre el grupo sano y los grupos tratados con vitamina D. La mayor variación de las concentraciones séricas de los metales valorados se encontró en los animales tratados con 750 μg de calciferol.
La vitamina D3 administrada en exceso determinó una hipervitaminosis D aguda que se demostró por el marcado incremento de los niveles séricos de la vitamina D3 y de su metabolito: el 25-OH-D3, la hipercalcemia, los signos clínicos descritos y los cambios en las concentraciones séricas y tisulares de los metales cuantificados.
El incremento en la concentración sérica de la vitamina D y de su metabolito en las ratas tratadas con vitamina D es un hecho descrito en la literatura. El marcado incremento en la concentración del 25-OHD3 se debe a que la reacción de 25-hidroxilación de la vitamina D, a nivel hepático, es un proceso que no está sujeto a una estricta regulación homeostática (1), por consiguiente, cuanto mayor es la cantidad de vitamina D administrada es mayor la cantidad de 25-OH-D3 producida. El 25-OH-D3 circula normalmente a concentraciones de 30 a 50 ng/ml en la mayoría de las especies. Sin embargo, durante la intoxicación con vitamina D, se incrementa de 200 a 400 ng/ml (8). Cuando circula en concentraciones muy altas el 25-OH-D3 puede competir efectivamente con la 1,25-OH2-D3 por los receptores en el intestino y el hueso e inducir acciones habitualmente atribuibles al 1,25-OH2-D3. Por esta razón, el 25-OH-D3 se piensa que es el factor crítico en la intoxicación por vitamina D (9). En la mayoría de las especies, la concentración plasmática de 1,25-OH2-D3 disminuye durante la intoxicación (9) o se mantiene en concentraciones normales (10). Los estudios de Littledike y Horst (8) en vacas lecheras son muy definitivos en este punto y sugieren que el CYP27B1 renal está efectivamente inhibido en esta situación.
Shephard y DeLuca (10) sugieren que los roedores pueden tolerar concentraciones plasmáticas de 25-OH-D3 en el rango de 250-1000 nmol/L (100-400 ng/mL), aunque otros investigadores indican que las concentraciones plasmáticas de 25-OH-D3 asociadas con la toxicidad son siempre superiores a 375 nmol/L (150 ng/mL) (8). Sin embargo, incluso en ausencia de pruebas definitivas para establecer el metabolito responsable, la gran cantidad de estudios realizados en animales y en humanos sobre la intoxicación por vitamina D indican que la concentración plasmática de 25-OH-D3 es un buen biomarcador de la toxicidad, y que el umbral para los síntomas tóxicos es ≈ 750 nmol/L (300 ng/mL), (11) que concuerda con nuestros resultados. Cuando la 25-OH-D3 circula a concentraciones tan elevadas, que sobrepasan su capacidad de combinación a la proteína transportadora de vitamina D (DBP), llega al receptor de vitamina D (VDR) localizado en el núcleo de las células blanco y causa una exagerada expresión de los genes, con las secuelas características (11).
En los animales tratados encontramos un incremento (p<0,05) significativo en las concentraciones de Ca en sangre (hipercalcemia) y en tejidos, que concuerda con los trabajos previos realizados en humanos y en diferentes especies (12, 13). Esta hipercalcemia se considera secundaria al incremento en la destrucción del tejido óseo, que determina la salida del catión en grandes cantidades hacia la sangre (14).
Los signos clínicos detectados en la presente investigación se caracterizan entre otros, por diarrea mucosanguinolenta, poliuria, letargia, debilidad muscular, vómitos hemorrágicos, pérdida exagerada de peso, conjuntivitis bilateral, hemorragias a nivel conjuntival y muerte que coinciden con los descritos en la literatura (15). La inflamación de la conjuntiva y la hemorragia a nivel corneal se deben a la deposición de calcio descrita, a este nivel, por Imaizumi et al. (16) en ratas y perros.
La hipercalcemia, a su vez, cuando se prolonga causa precipitaciones de sales de calcio y de fósforo predominantemente en diversos órganos blandos (riñones, corazón, pulmón, estómago, hígado y otros órganos), que provocan un marcado daño inflamatorio, que puede evolucionar hasta una necrosis, lo cual compromete el normal funcionamiento de estos órganos (17-20).
Los resultados también demuestran como hechos característicos hipocincemia, hipercupremia e hipoferremia y alteraciones en la distribución tisular de estos elementos traza. Es un hecho conocido que la inflamación/infección induce cambios sistémicos, conocidos colectivamente como la respuesta de fase aguda. Entre las variadas alteraciones que producen esta respuesta encontramos: hipoferremia, hipocincemia e hipercupremia. Es probable que estas respuestas estén mediadas, en parte, por la producción y liberación de citocinas como la interleucina 1 (Il-1), la interleucina 6 (Il-6), los interferones (IFN-alfa2) y el factor de necrosis tumoral (TNF) (21). Estos cambios se piensa que son aspectos beneficiosos de la respuesta de fase aguda temprana y se pueden considerar como un mecanismo de defensa frente a los procesos infecciosos/inflamatorios (22). La mayoría de estos cambios se observan en cuestión de horas o días después de la aparición de la infección o la inflamación (22). La Il-1, una proteína termolábil, que se libera en los tejidos lesionados, y que favorece la captación de Zn y de Fe a nivel del tejido hepático, con una salida incrementada de Cu hacia la circulación, se señala, por algunos investigadores, como el principal mediador de la respuesta de fase aguda y como una posible causa de los cambios séricos de los oligoelementos asociados con esta respuesta (23).
La disminución del Zn y de los aminoácidos séricos y su depósito elevado en el hígado es fundamental para la síntesis incrementada de las diversas “proteínas de fase reactiva aguda” (entre ellas, la ceruloplasmina), que intervienen en los mecanismos de defensa del huésped frente a los procesos inflamatorios e infecciosos (24). La alteración del Cu es común durante los estados infecciosos e inflamatorios (22). Se cree que los cambios en el metabolismo del Cu son secundarios a un aumento de la síntesis hepática y a la liberación de ceruloplasmina y del Cu hacia el plasma. Este hecho es de importancia: primero, porque la ceruloplasmina tiene propiedades antiinflamatorias y gobierna la capacidad antioxidante del plasma y, segundo, porque el Cu tiene propiedades bactericidas y antiinflamatorias (25). El aumento de la concentración sérica de Cu, generalmente empieza muy pronto en el curso de una inflamación aguda o de una infección, pero es menos acelerada en comparación con los cambios que presentan el Zn y el Fe (22).
La anemia que se observa comúnmente en pacientes con hipervitaminosis D es una entidad clínica bien conocida (26,27) y posiblemente relacionada con la hipoferremia y la diarrea mucosanguinolenta detectadas en esta condición experimental. En la actualidad se conoce que la citoquina inflamatoria Il-6 (28) induce la producción hepática de hepcidina, un péptido rico en enlaces –S-S, de fase reactiva aguda que inhibe la absorción intestinal y la liberación de Fe desde los macrófagos e incrementa el secuestro del metal en sus órganos de depósito (29) con producción de una anemia ferropénica.
En conclusión, nuestros resultados proporcionan evidencias que la administración de altas dosis de vitamina D, a corto plazo, determina hipercalcemia, diversos signos clínicos, produce un marcado aumento de las concentraciones séricas de la vitamina D3 y de 25-OH-D3 y una marcada alteración en las concentraciones séricas y tisulares de Zn, Cu y Fe, que dependen de las dosis inyectadas de vitamina D. En el presente estudio no se determinó la concentración plasmática del 1,25-(OH)2-vitamina D3 y de diversas proteínas como la proteína C reactiva (PCR), la ceruloplasmina y el orosomucoide (proteínas de fase reactiva aguda) que son muy útiles para documentar de una manera más efectiva la presencia de la inflamación en estos animales, los cuales serán evaluados en investigaciones futuras en la hipervitaminosis D aguda experimental.
Recibido 07-04-2011
Aceptado: 29-08-2011