Los oligoelementos cobre, magnesio, manganeso y zinc intervienen en numerosos procesos metabólicos, enzimáticos, inmunológicos y tisulares, forman parte estructural de proteínas y pueden participar en la regulación de la expresión genética. La deficiencia de estos elementos esenciales dificulta el apropiado funcionamiento del organismo e induce el desarrollo de diversas enfermedades. Se debe garantizar la incorporación de oligoelementos a través de la dieta; sin embargo, la cantidad suministrada no siempre es suficiente y el uso de suplementos nutricionales convencionales presenta dos problemas; el primero se atribuye a la asociación de los metales a sales inorgánicas que generan una baja absorción e intolerancias a nivel gástrico y el segundo corresponde a las interacciones antagonistas entre diversos metales componentes de la formulación. Como una alternativa a los problemas mencionados, en este trabajo se propone la elaboración de tabletas para la administración oral de nuevos complejos de cobre, zinc, magnesio y manganeso ligados a los aminoácidos glicina y asparagina. En la síntesis de estos complejos, cada ligando se unió a duplas de cationes no antagonistas, se verificó la formación de los complejos por espectroscopía infrarroja, calorimetría de barrido diferencial, análisis termogravimétrico y difracción de rayos X de polvos, y se determinaron los tiempos de desintegración y de disolución in-vitro a las formas farmacéuticas finales.
Palabras clave: Aminoácidos, oligoelementos; complejos; desintegración; disolución.
Oligoelements such as copper, magnesium, manganese and zinc are involved in several metabolic, enzymatic and immunological processes. They are also important for the integral tissue proteins and could be involved in gene expression regulation. The deficiency of these essential elements hampers the appropriate function of the body and may cause various diseases. Therefore, it is important to guarantee the incorporation of these trace elements in the diet, but the quantity provided is not always adequate for the optimum body performance. Currently, conventional nutritional supplements have two major problems. The first one is attributed to the association of inorganic salts with metals which might cause low absorption and gastric intolerance. The second problem is caused when several metals are present in a formulation which could lead to possible antagonistic interactions. For this reason, this study explores the development of cations (i.e., copper, zinc, magnesium and manganese) and amino acids (i.e., glycine and asparagine) new complexes formulated into compacts for oral administration. In each reaction, ligands were linked to non-antagonistic cation pairs. The complex formation was characterized by infrared spectroscopy, differential scanning calorimetry, thermogravimetric analysis and powder X-ray diffraction analyses. Compact disintegration and in-vitro dissolution tests for these complexes were also determined.
Key words: Aminoacid, oligoelements; complex; desintegration; dissolution.
Universidad de Antioquia. Facultad de Química Farmacéutica.
Departamento de Farmacia. Medellín, Colombia.
A los oligoelementos cobre (Cu), magnesio (Mg), manganeso (Mn) y zinc (Zn) se les atribuyen diversas funciones biológicas que los relacionan con el metabolismo, el crecimiento, la respuesta inmune, la función cardiaca y la actividad nerviosa. El déficit de estos oligoelementos en el organismo se manifiesta en enfermedades como: aterosclerosis, osteoporosis, diabetes e incluso cáncer (1). Los alimentos y el uso de suplementos nutricionales pueden proporcionar al organismo los requerimientos diarios de metales; sin embargo, los metales obtenidos de la dieta no son suficientes y en la mayoría de las formulaciones nutricionales, se asocia el oligoelemento a sales inorgánicas (cloruros, sulfatos, carbonatos, óxidos, etc) que dificultan su absorción y causan molestias gástricas (2, 3). La fibra, los fitatos y algunos elementos provenientes de la dieta (especialmente hierro y calcio) pueden causar inhibición de la absorción de los cationes antes mencionados (4). Estudios previos muestran una adecuada absorción de metales cuando están unidos a aminoácidos ya que se vehiculizan en conjunto a través vías metabólicas de asimilación de las moléculas orgánicas sin generar problemas en el tracto digestivo (5). Por otro lado, las interacciones antagonistas entre metales deben ser consideradas en el diseño de la formulación del suplemento (6).
En este trabajo se presenta la síntesis y caracterización por espectroscopía infrarroja (FTIR), calorimetría de barrido diferencial (DSC), análisis termogravimétrico (TGA) y difracción de rayos X de polvos (DRXP), de cuatro nuevos complejos preparados a partir de los aminoácidos glicina (Gly) y L-asparagina (Asn) y duplas de los cationes no antagonistas Cu-Zn y Mg-Mn. Con los complejos obtenidos se elaboraron tabletas de adecuada desintegración y disolución.
La relación metal:metal:aminoácido utilizada para la formación de los complejos fue 1:1:4. En la síntesis 0.01 moles de los respectivos cationes (acetato de Cu, óxido de Zn, carbonato de Mg o sulfato de Mn Merck) se disolvieron en 25 mL de agua desionizada, posteriormente se adicionaron 25 mL de etanol (J.T. Baker) y 0.04 moles del aminoácido (Gly o Asn Merck), disueltos en 25 mL de agua desionizada (manteniendo una temperatura de 30°C). La solución se agitó durante una hora a 70°C y luego se enfrió en un baño de hielo para hacer precipitar los cristales, los cuales fueron removidos por filtración, utilizando papel de filtro Advantec MFS No. 131 finalmente los cristales se secaron a temperatura ambiente (25 °C ± 2°C) por 72 horas (7).
Se tomaron microfotografías electrónicas de los complejos utilizando un microscopio electrónico de barrido JEOL JSM6490LV, con el fin observar las características morfológicas y superficiales de las partículas de cada uno de los complejos.
La determinación del contenido de metal se realizó por absorción atómica en un equipo Perkin Elmer AAnalyst 300, con lámparas Curtis Indachron Lumina TM Lamp de Mg, Mn y Zn. El contenido de Cu se determinó por espectroscopía UV-VIS en un espectrómetro Hach DR5000, mediante la formación de un complejo coloreado con amoniaco [Cu(NH3)4], que absorbe a 636 nm (8).
La humedad en los complejos se obtuvo en una balanza Ohaus MB200, utilizando 5 g de muestra a una temperatura de 85°C durante 15 minutos (9).
Estas mediciones se realizaron a los ligandos libres y a los complejos. Los FTIR fueron realizados en un espectrofotómetro Perkin Elmer Spectrum Bx, entre 4400 cm-1 y 500 cm-1 con pastillas de KBr. Los estudios de DSC se realizaron en un calorímetro Netzsch DSC 200 PC-phox, en un intervalo de 25°C a 500°C a 10°C min-1, con crisoles de aluminio y en atmósfera de aire. El TGA se llevó a cabo en un analizador termogravimétrico TA Instruments Hi-Res TGA 2950, con flujo de 40mL min-1 en atmósfera de aire, en un rango de temperatura entre 25°C y 500°C, a una velocidad de calentamiento de 10°C min-1. Los DRXP, fueron realizados en un difractómetro de rayos X para polvos Rigaku, provisto de una fuente de Cu (λ=1,5418 Ǻ), operado a 40 kV y 30 mA y realizando un barrido 2 ϴ de 3° a 50° a una velocidad 2°/min.
La cantidad de complejo utilizado en cada formulación (66.58mg de Gly-Cu-Zn, 99.40mg de Asn-Cu-Zn, 39.95mg de Gly-Mg-Mn o 65.65mg de Asn-Mg-Mn), se calculó con el resultado de contenido de metal y teniendo en cuenta no exceder el nivel de ingesta máximo tolerable de los metales (10mg de Cu, 40mg de Zn, 400mg de Mg y 11mg de Mn ) (10). Para la formulación se utilizó glicolato de almidón sódico Explosol Blanver al 3%, talco Protokimica al 3%, dióxido de silicio Aerosyl al 0.1% y celulosa microcristalina Avicel PH101 Biopolymer como excipientes (11).
Después de la mezcla y conminución de los polvos, se realizó una prueba de homogeneidad en el mezclado, contrastando contra una curva estándar la concentración de metal contenida en la mezcla de polvos (12).
Para la obtención de las tabletas de cada formulación, se comprimieron 200mg de la mezcla homogénea de polvos en una máquina tableteadora de una estación Modelo Compac 060804, Indemec con punzones de ¼ pulgada cóncavos. El rango de presiones utilizadas fue de 1900 a 2100 psi durante 30segundos.
El ensayo de desintegración en las tabletas se realizó por triplicado en agua destilada a 37ºC, empleando un desintegrador Erweka GmbH modelo 712, Offenbach, Germany a 30 strokes/min (13).
Los ensayos de disolución se realizaron en un equipo disolutor Tipo II, según el método de la USP 32 NF 27, con 900mL de agua desionizada a 75 rpm y a 37°C (13). El porcentaje del metal disuelto en el tiempo se determinó por absorción atómica, realizando la medición para el catión de mayor peso molecular presente en cada dupla del complejo (Zn o Mn). Se utilizó una curva de calibración con estándares de Zn y Mn (Merck) y las mediciones se realizaron por triplicado a intervalos de 10 minutos durante 60 minutos (13).
En la Figura 1 se presentan microfotografías electrónicas de los complejos, en ellas se observa la presencia predominante de partículas prismáticas de superficie irregular, las cuales son adecuadas para los procesos de disolución, pero dificultan el proceso de compresión, lo cual indicó la necesidad de adicionar modificadores de flujo a la formulación de las tabletas.

El rendimiento en la síntesis de todos los complejos se considera alta (mayor al 70%). El contenido de metal y humedad de los complejos se muestran en la Tabla 1. El promedio del contenido de Cu, Mg, Mn y Zn en los complejos confirma la estructura esperada; a su vez el contenido de humedad menor al 5% en todos ellos, indica que se presentarán adecuadas propiedades mecánicas durante la compresión. (12).
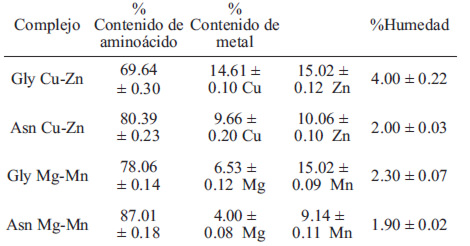
En el espectro IR de los ligandos libres las vibraciones de estiramiento y de deformación del grupo amino están bien definidas en aproximadamente 3421 cm−1 y 1654 cm−1 (Gly), 3451 cm−1 y 1687 cm−1(Asn), las cuales se mantienen sin variación después de la complejación; a su vez la vibración debida al estiramiento de C=O del COOH que aparece aproximadamente a 1610 cm−1 (Gly) y 1643 cm−1 (Asn) en los ligandos libres, se desplazan a menores frecuencias o incluso desaparecen luego de la coordinación, lo que indica que este grupo participa en la coordinación con el catión, este mismo efecto se observa en complejos organometálicos de alanina, arginina, valina con los metales niquel, platino, paladio, cobalto, etc (14-18). La asignación tentativa de las vibraciones metal-ligando se muestra en la Tabla 2 y se realizó con base a estudios previos.
El DSC de la Gly presenta tres picos; endotérmico en 35.4 °C, exotérmico en 74.6 °C, (relacionados con la liberación de agua) y endotérmico en 256.4°C (atribuido al punto de fusión) (19). La Asn presenta tres picos endotérmicos en 246.4°C, 267.8°C y 417.1°C, todos relacionados con su descomposición (20).
El complejo Gly-Cu-Zn en el DSC presenta tres picos endotérmicos en 77.8°C, 179.7°C y 255.8°C y un pico exotérmico en 430.0°C; el primer pico está relacionado en el TGA con una pérdida de 7.393%, correspondiente a la pérdida de una molécula de agua de hidratación, los siguientes picos se relacionan en el TGA con pérdidas de 39.57% y 13.76% correspondientes a la liberación de 2CO2, H2O y NO del aminoácido. El residuo de 39.28% corresponde a una mezcla de CuO y ZnO (21). El complejo Gly Mg-Mn muestra en el DSC tres picos endotérmicos en 117.9°C y 237.2°C y 435.4°C y un pico exotérmico en 376.7°C, relacionadas en el TGA con una pérdida total de 30.26% y que corresponden a la descomposición gradual del aminoácido que no llega a ser completa. El residuo de 69.76% corresponde a MgO, MnO y restos de aminoácido (22). El complejo Asn Cu-Zn presenta un pico exotérmico en el DSC a 327.7°C, que se acompaña en el TGA con una pérdida total de 74.07% que se relaciona con la degradación completa del aminoácido. El residuo de 25.48% corresponde a CuO y ZnO (21). En el complejo Asn Mg-Mn se observan tres picos endotérmicos en el DSC a 123.3°C y 250.4°C y 432.4°C correspondientes en TGA a una pérdida total de 26.53% relacionados con la descomposición del aminoácido. El residuo de 73.50% se atribuye a MgO, MnO y restos de aminoácido (22).
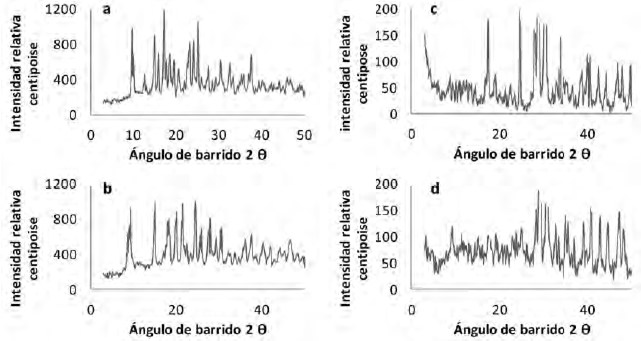
En la Figura 2 se muestran los DRXP de los complejos los cuales no revelan rastros de los compuestos iniciales, demostrando así su alta pureza, y se evidencia cristalinidad en los complejos con Gly y cierto grado de amorficidad en los complejos obtenidos con Asn, lo cual está realacionado con las mejores propiedades para la disolución que presentan los complejos de Asn que los correspondientes complejos de Gly (9, 12).
Los tiempos de desintegración en todos los comprimidos de los complejos fueron menores a 10 minutos, (valores menores a 30 minutos, se consideran aceptables) (13).
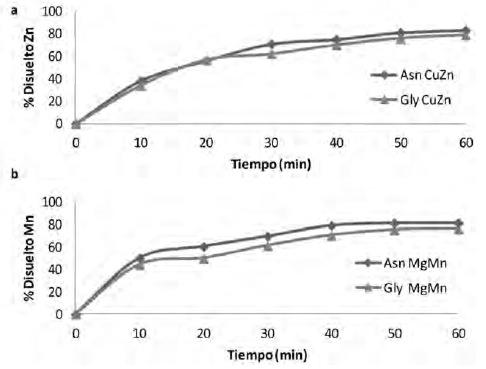
La Figura 3, muestra el perfil de disolución de los complejos, en todos ellos se evidencia que la mayor tendencia ascendente del proceso se da a los 30 minutos. El máximo de disolución obtenido en los complejos de Gly Cu-Zn, Asn Cu-Zn, Gly Mg-Mn y Asn Mg-Mn fue de 79.12%, 83.21%, 76.01% y 81.51%, respectivamente.
De acuerdo con los resultados obtenidos de contenido de metal y análisis térmicos, la composición propuesta para los complejos es de CuZn(Gly)4. H2O, CuZn(Asn)4, MgMn(Gly)4, MgMn(Asn)4.
En el espectro IR de los ligandos libres y de los complejos se muestran bandas intensas atribuibles al estiramiento N-H aproximadamente a 3450 cm
En los análisis térmicos, se evidencia la descomposición del respectivo aminoácido en todos los complejos, con liberación de CO2 y NO. En las sales dobles con Cu-Zn se presenta la pérdida completa del aminoácido, originando residuos de los óxidos de los metales, mientras en las sales dobles con Mg-Mn el residuo está constituido por restos de aminoácido y óxidos de los metales (19-22).
Todos los complejos presentaron valores adecuados de desintegración y la disolución alcanzada a los 30 minutos es superior al 76% (7, 13). La amorficidad de los complejos obtenidos con Asn generan mayores perfiles de disolución que los obtenidos con las formas cristalinas de los complejos con Gly (9).
Los complejos aquí reportados (Gly Cu-Zn, Asn Cu-Zn, Gly Mg-Mn y Asn Mg-Mn), son una alternativa viable a la suplementación de estos oligolementos, ya que se utilizarían las vías metabólicas de absorción de los aminoácidos y los péptidos, de manera que los quelatos actuarían como vehículo de transporte molecular ligándose por interacción débil a metales, potenciando su solubilidad y por ende, su biodisponibilidad.
Desde el punto de vista farmacotécnico, los complejos exhiben propiedades adecuadas para ser formulados en formas farmacéuticas de administración oral, las cuales a su vez, apuntan a la generación de preparados nutricionales que consideran desde su diseño, la asociación de cationes no antagonistas con adecuadas propiedades de solubilidad y de pH para la ingesta por vía oral.
Recibido: 19/10/2011
Aceptado: 07/12/2011