Se consideraron en conjunto los siguientes micronutrientes por su función en la salud ósea: calcio, vitamina D, fósforo, magnesio y flúor. Calcio: no se tiene suficiente información para cambiar las recomendaciones actuales. En adolescentes y adultos, los escasos datos indican que el consumo a nivel de lo recomendado se relaciona con una masa ósea normal. En adultos mayores, los escasos datos reportan un bajo consumo y un alto índice de fracturas, pero no se tiene información si los valores actuales son adecuados. Vitamina D: los escasos datos reportan alta deficiencia en adultos mayores, la cual está relacionada con osteoporosis. Tomando en cuenta el aumento reciente en las recomendaciones de vitamina D en Norteamérica por su contribución a la salud ósea, se propone aumentar la recomendación poblacional a 400-600 UI/d en Venezuela. Fósforo, Magnesio y Flúor: la falta de datos locales no permite cambiar las últimas recomendaciones. Tal situación evidencia la falta de estudios locales para evaluar las recomendaciones actuales. Se necesitan estudios poblaciones del consumo de estos micronutrientes y evaluar su interacción y su relación con la salud ósea y en general. Se necesita conocer si el nivel de estos nutrientes en leche humana es adecuado para la población infantil. Es preciso implementar un sistema de vigilancia nutricional efectiva e implementar intervenciones que maximicen la salud ósea, incluyendo el diseño e implementación de una política lechera que conlleven al aumento en su producción y consumo por la población.
Palabras clave: Recomendaciones nutricionales, calcio, vitamina D, fósforo, magnesio, flúor, salud ósea, Venezuela.
The following micronutrients were considered together for their role in bone health: calcium, vitamin D, phosphorus, magnesium and fluoride. Calcium: not enough is known to change current recommendations. In adolescents and adults, limited data suggest that consuming the recommended level is associated with normal bone mass. In older adults, the limited data reported low consumption and a high rate of fractures but there is no information on whether the current values are adequate. Vitamin D: the limited data reported high deficiency in older adults, which was related to osteoporosis. Given the recent increase in North American recommendation for their contribution to bone health, we proposed to increase the recommendation to 400-600 IU/d for Venezuela. Phosphorus, magnesium and fluoride: the lack of local data does not support changing the latest recommendations. Therefore, it highlights the lack of local studies to assess current recommendations. Studies are needed to estimate the intake of these micronutrients in the population and evaluate their interaction and their relation to bone and overall health. Information of the adequacy of these nutrients in human milk for infants is needed. Alto, it is necessary to implement an effective nutrition surveillance system and implement interventions that maximize bone health from an early stage, including the design and implementation of a dairy policy that leads to an increase in production and consumption by the population.
Key words: Dietary recommendations, calcium, vitamin D, phosphorus, magnesium, fluoride, bone health, Venezuela.
Departamento de Tecnología de Procesos Biológicos y Bioquímicos. Universidad Simón Bolívar. Unidad de Nutrición y Alimentación. FUNINDES-USB. Caracas. Escuela Graduada de Salud Pública, Universidad de Puerto Rico. San Juan, Puerto Rico.
Centro de Atención Nutricional Infantil (CANIA). Caracas. Departamento de Tecnología de Procesos Biológicos y Bioquímicos.
Universidad Simón Bolívar. Caracas. Facultad de Farmacia, Escuela de Nutrición y Dietética. Universidad Central de Venezuela.
El calcio constituye 1-2% del peso corporal total. Alrededor del 99% está en los huesos y dientes en forma de hidroxiapatita; el resto está en sangre, fluidos extracelulares, músculos y otros tejidos, donde interviene como mediador en diversos procesos metabólicos (1,2). El bajo consumo de calcio está asociado a osteoporosis, enfermedades cardiovasculares, diabetes, obesidad y cáncer de colon (1,3,4).
Niños y adolescentes: La masa ósea se acumula hasta llegar a un límite llamado pico de masa ósea (PMO). La adquisición de un PMO adecuado es el factor más importante para la prevención de la osteoporosis en el adulto (5). Desde el nacimiento hasta los 26-30 años hay un incremento progresivo de la mineralización ósea, la cual ocurre con mayor velocidad de 0-3 años y de 11-14 años. El máximo valor de la tasa de acumulación de calcio es a los 12,5 años en niñas y a los 14 años en niños norteamericanos (6). A los 17 años, la adolescente ha adquirido el 90% de su masa ósea y a los 22 años el 99% de su masa ósea (7). En los varones, este aumento es de mayor magnitud que en las hembras y continúa por más tiempo (2,8). En Venezuela se encontró que el PMO en columna lumbar y cuello de fémur se alcanza a los 22 años en las mujeres, con el 80% de dicho valor entre 12-13 años y en los hombres se alcanza a los 19 años, con un 80% entre 14-15 años (9). Hay varios factores que influyen en la adquisición del PMO, entre ellos los genéticos, hormonales y estilos de vida. Si no se alcanza a plenitud el PMO en adolescencia, esto puede llevar a una baja densidad mineral ósea (DMO) (2,5). Uno de estos factores es el consumo de calcio y su suplementación en niños pre-púberes han mostrado beneficios en la masa ósea, particularmente si también hacen ejercicio y si el consumo habitual era bajo (10,11). Sin embargo, los estudios demuestran que esta suplementación ha de mantenerse en el tiempo para que el beneficio sea duradero (12). Particularmente en la adolescencia, si el individuo no tiene una ingesta adecuada de calcio, no llegará al PMO y el individuo entrará en la etapa adulta con una DMO inferior a su potencial genético, lo que puede aumentar el riesgo de presentar fracturas. Otros predictores son el peso corporal y edad de menarquia, en donde el bajo peso y menarquia tardía son factores de riesgo para una menor DMO (13). Un IMC normal se asoció a valores normales de DMO en una muestra de 36 adolescentes femeninas en Venezuela (14).
Embarazadas y madres en período de lactancia: La concentración de calcio en la leche humana varía entre 20-30 mg/dl en mujeres bien nutridas con una adecuada ingesta de calcio (15). En mujeres venezolanas la concentración de calcio fue de 43 mg/dl (16). En Brasil, se reportaron valores más bajos en madres adolescentes comparadas con adultas de estrato socioeconómico bajo, mientras que la concentración de calcio fue mayor en las madres adultas de estrato social alto, por lo que en las madres adolescentes se deben asegurar que se cubran sus requerimientos diarios de calcio (1300 mg/d) (17).
Adultos: En esta etapa el consumo de calcio es importante para mantener la masa ósea adquirida y evitar su pérdida. En la pre-menopausia, el remodelamiento óseo se mantiene constante y la suplementación de 1000 mg/d de calcio en mujeres jóvenes y pre-menopaúsicas tiene un efecto positivo en la masa ósea (18), el cual puede prevenir la pérdida de 1% de hueso/año. Alrededor de la menopausia, entre los 40-50 años, la resorción ósea es mayor a la formación, llevando a la pérdida de masa ósea. El consumo de calcio es importante en esta etapa para reponer el calcio perdido durante la resorción. Sin embargo, los estudios han mostrado que durante esta etapa la masa ósea no responde tanto a la suplementación con calcio (19). Después de 5 o más años de menopausia, la suplementación con calcio si favorece la masa ósea (19), la cual puede aumentar de 1,6-2% (20) y puede reducir un poco el riesgo de fracturas de 12-23%, dependiendo del lugar de la fractura (19-20). En Venezuela, en 80 hombres de 25-50 años se encontró que el 25% presentó valores por debajo del rango esperado para DMO, la cual disminuyó con la edad y aumentó con el consumo de calcio, peso corporal y actividades físicas de alto impacto (21). En 80 mujeres de 25-50 años se encontró que la mayoría tenía un DMO normal, el cual aumentó con el consumo de calcio y peso corporal y disminuyó con el consumo de bebidas antagónicas, pero no se encontró relación con el nivel de actividad física (22).
Adulto Mayor: En el adulto mayor la intervención con calcio también favorece la salud ósea. La suplementación con calcio y vitamina D en más de 45 mil mujeres mayores de 60 años redujo el riesgo relativo de fracturas de caderas (23).
Según la Tabla de Composición de Alimentos (TCA) de Venezuela (24), los alimentos de consumo frecuente en el país con mayor contenido de calcio son los lácteos (queso parmesano, leche en polvo, quesos blanco y amarillo), seguidos de melaza, harina enriquecida de cebada, Lactovisoy, harina enriquecida de cebada de arroz y sardinas enlatadas. Hay que tomar en cuenta el aporte de calcio proveniente de los suplementos dado su uso frecuente en grupos vulnerables.
La biodisponibilidad del calcio es importante para Venezuela ya que el consumo de calcio se encuentra por debajo de los requerimientos establecidos para la población. Los productos lácteos son las mejores fuentes de calcio dado su alto contenido de calcio, alta biodisponibilidad y bajo costo (25), proveen alrededor de 300 mg de calcio por ración, siendo bio-disponible el 32%. La absorción de calcio entre los diferentes productos lácteos es bastante similar (26). Los alimentos fortificados con calcio tienen biodisponibilidad similar a la de la leche (27). Los alimentos de origen vegetal no son buenas fuentes de calcio, algunas plantas, como la espinaca, contienen ácido oxálico que forman sales insolubles con el calcio e inhiben su absorción (27). Vegetales como brócoli, acelga, nabo, col rizada tienen bajo contenido de ácido oxálico y son altamente biodisponibles (28). Aunque los granos de soya contienen ácido oxálico, la absorción de calcio es muy buena (29). El ácido fítico inhibe la absorción de calcio (29), por ello los cereales listos de desayuno son fortificados con calcio. La absorción de calcio en la mayoría de los suplementos es similar a la de la leche, pero el citrato malato es superior y puede ser consumido sin otros alimentos. Suplementos de dosis altas (>500 mg) tienen menor eficiencia comparada con dosis mas bajas (30).
El calcio dietario interactúa con otros nutrientes como hierro, cinc, magnesio y fósforo. El calcio inhibe la absorción de hierro dependiendo de la dosis, pero independiente de la fuente de calcio (31). Dado que el hierro es uno de los nutrientes comúnmente deficientes en la dieta en Venezuela, esto ha traído preocupación. Sin embargo, estudios usando altas dosis de calcio por periodos largos han reportado que este micronutriente no influye en los biomarcardores de hierro, lo que parece indicar que el efecto inhibitorio es de corta duración y que puede haber mecanismos compensatorios en el tiempo (31). Con respecto al cinc, hay resultados contradictorios y en cuanto a la interacción con magnesio, en adolescentes sanos no se ha encontrado ningún efecto negativo del calcio en la absorción o balance de magnesio (32).
Existen indicadores relacionados con una ingesta excesiva de calcio, tales como: hipercalcemia, hipercalciuria, calcificación de vasos sanguíneos y de partes blandas, nefrolitiasis, cáncer de próstata, constipación e interacciones con la absorción del hierro y del zinc (33).
Pocos países han reportado el consumo de calcio nacional. En una revisión exhaustiva del consumo de calcio (medido por encuestas nacionales) en 15 países de Europa, 2 de Asia, 2 de Oceanía y Estados Unidos, se encontró que el consumo en niños era de 700-1000 mg/d, en adolescentes de 700-1400 mg/d, en adultos de 500-1300 mg/d, y en ancianos de 700-1100 mg/d (34). En la mayoria de los paises, los lácteos son los que mas aportaron al consumo de calcio.
No existe un criterio uniforme en el establecimiento de las recomendaciones de calcio en el mundo. Se han usado diversas metodologías, nomenclaturas y grupos de edad. En Estados Unidos, el Instituto de Medicina estableció la recomendación para Norteamérica (DRI, por sus siglas en Inglés), la cual fue revisada recientemente (33). La FAOOMS también elaboró sus recomendaciones de calcio en el 2002 (35), con algunas diferencias comparado con los DRIs.
Según los últimos datos disponibles de la Cámara Venezolana de Industrias Lácteas en el 2008, el consumo de leche se estimó en 91,3 lts/persona/año con un aporte de unos 386 mg/d de calcio, esto representa una adecuación del 39% (36). Los últimos datos disponibles de las Hojas de Balance de Alimentos indican que el consumo de calcio en el 2002-2007 fue muy baja (adecuación de 41-51%). Sin embargo, estos datos representan un consumo aparente de la población y no el consumo real (37). En Venezuela se han hecho esfuerzos para lograr el enriquecimiento de los alimentos infantiles con calcio, de acuerdo a lo exigido hace 40 años en la Resolución No 13.3989 del Ministerio de Sanidad y Asistencia Social y las Normas COVENIN 1452-93 y 3359-1998 (38, 39). En estos documentos se exige a la industria agregar 500 mg de calcio por 100 g.
Existen algunos estudios en relación al consumo de calcio en Venezuela. En una comunidad urbana en pobreza en niños de 4-14 años la adecuación del consumo de calcio fue 67% en pre-escolares y 43% en escolares; el 70% de la muestra no alcanzó los dos tercios de la recomendación (40). En adolescentes de 3 escuelas privadas y 3 públicas en Caracas se encontró un consumo promedio de calcio de 990 mg/d y una adecuación del 83% (41). En una muestra de adolescentes de 13-18 años de una escuela privada en Caracas se consiguió un consumo promedio de calcio de 1076 mg/d y una adecuación del 90% (42). En otro grupo de adolescentes de 15-18 años se encontró una ingesta promedio de calcio 1183 mg/d en mujeres y 1315 mg/d en hombres; el 50% de la muestra tuvo una adecuación del 100% (43). La principal fuente de calcio fueron los lácteos y ningún adolescente reportó el uso de suplementos de calcio. En mujeres de 25-50 años el consumo promedio de calcio fue de 1300 mg/d, de los cuales 56% presentó una adecuación por encima del 110%, 34% estuvo por debajo de lo recomendado y 20% estuvo por debajo del 75% (22). El 36% de las participantes reportó el uso habitual de suplementos de calcio. Entre las mujeres que no consumieron suplementos, los lácteos proporcionaron el 70% del calcio, mientras que el 30% restante fue cubierto otros alimentos (vegetales, verdes, cereales, etc.). En el estudio en hombres de 25-50 años mencionado anteriormente, el consumo promedio de calcio fue de 2153 mg/d, con una adecuación de 84%, encontrándose los mayores consumos en el grupo con actividad física alta (21). El 45% consumió suplementos de calcio, los cuales aportaron el 17% del calcio ingerido, mientras que el 58% provino de los lácteos y el 25% restante de otros alimentos. Para los que no reportaron consumo de suplementos (55%), 76% de la ingesta de calcio provino de los lácteos y el 24% de otros alimentos. El 29% tuvo un consumo por encima del límite superior sugerido (UL: 2.500 mg/d). En adultos mayores de 55 años, Falque y Maestre encontraron un consumo promedio de calcio de 873 mg/d, con una adecuación del 69% (comunicación personal). El mayor consumo se encontró en los mayores de 70 años (916 mg/d) y el menor consumo en los de 60-69 años (827 mg/d; p<0,05).
Según la Encuesta de Seguimiento al Consumo de Alimentos (ESCA) en Venezuela del 2003-2010 (44) el consumo total de calcio (mg/peso neto/persona día) fue de 601-694 mg/d, con una adecuación de 60-69% y la principal fuente de calcio fueron los lácteos (64%). En estudios realizados en diferentes comunidades en Venezuela por las Escuelas de Nutrición entre el 2000-2010 se observó una adecuación de 73-77% (comunicación personal). Además, en Venezuela se dispone del Estudio sobre Condiciones de Vida en el Eje Norte Llanero realizado en el año 2006, en donde se encontró un mayor consumo de calcio en los estratos altos (843 mg/persona/d) y menor consumo en los estratos más bajos (739 mg/persona/d en el estrato social IV y (677 mg/persona/d en el estrato V) (44).
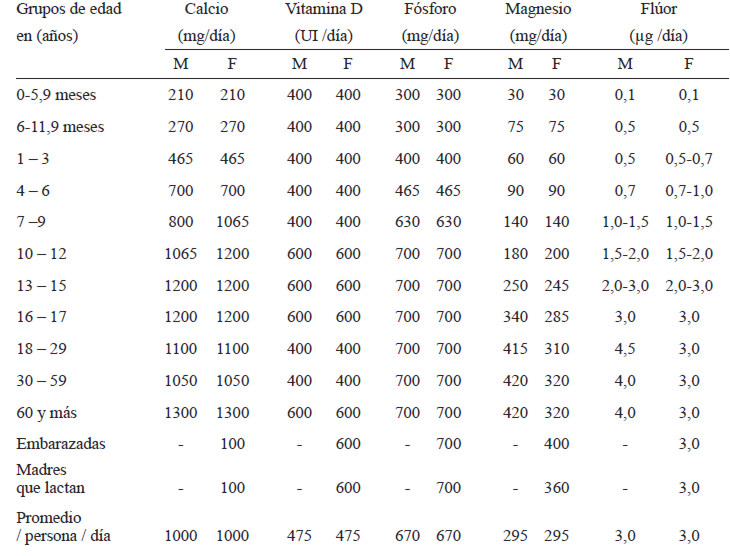
El valor de referencia de calcio establecido para la población venezolana por género y grupos de edad por el Instituto Nacional de Nutrición (INN) en el año 2000 (1), se presenta en la Tabla 1. Dichas recomendaciones se basaron en los DRI para Estados Unidos (33). En la presente revisión, se recomienda lo siguiente para Venezuela:
Según los resultados en las encuestas realizadas en Venezuela, el consumo aparente de calcio en la población en general está por debajo de la recomendación actual: 65-77% de adecuación. Aunque no se tienen datos de salud ósea en esas personas encuestadas, los pocos estudios realizados en ciertas regiones en Venezuela muestran un alto índice de fracturas (4). Por lo tanto, se podría inferir que el bajo consumo de calcio en Venezuela puede estar relacionado al alto índice de fracturas. Esto se debe confirmar en estudios que sean representativos de la población.
La producción de lácteos no es suficiente para cubrir las recomendaciones actuales, por ello podría ser necesaria la fortificación de alimentos con calcio para cubrir las recomendaciones.
La vitamina D es una pro hormona que tiene dos formas: vitamina D2 o ergocalciferol, obtenida en la dieta y vitamina D3 o colecalciferol formada en la epidermis a partir de la conversión de 7 dehidrocolesterol por rayos ultravioleta, en esta reacción influyen: la pigmentación de la piel, la edad, la estación y la latitud geográfica (46).
La vitamina D endógena y la ingerida en la dieta pasa a la circulación, y es transportada mediante proteínas de unión (47) al hígado donde ocurre una hidroxilación, produciendo 25-(OH)- vitamina D, la forma circulante más abundante de la vitamina D. El complejo de la 25- hidroxivitamina D a nivel renal sufre otra hidroxilación, convirtiéndose en 1,25-(OH)-vitamina D, que es la forma biológicamente activa (47, 48). Este último proceso también puede ocurrir en macrófagos, cerebro y colon (49). La forma activa de vitamina D, cuya su función primaria es mantener niveles séricos normales de calcio y fósforo, estimula la absorción intestinal activa de calcio y la resorción ósea para liberar calcio del hueso y aumenta la reabsorción urinaria de calcio (50). La producción de 1,25(OH)2D es estimulada por la hormona paratiroidea (PTH, por sus siglas en inglés), que a su vez es inhibida por el calcio y la 1,25(OH)2 D(51).
El receptor nuclear de la vitamina D no solo se encuentra en el intestino y el hueso, sino en otros tejidos como linfocitos, músculo estriado, corazón, páncreas, piel, cerebro, gónadas, etc. La unión de la 1,25(OH)2D con su receptor desencadena efectos fisiológicos, relacionados con la función del páncreas, del músculo liso y la liberación de citocinas que participan en la modulación del sistema inmune, y en la proliferación, maduración y diferenciación celular (51, 52). Aunque la forma activa de vitamina D es la 1,25(OH)2D, el status de la vitamina D se mide por la 25(OH)D, que tiene una vida útil más larga y refleja todas las fuentes: sol, dietéticas y suplementos (46).
Según el Instituto de Medicina de los Estados Unidos, se considera un nivel adecuado de vitamina D si los niveles de 25(OH) D se encuentran por encima de 20 ng/mL, (50nmol/L) (33). Por debajo de este valor, aumentan la resorción ósea y los valores de PTH (3D). Otros autores consideran deficiencia niveles inferiores a 20 ng/ml, insuficiencia niveles entre 21 a 29 ng/mL, mientras que niveles >30 ng/mL se consideran como óptimos (53; 54). En adultos mayores se sugiere un nivel ≥75 nmol/L para obtener una densidad mineral ósea óptima en cadera (55, 56). En la población pediátrica aunque no existe un consenso sobre el nivel de 25(OH)D que defina la deficiencia se recomienda mantener concentraciones > 20 ng/mL (57). Entre los grupos de riesgo para déficit de vitamina D se incluyen adultos mayores (58), personas de piel oscura o con reducida exposición solar, prematuros, recién nacidos hijos de madres con deficiencia de vitamina D (57), pacientes con malabsorción gastrointestinal, o con tratamiento anticonvulsivante y personas que usan pantallas solares, las cuales pueden disminuir la síntesis cutánea hasta en 98% (59).
La deficiencia de vitamina D en adultos puede resultar en osteomalacia, osteopenia, osteoporosis y aumentar el riesgo de fracturas (50) y de caídas por debilidad muscular. La deficiencia de esta vitamina es un factor de riesgo para la hipertensión, diabetes tipo 1, varios tipos de cáncer (60) y adelanto en la edad de la menarquia (61). En embarazadas, la deficiencia de vitamina D ha sido asociada a mayor riesgo de preclampsia, cesárea y diabetes gestacional; debido a la alta prevalencia de déficit de vitamina D en embarazadas, en los Estados Unidos, se ha recomendado la determinación de nivel de 25(OH)D en todas las mujeres embarazadas (54). En niños y adolescentes el déficit de vitamina D produce raquitismo y la deficiencia subclínica de vitamina D puede afectar la mineralización ósea (62). Diversos estudios han identificado que las concentraciones de vitamina D están disminuidas en los pacientes obesos con síndrome metabólico. (63-65).
La mayor parte de la vitamina D proviene de la síntesis cutánea (vitamina D3) y no de la dieta. La vitamina D puede ser expresada en unidades internacionales (UI) o ug de colecalciferol, 1 UI equivale a 0,025 ug y 1 ug equivale a 40 UI. La Tabla De Composición de Alimentos Para Uso Práctico del INN (24) no incluye la información de vitamina D, así como tampoco la incluyen tablas de composición de otros países latinoamericanos. Los alimentos con mayor aporte de vitamina D (UI por 100g) son: aceite de hígado de bacalao, arenque fresco, salmón ahumado, caballa, jurel, salmón enlatado, sardinas frescas, leche en polvo entera, enriquecida, huevo de gallina, yema, alimentos a base de cereales para uso infantil (enriquecidos) y atún fresco (66- 68). Entre los alimentos fortificados en el país se encuentran: leche completa líquida y en polvo, descremada en polvo, productos de base vegetal para alimentación infantil, mezclas de polvo con sabor a cacao, yogurt y margarinas (69).
Dos formas de vitamina D son utilizadas en los suplementos: D2 (ergocalciferol, derivado de plantas) y D3 (colecalciferol derivado del pescado). Se ha demostrado que la vitamina D3 es más eficaz en la elevación de los niveles de 25(OH)D que la vitamina D2 (70). Su presentación puede ser en multivitamínicos o individual de 200-1000 UI/mL en gotas y de 250-1000 UI en cápsulas.
El nivel elevado de 25(OH)D y la hipercalcemia son los marcadores de la intoxicación. Dosis superiores a 50000UI/d por varias semanas o meses se asocian frecuentemente con toxicidad. Existen recomendaciones de consumo superior tolerable por edad (33). Las manifestaciones clínicas son: hiperclacemia, hipercalciuria, anorexia, nauseas, vómitos, sed, poliuria, debilidad muscular, artralgias, desmineralización ósea, y desorientación.
Varios estudios han encontrado una alta prevalencia de deficiencia de vitamina D a nivel mundial (71), incluso en países con exposición solar durante todo el año o en países industrializados con acceso a alimentos fortificados con vitamina D. Un estudio en hombres Hispanos Americanos encontró la mayor prevalencia de deficiencia de vitamina D (<20 ng/ml) en Puertorriqueños (26%), en hombres de República Dominicana (21%), Centro América (11%), y Sur América (9%) (72). En mujeres chilenas sanas sin factores de riesgo para deficiencia de vitamina D y con exposición solar adecuada, el 60% de las postmenopáusicas y 27% de las premenopáusicas, tenían niveles de 25(OH) D < 20 ng/mL (73). Datos recientes del National Health and Nutrition Examination Survey (NHANES, por sus siglas in Inglés) encontraron una prevalencia de insuficiencia de vitamina D (<30 ng/ml) de 97% de negros y 90% de Mexicanos-Americanos (74). En la población española mayor de 50 años en 2000, 2003, 2006 y 2008 también se registraron adecuaciones bajas de vitamina D: 56%, 62%, 64% y 44%, respectivamente (75).
En Estados Unidos, un reporte reciente de la encuesta NHANES 2003-2006 realizada en una muestra representativa de niños y adultos encontró un consumo promedio de vitamina D de 4,9 ug/d, de los cuales 41% provino de los alimentos ricos naturalmente en vitamina D y 59% de los alimentos fortificados (76). En el Norte de Europa, el consumo de vitamina D se estimó en mujeres y hombres, y una gran parte provino del consumo de pescados grasos (77). En países en donde la fortificación de alimentos con vitamina D es usual, la fuente principal de vitamina D son esos alimentos, como en Estados Unidos y Canadá. Estas fuentes son menos importantes para el consumo total de vitamina D en países donde no hay o hay poca fortificación con vitamina D, como en Europa (78).
Hay varios factores que explican la alta prevalencia de deficiencia de vitamina D a nivel mundial, como la falta de exposición solar, ya que ésta es la principal fuente de la vitamina (78). Todo aquello que impida o interfiera la transmisión de UVB a la piel, como la utilización de protectores solares o la melanina, puede afectar la síntesis de vitamina D3 (52,79). Los adultos mayores constituyen un grupo vulnerable debido a su reducida exposición solar y a una disminución la conversión de vitamina D en la piel (58, 80), su epidermis tiene menos 7-dehidrocolesterol (81). La obesidad también se asociada con la deficiencia de vitamina D y se cree que se debe al gran número de células de grasa que secuestran la vitamina (82).
En los escasos estudios realizados, se ha determinado que la media de 25OHD en un grupo de 36 mujeres premenopáusicas con DMO normal era de 52,9±24,3 ng/ml (83). En mujeres postmenopáusicas con osteoporosis, 43% presentaron valores bajos de 25OHD (84). Un comportamiento similar se encontró en adultos mayores de 60 años residenciados en unidades geriátricas (51%) o en sus hogares (25%) (85). No hay información sobre la disponibilidad alimentaria de la vitamina D para la población venezolana en las Hojas de Balance de Alimentos del INN (37).
En la revisión del año 2000 de los valores de referencia de energía y nutrientes para la población venezolana, se señala la ausencia de información nacional sobre el consumo de vitamina D tanto en su forma natural como en productos enriquecidos (1), situación que se mantiene en la actualidad. La falta de datos nacionales tanto de consumo como de los niveles de vitamina D y su correlación con parámetros bioquímicos y radiológicos de salud ósea, hace difícil proponer modificaciones a los actuales valores de referencia para la población venezolana; sin embargo, considerando que países como Estados Unidos y Canadá en sus últimas recomendaciones del año 2011 (33) proponen valores superiores a los nacionales, las actuales recomendaciones pueden ser insuficientes para algunos grupos poblacionales, especialmente para el grupo de 1 a 19 años. En la presente revisión, se recomienda lo siguiente para Venezuela (Tabla 1):
El fósforo es un componente básico del contenido mineral del hueso, es parte estructural de los ácidos nucleicos y fosfolípidos e interviene en el aporte de oxígeno a los tejidos (86). Sus funciones principales son mantener el balance ácido-base, almacenar temporalmente energía y transferir energía de los compuestos metabólicos y activar proteínas catalíticas (enzimas, hormonas y otros) a través de la fosforilación (87).
El fósforo es regulado por la absorción de las fuentes dietarias, formación ósea, excreción renal y equilibrio con las reservas intracelulares (88). La absorción es controlada por la vitamina D y por transportadores específicos de fosfato (87). Un aumento en la ingesta de fósforo también incrementa su absorción sin que el proceso se sature (89). El funcionamiento normal del riñón mantiene la homeostasis del fósforo, en adultos sanos el contenido de fósforo en la orina es prácticamente equivalente al absorbido en la dieta (90). El uso de antiácidos de hidróxido de aluminio y dosis farmacológicas de calcio reducen su absorción (87).
Los mecanismos que regulan el metabolismo del fósforo están ligados en forma estrecha con los del calcio, a través de la acción de la hormona paratiroidea (PTH) y la vitamina D (88). Si la concentración de calcio disminuye en sangre, aumenta la secreción de PTH, lo que estimula la conversión renal de vitamina D a su forma activa (calcitriol); éste aumenta la absorción intestinal de calcio y de fósforo. Tanto el calcitriol como la PTH estimulan la resorción ósea, lo que libera calcio y fósforo a la sangre. La PTH también disminuye la excreción urinaria de calcio y aumenta la de fósforo, lo que ayuda a aumentar el calcio en sangre, porque los niveles altos de fosfato en sangre suprimen la conversión de vitamina D a su forma activa en los riñones (88). Otros factores que participan en el metabolismo del fósforo son: Factor de Crecimiento Epidérmico, glucocorticoides, estrógenos y fosfatoninas (89).
Según la TCA, los alimentos de consumo frecuente en el país con mayor contenido de fósforo son los lácteos (queso parmesano, leche en polvo completa enriquecida), soya en forma de harina desgrasada y en grano entero; embutidos, yema de huevo de gallina y la parte sólida de sardinas enlatadas (24). El fósforo también se encuentra en aditivos usados en el procesamiento de los alimentos, como en las bebidas carbonatadas, y en los medicamentos, en forma de sal de fosfato; estos generalmente no son incluidos en las bases de datos de alimentos, por lo que hay una subestimación (91).
La mayoría de los alimentos son fuentes altamente biodisponibles en fósforo, particularmente las carnes; sin embargo, en los cereales, granos y nueces, el fósforo se encuentra principalmente almacenado en forma de fitato y solo el 50% es biodisponible, ya que el sistema digestivo no segrega enzimas que puedan liberar el fósforo del fitato (87). La biodisponibilidad varía según el tipo de leche: 85-90% en leche humana, 72% en leche de vaca y 59% en fórmulas a base de soya (por el contenido de ácido fítico) (87). Una concentración luminal de sodio es esencial para asegurar la absorción de fósforo y un alto aporte de magnesio en la dieta disminuye su absorción (92).
La deficiencia de fósforo resulta en hipofosfatemia, lo que lleva a la pérdida de apetito, anemia, debilidad muscular, dolor óseo, raquitismo en niños y osteomalacia en adultos. Como el fósforo se encuentra en tantos alimentos, es muy raro ver deficiencia dietaria de fósforo; hay muy poca evidencia que en individuos sanos, la ingesta de fósforo afecte la incidencia de osteoporosis (93). Los individuos con riesgo de deficiencia de fósforo son los alcohólicos, pacientes con episodios de cetoacidosis diabética, recién nacidos pretérmino, los anoréxicos o aquellos en situación de hambruna (87).
La hiperfosfatemia (fósforo sérico >5 mg/dl) por causas dietéticas es poco probable debido a que el riñón elimina eficazmente el exceso de fosfato de la sangre en los individuos sanos. Esto puede ocurrir en individuos con alguna patología renal, lo que conlleva a una disminución en la absorción de calcio y calcificación de tejidos no esqueléticos, como los riñones (87).
El exceso en el consumo de fósforo ocurre con mayor frecuencia por el aumento en el consumo de bebidas carbonatadas, las cuales son altas en fósforo (94); su consumo se ha asociado con la disminución de la masa ósea y el aumento en la tasa de fracturas en adultos y adolescentes (95-97); el alto consumo de bebidas carbonatadas estaría afectando la salud ósea por el reemplazo de bebidas como la leche (98). El fósforo de los aditivos tiene un efecto aún mayor en los niveles de la PTH comparado con el naturalmente presente en los alimentos (99). Una dieta alta en fósforo aumenta los niveles post-prandiales de fosfato sérico, lo que reduce la activación de calcitriol, disminuye el calcio en sangre lo que libera PTH, afectando en forma adversa sobre la salud ósea (87), sobre todo cuando la dieta también es deficitaria en calcio (100, 101). Cada 100 mg de aumento el consumo de fósforo aumentan el riesgo de fractura en 9% (102).
El consumo de calcio y una alta relación calcio/fósforo se han asociado positivamente con la DMO, tal como se demostró en mujeres jóvenes en España (103); sin embargo, no se detectó un efecto adverso en los biomarcadores óseos al aumentar el consumo de fósforo a 3000 mg/d, cuando también se aumenta el consumo de calcio cerca de 2000 mg/d (104). En mujeres jóvenes, los niveles de PTH y los marcadores de resorción ósea disminuyeron al aumentar el calcio dietario (600-1200 mg) (105). Por lo tanto, pareciera más importante para la salud ósea mantener una tasa alta entre el consumo de calcio y fósforo que la ingesta total absoluta de fósforo (106).
La encuesta NHANES 2003-2006 encontró un consumo promedio de fósforo de 1327 mg/d (97% proveniente de alimentos y 3% de alimentos fortificados), estos datos pueden estar subestimados ya que no se consideró el fosfato proveniente de los aditivos (107,108). En un estudio realizado en 10 países de Europa, el consumo promedio de fósforo en las diferentes poblaciones se encontró alrededor de 1400 mg/d (109). El Instituto de Medicina estableció el nivel recomendado de fósforo para Estados Unidos (basados en el nivel necesario para mantener un balance de fósforo y los niveles normales de fosfato en suero en adultos) en 460-500 mg para niños, 1250 mg/d en adolescentes y 700 mg/d en adultos a partir de 19 años (87). El nivel máximo de ingestión tolerable se fijó en 3000 mg/d para niños de 4-8 años y adultos mayores de 70 años, debido a la posibilidad de tener alteraciones renales, y de 4000 mg/d entre los 9 y 70 años. No se tomó en cuenta la relación calcio/fósforo (87).
Hay muy pocos estudios realizados en Venezuela para conocer el consumo de fósforo. En adultos mayores de 55 años en Maracaibo en el 2009, el consumo promedio de fósforo fue de 1054 mg/d, con una adecuación del 151% (Falque, comunicación personal). Según ESCA 2003-2010, el consumo total de fósforo varió muy poco durante este periodo, con un promedio de 1243 mg/d y una adecuación de 177% (1). Las principales fuentes alimentarias de fósforo fueron los cereales (26%), leche y lácteos (23%) y carnes y pescados (22%) (43). De acuerdo a las Hojas de Balance de Alimentos para el año 2009 (37), también se encontró un alto consumo promedio de fósforo de 1396 mg/d proveniente de los alimentos, con una adecuación de 199% (1). Estos datos muestran un consumo de fósforo superior a las recomendaciones, similar a lo encontrado en muchos países. También se ha analizado el contenido de fosforo en la leche humana, el cual fue de 14 mg/100 g (adecuado para un recién nacido a término), con un aumento hasta los 3 meses y luego se mantuvo estable a partir de esta edad (16).
El valor de referencia de fósforo establecido para la población venezolana por el INN en el año 2000 (1) se presenta en la Tabla 1. Dichas recomendaciones se basaron en parte según los DRI para Estados Unidos (87), a excepción del valor recomendado en adolescentes, el cual fue mayor (1250 mg/d). En la presente revisión de los requerimientos de fósforo, no se tiene suficiente información para cambiar las recomendaciones actuales. En adultos mayores el consumo promedio de fósforo fue 1054 mg/d; sin embargo, no relacionaron estos niveles con los de PTH o fosfato sérico, por lo tanto, se carece de información suficiente que permita modificar las recomendaciones del año 2000.
El magnesio se encuentra en elevadas proporciones en el cuerpo humano y está involucrado en más de 300 reacciones esenciales del metabolismo, ya que es un co-factor de numerosas enzimas y proteínas, entre ellas las hormonas calcitrópicas y la 1,25(OH)2D (110). Además, tiene un rol importante en el metabolismo del ATP, en la síntesis de proteínas y ácidos nucleicos, en el transporte activo a través de membranas de iones como potasio y calcio, en el mantenimiento de la integridad de membranas celulares, excitabilidad neuromuscular y contracción muscular, entre otras funciones (110).
Alrededor de 50-60% del magnesio corporal se encuentra en los huesos; 27% en los músculos; 6-7% en otras células y menos de 1% se encuentra a nivel extracelular (110). El magnesio es importante para la calidad del hueso, ya que reduce el tamaño del cristal de hidroxiapatita, lo cual previene la formación de cristales largos y perfectos, lo que conduce a huesos menos frágiles. En cuanto a la función del magnesio en la salud ósea, aunque hay escasos estudios, su deficiencia puede afectar el crecimiento óseo, la actividad osteoblástica y osteoclástica, osteopenia, fragilidad ósea y puede alterar el metabolismo del calcio a través del efecto en las hormonas calcitrópicas (111).
El estado de salud del magnesio depende de la salud del sistema digestivo y renal. En personas sanas, la absorción del magnesio es alrededor de 50% del consumo, la mayor parte se absorbe en el intestino delgado, ésta depende de la ingesta total de magnesio. Dietas bajas en magnesio llevan a un aumento en la eficiencia de absorción, mientras que las altas en este nutriente ocasionan una disminución en su absorción (112). La absorción de magnesio también puede ser afectada por la ingesta de otros nutrientes como calcio, fósforo, fibra y proteína (113).
Estudios epidemiológicos han observado una asociación positiva entre el consumo de magnesio y la DMO, se asoció a niveles más bajos de los marcadores de resorción ósea en mujeres jóvenes (114-116); así como también en mujeres italianas y americanas postmenopáusicas (117,118) y en mujeres y hombres caucásicos de edad avanzada (119). En adolescentes caucásicas la suplementación con 300 mg/d de magnesio por un año aumentó significativamente la masa ósea (120). En mujeres postmenopáusicas, la suplementación de 600 mg/d de magnesio y de calcio por 6-12 meses llevó a un aumento de 11% en la masa ósea, la cual se mantuvo después de 2 años de seguimiento (121).
Las principales fuentes de magnesio son cereales, germen de trigo, nueces, almendras, merey, granos enteros, pescado, camarones y diversos vegetales, especialmente los de hoja verde (110). Los alimentos industrializados suelen tener muy bajas concentraciones de magnesio, ya que éste se pierde en el proceso de refinamiento. El agua también puede contener altas cantidades de magnesio, pero depende de la fuente del agua. Según la TCA, los alimentos de consumo frecuente en Venezuela con mayor contenido de magnesio son las nueces, soya y granos (24). El consumo de suplementos ha aumentado recientemente con la adición de magnesio a los suplementos de calcio y vitamina D (50 a 400 mg) (122); sin embargo, no se tienen estudios en Venezuela de su uso.
La deficiencia de magnesio no es común en personas sanas que llevan una alimentación balanceada, debido a su amplia distribución en alimentos y a que la excreción urinaria se adapta al bajo consumo. Algunos trastornos gastrointestinales y renales y el alcoholismo crónico pueden aumentar el riesgo de deficiencia de magnesio (110). Además, en personas de edad avanzada en Estados Unidos se ha encontrado un bajo consumo de magnesio, aunado a una menor absorción y mayor excreción urinaria en esta etapa, pueden ocasionar deficiencia de magnesio (87). Un consumo bajo de magnesio en forma constante puede aumentar la razón entre el consumo de calcio y magnesio a > 3, lo cual se ha asociado a mayor riesgo de diversas enfermedades crónicas, como hipertensión, enfermedades cardiovasculares, osteoporosis, diabetes (123). Además, se ha sugerido que una dieta alta en calcio podría intensificar la deficiencia de magnesio, pero estudios de balance no confirman esto (124,125).
En un reporte reciente de la encuesta NHANES 2003-2006 el consumo promedio de magnesio fue de 277 mg/d (96% proveniente de los alimentos y 4% de los alimentos fortificados con este nutriente), el 50% de los adultos estudiados tuvieron un consumo inferior al esperado (107). Las recomendaciones de magnesio establecidos por la Unión Europea fueron de 150-500 mg/d en adultos y por la Comisión Europea fue de 300 mg/d (126). El consumo de magnesio en la mayoría de países europeos fue > 300 mg/d en hombres y en mujeres y por debajo del nivel esperado en Italia, Francia y España, sobretodo en mujeres y ancianos (127-129). Las concentraciones de magnesio en la leche humana son independientes del estado nutricional materno de este mineral, sin diferencias de acuerdo a la edad materna y al estrato socioeconómico. En madres brasileras se encontró pocas diferencias en dicha concentración entre adolescentes y adultas: 25,8 y 28,2 mcg/L, respectivamente (130).
No se cuenta con estudios sobre el consumo de magnesio en Venezuela. Sin embargo, los datos de ESCA 2003-2010 muestran que las leguminosas son las que más han aportado magnesio consistentemente desde el 2003, seguidos del grupo de los cereales (43). El aporte total de magnesio de los alimentos ha aumentado de 170 mg/persona/d en el año 2003 a 179 mg/persona/d en el 2010; sin embargo, este nivel está por debajo de las recomendaciones del 2000 para Venezuela (1).
La concentración de magnesio en leche humana en mujeres venezolanas es de 25 mcg/ml durante el primer mes y alrededor de 30 mcg/ml entre los 3 y 6 meses (16); sin embargo, no se estimó el consumo de magnesio ni de otros nutrientes importantes en las madres. Por lo tanto, se necesitan más estudios para conocer si esta cantidad de magnesio en la leche humana es suficiente para los niños venezolanos. Dada la alta variabilidad del contenido de magnesio en las aguas en varias zonas de Venezuela (131,132), unidas a un bajo consumo de este nutriente, se podría considerar que hay un consumo sub-óptimo y posible deficiencia en algunos segmentos de la población.
El valor de referencia de magnesio establecidos para la población venezolana por el INN en el año 2000 fue de 295 mg/persona/d (1). Dichas recomendaciones se basaron en los DRI’ s para Estados Unidos (87). Las recomendaciones actuales de calcio y de magnesio para los adultos en Venezuela tienen una razón de calcio a magnesio de 2,4 en hombres y de 3,1 en mujeres. En este momento no se tiene suficiente información para cambiar las recomendaciones del año 2000 (Tabla 1).
El flúor es un elemento químico perteneciente al grupo de los halógenos. Dada su alta afinidad por el calcio, el fluoruro esta principalmente asociado a la mineralización dental y a la DMO. Una excesiva ingesta de flúor durante el desarrollo del esmalte antes de la erupción ocasiona hipomineralización del esmalte dental por aumento de la porosidad, patología conocida como fluorosis dental (133).
La ingesta diaria total de flúor viene determinada fundamentalmente por la concentración de flúor en el agua con la cual se preparan las comidas y las fórmulas lácteas, ya que la leche humana contiene 0,005-0,001 mg/L, mientras que la fórmula reconstituida contiene 0,14 mg/L (134,135). Las frutas, vegetales y carnes aportan poco flúor (134-136). La Organización Panamericana de la Salud (OPS) en 1996 sugirió el uso de pasta dental en niños menores de 6 años con concentraciones de flúor de 400-550 ppm y en niños mayores de 6 años de 1000-1500 ppm para evitar la fluorosis dental (137).
Durante el primer año de vida, el agua debe contener menos de 0,3 mg/L de flúor (135), restringiéndose el uso de suplementos de flúor en niños con riesgo de presentar caries a partir de los 6 meses, como lo indica la Academia Americana de Pediatría, para no exceder el nivel máximo de ingesta tolerable (UL). A partir del primer año de vida, los UL son mayores y no hay inconveniente en recomendar aguas fluoradas (hasta 1 mg/L de flúor) para aprovechar el efecto tópico de la bebida (135,138). Se debe considerar la recomendación de la OPS, la cual plantea que en cada país se recomienda una sola fuente de fluoración, la cual podría ser la sal o el agua, nunca las dos juntas (137).
Las caries dentales han sido en Venezuela uno de los problemas de salud pública más prevalentes al igual que el resto del mundo. En Venezuela, la Comisión Nacional de Yodación y Fluoruración de la Sal para Consumo Humano y Veterinario (CONYFLUSAL) estimó prudente una concentración de flúor en la sal de 180-220 ppm ó 200-250 mg de fluoruro de potasio por Kg de sal. Para mantener el nivel de fluoración de la sal, son necesarios los controles permanentes y sistemáticos de la dosificación con yodo y flúor de la sal según la normativa venezolana por parte de las empresas procesadoras, para garantizar la calidad óptima de la sal para el consumo humano (139).
Se carece de estudios nacionales sobre el consumo de flúor que permitan modificar las recomendaciones establecidas por el INN en el año 2000 (1), las cuales se basaron en los DRI’s para la población norteamericana (87). En la Tabla 1 se presentan los valores recomendados de flúor para la población, según grupo de edad, para embarazadas y madres lactando.
El presente documento ha puesto de manifiesto la falta de estudios nacionales que aporten los insumos necesarios para evaluar las recomendaciones actuales de calcio, vitamina D, fósforo, magnesio y flúor, así como para establecer nuevas recomendaciones en caso necesario. Por lo tanto, se propone de manera prioritaria la realización de los siguientes estudios:
Estimación del consumo de calcio, vitamina D, fósforo, magnesio y flúor en muestras representativas de la población en los diferentes grupos etarios, evaluando la posible interacción entre nutrientes y su relación con la DMO y las fracturas y evaluar los factores de riesgo modificables de la osteoporosis.
Dado el bajo consumo de calcio encontrado en varios estudios en Venezuela y el alto consumo de fósforo en los escasos reportes disponibles, se requieren estudios epidemiológicos que evalúen si la relación calcio/fósforo es un predictor de la DMO y de fracturas. Además, es necesario conocer la razón entre el consumo de calcio/magnesio y su posible relación con enfermedades crónicas relacionadas con la nutrición y la relación entre el consumo de fósforo y los niveles de fosfato sérico y PTH, para conocer el nivel óptimo que conlleve a los niveles deseados de estos indicadores.
Se necesitan más estudios para conocer si la cantidad de estos micronutrientes en la leche humana es adecuada para la población infantil. Además, se requiere ampliar la información sobre el contenido de estos micronutrientes en los alimentos, particularmente calcio y vitamina D.
Es preciso implementar un sistema de vigilancia nutricional efectiva para la monitorización del nivel de micronutrientes en la población. Así como también la determinación en una muestra representativa de la población de los niveles séricos de 25(OH)D y la contribución de la exposición solar en estos valores, para conocer si hay deficiencia de vitamina D. Sería interesante a futuro, evaluar el estado nutricional de la vitamina D en individuos obesos, y su relación con resistencia a la insulina.
Dado que la adolescencia es un periodo crítico para implementar intervenciones conducentes a maximizar el alcance del PMO, se deben aplicar medidas preventivas y/o correctivas oportunas en esta etapa para disminuir el riesgo de osteoporosis en etapas posteriores del ciclo vital. Apoyando este punto se necesita diseñar e implementar una política lechera con acertado sentido común, ubicada dentro de la realidad actual del país y ejecutada por profesionales y técnicos capaces del sector oficial y de la industria; y diseñar programas, publicaciones y campañas de educación nutricional con mensajes apropiados que ilustren los beneficios de los lácteos en una sana alimentación.
Dada la importancia del establecimiento de recomendaciones nutricionales adaptadas a las realidades de Venezuela, sería de gran interés la conformación de un comité regional integrado por varios países con poblaciones similares, para elaborar las recomendaciones de éstos y otros micronutrientes.