La niacina es una vitamina hidrosoluble, conocida también como ácido nicotínico o vitamina B3. La nicotinamida es un derivado de la niacina (amida del ácido nicotínico), y es utilizada por el cuerpo para producir las coenzimas nicotinamida adenina dinucleótido (NAD) y nicotinamida adenina dinucleótido fosfato (NADP). En esta revisión de los requerimientos de niacina para Venezuela, encontramos que los datos nacionales no son suficientes para establecer las recomendaciones de consumo de este nutriente, por lo tanto, al igual que en la revisión del año 2000, las recomendaciones actuales se basan en las definidas para la población de Estados Unidos. Las Ingestas Dietéticas Recomendadas (RDAs) para Venezuela son: menores de 1 año (2-4 mg/día), niños entre 1 y 8 años (6-8 mg/día), niños entre 9 y 13 años (12 mg/día), adolescentes y adultos del sexo femenino (14 mg/día), adolescentes y adultos del sexo masculino (16 mg/día), embarazadas (18 mg/día) y lactancia (17 mg/día). En cuanto al Requerimiento Promedio Estimado (EAR): 5-9 mg/día para niños, 11 mg/día para adolescentes y adultos del sexo femenino y 12 mg/día para adolescentes y adultos del sexo masculino, aumentado a 14 mg/día para embarazadas y a 13 mg/día durante la lactancia. Los Niveles de Ingesta Máximos Tolerables (UL) son: niños entre 1 y 3 años (10 mg/día), niños entre 4 y 8 años (15 mg/día), niños entre 9 y 13 años (20 mg/día), adolescentes (30 mg/día) y adultos (35 mg/día). Es necesario realizar estudios donde se evalúe el estado nutricional de esta vitamina en diferentes grupos de la población, que incluya no solo la estimación del consumo, sino la utilización de indicadores bioquímicos, como la medición de los niveles de las coenzimas NAD y NADP en eritrocitos o sangre completa y la determinación de los principales metabolitos urinarios de la vitamina.
Palabras clave: Niacina, ácido nicotínico, niacinamida, Ingesta Dietética Recomendada, Niveles de Ingesta Máximos Tolerables, Venezuela.
Niacin is a water soluble vitamin, also known as nicotinic acid or Vitamin B3. Nicotinamide is a derivative of niacin (amide of nicotinic acid), and is used by the body to produce the coenzyme nicotinamide adenine dinucleotide (NAD) and nicotinamide adenine dinucleotide phosphate (NADP). In preparing this review about the niacin requirements for Venezuela, it was found that there is not enough national data to establish recommendations, therefore, as in the 2000 review of the Venezuelan Recommended Dietary Allowances (RDAs), the actual recommendations for intake of niacin, are based on those reported for the United States population. The RDAs for Venezuela are: 2-4 mg/day for infants less than 1 year old, 6-8 mg/day for children between 1 and 8 years, 12 mg/day for children between 9 and 13 years, 14 mg/day for adolescents and female adults, 16 mg/day for adolescents and adult males, 18 mg/day during pregnancy and 17 mg/day during lactation. The estimated average requirement (EAR) is: 6-9 mg/day for children, 11 mg/day for adolescents and female adults and 12 mg/day for adolescents and adult males, increasing to 14 mg/day during pregnancy and to 13 mg/day during lactation. The niacin Tolerable Upper Intake Levels (UL) are: 10 mg/day for children between 1 and 3 years, 15 mg/day for children between 4 and 8 years, 20 mg/day for children between 9 and 13 years, 30 mg/day for adolescents and 35 mg/day for adults. It is necessary to perform studies where the nutritional status of this vitamin is evaluated for different population groups, including not only the estimation of consumption, but the use of biochemical indicators, such as measuring the levels of the coenzymes NAD and NADP in erythrocytes or whole blood and determination of the major urinary metabolites of the vitamin.
Key words: Niacin, nicotinic acid, nicotinamide, Recommended Dietary Allowance, Tolerable Upper Intake Levels, Venezuela.
Departamento de Tecnología de Procesos Biológicos y Bioquímicos. Universidad Simón Bolívar. Caracas. Servicio de Nutrición, Crecimiento y Desarrollo. Hospital de Niños J.M. de los Ríos. Caracas, Venezuela.
La niacina es una vitamina hidrosoluble, conocida también como ácido nicotínico o vitamina B3. La nicotinamida es un derivado de la niacina (amida del ácido nicotínico), y es utilizada por el cuerpo para producir las coenzimas nicotinamida adenina dinucleótido (NAD) y nicotinamida adenina dinucleótido fosfato (NADP) (1).
El ácido nicotínico y la nicotinamida son sólidos blancos y cristalinos, muy estables tanto al calor como a la luz, a la oxidación y a los cambios de pH. La nicotinamida es más soluble que el ácido nicotínico en agua, alcohol y éter (2).
Además de su síntesis a partir de la niacina en la dieta, el NAD también puede ser sintetizado en el hígado a partir del triptófano, un aminoácido dietario. La síntesis de niacina a partir de triptófano depende de enzimas que requieren de vitamina B6 y riboflavina, así como de una enzima que contiene un grupo hemo (hierro) (1). Se ha determinado que un consumo bajo de las vitaminas B6 y B1, y alto de proteínas, puede afectar negativamente la conversión de triptófano a niacina (3-5). En promedio, 1 mg de niacina puede sintetizarse a partir de la ingesta de 60 mg de triptófano. De este modo, se considera en general, que 60 mg de triptófano son iguales a 1 mg de equivalentes de niacina (EN). Para la población japonesa, se utiliza una equivalencia de 67 mg triptófano = 1 mg de niacina (6).
La absorción del ácido nicotínico y de la nicotinamida a concentraciones fisiológicas, se realiza en el intestino delgado por un proceso de difusión facilitada pH dependiente, mediada por un transportador de alta afinidad, independiente de sodio. Por otra parte, no está del todo establecido el mecanismo involucrado en la absorción de dosis farmacológicas de la vitamina, aunque se ha sugerido que pudiera realizarse por un proceso de difusión pasiva. Pueden absorberse casi en su totalidad de 3 a 4 g de niacina tomados por vía oral (7).
EL NAD y el NADP, que son las principales formas de la niacina en los alimentos, son previamente hidrolizadas por glucohidrolasas en la mucosa intestinal, para liberar nicotinamida. La niacina se transporta en el plasma como ácido nicotínico y nicotinamida, ambas moléculas entran a los tejidos por difusión pasiva, aunque hay evidencias de la existencia de sistemas específicos que facilitan la captura tisular. Los tejidos transforman estos compuestos en las coenzimas NAD y NADP encontrándose esta última en forma reducida (NADPH). El principal producto de degradación de la niacina, luego de su metilación en el hígado, es la N-metilnicotinamida (NMN), la cual se excreta por vía urinaria, junto con otros compuestos producto de la oxidación de la NMN: 2- y 4- piridona (2).
Los organismos vivos obtienen la mayor parte de su energía a través de reacciones de oxido-reducción (redox), procesos que involucran la transferencia de electrones. Cerca de 200 enzimas requieren de las coenzimas de la niacina, NAD y NADP, principalmente para aceptar o entregar electrones. El NAD participa generalmente, en reacciones que producen energía, que involucran la degradación (catabolismo) de carbohidratos, grasas, proteínas, y alcohol. El NADP participa frecuentemente, en reacciones biosintéticas (anabólicas), como en la síntesis de todas las macromoléculas, incluyendo ácidos grasos y colesterol (1, 8).
El cofactor NAD de la niacina también es necesario para importantes reacciones no redox. Es el sustrato para dos clases de enzimas: mono-ADP-ribosiltransferasas y poli-ADP- ribosa polimerasas (PARPs), las cuales separan la niacina del NAD, y transfieren el ADP-ribosa a una proteína aceptora o a la propia enzima. El aminoácido aceptor de la ADP-ribosa en las proteínas puede ser arginina y cisteína principalmente, y además, asparagina e histidina en algunos casos (9, 10).
Una tercera clase de enzimas: ADP-ribosil ciclasa, catalizan la formación de ADP-ribosa cíclico (cADP-Ribosa), una molécula que en el interior de las células, provoca la liberación de iones de calcio de sitios de almacenaje interno y que probablemente también juega un papel en la señalización celular. La participación de la cADP-Ribosa en la regulación del calcio citosólico, podría sustentar la hipótesis de la serotonina, para explicar los signos psiquiátricos y neurológicos de la deficiencia de niacina (pelagra) (1).
Desde el año 1955 se conoce que dosis farmacológicas de ácido nicotínico, y no de nicotinamida, reducen el colesterol sérico (11). Numerosos ensayos clínicos importantes relacionados con enfermedades cardiovasculares, encuentran que el ácido nicotínico como monoterapia, o en conjunto a otras terapias, tiene un beneficio estadísticamente significativo tanto en hombres como en mujeres (11-13). Así lo ha confirmado un meta-análisis reciente, donde se evaluaron 11 ensayos clínicos aleatorizados (9.959 participantes), que concluyó que la utilización de la niacina se asoció con una reducción significativa de eventos cardiovasculares (14). Se ha determinado, que el ácido nicotínico aumenta notablemente los niveles de colesterol HDL, disminuye las concentraciones séricas de triglicéridos y de la lipoproteína-a, y cambia las partículas de LDL densas y pequeñas por partículas grandes con menor poder aterogénico; todos estos cambios en el perfil lipídico de la sangre se consideran cardioprotectores. Además, los efectos de la niacina parecen ser dosis-dependientes (11, 15). De acuerdo con esto, Zou y Si en 2013, muestran un efecto positivo y significativo de la terapia combinada de fibratos y niacina, al disminuir los triglicéridos circulantes y aumentar los valores de HDL-colesterol, en pacientes ancianos (>75 años) con hiperlipidemia mixta, sin el riesgo de efectos adversos graves (16). Por otra parte, se ha determinado, que el tratamiento con niacina de pacientes hipercolesterolémicos con niveles bajos de HDL, provoca una disminución significativa en su estado de estrés oxidativo. Estos resultados indican un efecto beneficioso adicional de la niacina más allá de su capacidad de influir en el perfil lipídico (17).
Fuentes de origen animal: La principal fuente la constituyen las carnes, de ternera, de aves, de cordero y de cerdo. El hígado es la víscera con más contenido de niacina. Los pescados también son fuente importante de niacina, especialmente el atún, el cual posee altos niveles de esta vitamina. Por otro lado, la leche y sus derivados, junto con los huevos, son ricos en triptófano, lo cual es muy importante considerando que partir de éste se puede sintetizar la vitamina (2,18).
Fuentes de origen vegetal: Se reportan altas concentraciones de niacina en los cereales integrales y sus derivados, también en los guisantes, patatas, alcachofas y cacahuetes. Las fuentes de triptófano en el reino vegetal son la avena, los dátiles y el aguacate (2,18).
La última etapa de la deficiencia severa de niacina se conoce como pelagra, que se presenta en dietas monótonas a base de maíz y otros cereales que contiene niacina no utilizable (niacitina) y poco triptófano. En los países industrializados la deficiencia de niacina se debe a causas como la desnutrición y el alcoholismo (2). También puede presentarse en pacientes con tumores carcinoides intestinales, probablemente por la gran producción de serotonina que disminuye la síntesis de ácido nicotínico a partir del triptófano; o en pacientes con enfermedad de Hartnup, un trastorno hereditario que causa absorción deficiente de triptófano (8). Por otra parte, se ha descrito que el tratamiento prolongado con Isoniazida, un medicamento contra la tuberculosis, ha dado lugar a deficiencia de niacina (19). Las manifestaciones clínicas más comunes de la deficiencia de niacina involucran a la piel, al sistema digestivo, y al sistema nervioso. A la pelagra comúnmente se le conoció como la enfermedad de las 3 D’s: dermatitis, diarrea y demencia (20).
En la piel, un sarpullido de pigmentación oscura, grueso y escamoso, se desarrolla simétricamente en las zonas expuestas a la luz del sol. De esta manera, la palabra “pelagra” deriva de la expresión italiana para piel áspera o “en carne viva.” Los síntomas relacionados al sistema digestivo incluyen una lengua roja y brillante, vómitos, y diarrea. Inicialmente, la diarrea puede estar ausente y presentarse en formas más avanzadas por inflamación de la mucosa y la malabsorción, aumentando la gravedad por la disminución en la superficie de absorción y la disminución del tiempo de tránsito intestinal, a la vez que aumentan los requerimientos. Los síntomas neurológicos incluyen dolores de cabeza, apatía, fatiga, depresión, desorientación, y pérdida de memoria. Si no se trata, la pelagra es en última instancia, fatal (1, 19).
La deficiencia de niacina también ha sido vinculada a la inestabilidad genómica, relacionada con la alteración de la función de la familia de enzimas de la poli ADP-ribosa polimerasa (PARPs). En varios modelos, se ha encontrado que la deficiencia de niacina provoca alteraciones en el ciclo celular y detención de la apoptosis, reparación inadecuada de las roturas en la doble hebra del ADN, y por tanto acumulación de daños en esa molécula y aumento del riego de cáncer (21).
Se desconoce si la niacina de los alimentos causa efectos secundarios. La mayoría de los efectos adversos han sido reportados con preparaciones farmacológicas de la niacina, especialmente con el ácido nicotínico (2).
El efecto secundario más común al consumo de ácido nicotínico es la rubefacción cutánea, que consiste en el enrojecimiento de la piel acompañado de calor y picazón. Se inicia en la cara, pero puede extenderse a los brazos y el cuerpo. Episodios severos de ruborización pueden provocar hipotensión y mareos. La ruborización generalmente aparece temprano, 30 minutos después de ingerir la dosis de ácido nicotínico, y poco más tarde (de 2 a 4 horas) con el ácido nicotínico de liberación sostenida y el de liberación prolongada. También, se presentan con frecuencia, molestias gastrointestinales como náuseas y vómitos. Por otra parte, se ha observado que dosis elevadas de ácido nicotínico deterioran la tolerancia a la glucosa, probablemente debido a una sensibilidad disminuida a la insulina. Se ha observado hepatotoxicidad (daño de células hepáticas), incluyendo ictericia y enzimas hepáticas elevadas, a ingestas de un mínimo de 750 mg de ácido nicotínico al día por menos de tres meses (22,23). Las personas con enfermedades hepáticas, diabetes, úlcera péptica activa, gota, arritmias cardiacas, enfermedades inflamatorias del intestino, migraña, y alcoholismo, podrían ser más susceptibles a los efectos adversos de un exceso en la ingesta de ácido nicotínico que la población general (20).
Por lo general, la nicotinamida se tolera mejor que el ácido nicotínico. Sin embargo, con dosis de 3 gramos al día se han observado náuseas, vómitos, y signos de toxicidad hepática (enzimas hepáticas elevadas, ictericia) (24).
De acuerdo con lo anterior, la Junta de Nutrición y Alimentos estableció el Nivel de Ingesta Máxima Tolerable (UL) para la niacina (ácido nicotínico y nicotinamida) en 35 mg/día, para evitar la rubefacción cutánea como un efecto secundario. Dicho nivel máximo se aplica a la población en general (no incluye a los niños menores de 12 meses), y no está pensado para aplicarse a personas que toman suplementos de ácido nicotínico en dosis altas para tratar los niveles elevados de colesterol en la sangre (20).
En relación a la situación de la niacina en el mundo, vale la pena destacar, que actualmente la deficiencia grave de niacina es poco común, y se encuentra concentrada en los países más pobres, especialmente en las zonas rurales. En aquellas poblaciones donde la base de la alimentación es el maíz, el sorgo o el centeno, cereales que contienen niacina no asimilable, la prevalencia de deficiencia puede ser elevada. En México y Guatemala a pesar de que el maíz es muy consumido por la población, el proceso de nixtamalización mediante el cual se añade cal (óxido de calcio) previo a la cocción, asegura que la niacina pueda hidrolizarse aumentando la biodisponibilidad de ésta (25, 26). También la deficiencia de niacina puede encontrarse en algunos grupos vulnerables, como los alcohólicos y pacientes desnutridos con SIDA, probablemente en estos últimos, asociado al incremento de las necesidades metabólicas (27). Por otra parte, en los pacientes con SIDA se encuentra disminuida la síntesis de niacina a partir del triptófano, lo que puede comprometer el estado nutricional de la vitamina (28).
Brotes recientes de pelagra, se han descrito en asociación con situaciones de emergencia humanitaria en Malawi, Mozambique, Angola, Zimbabwe y Nepal (25). En el caso específico de Angola, de acuerdo con Seal y colaboradores en 2007, la incidencia de pelagra clínica no ha disminuido luego de la guerra civil que finalizó en el año 2002, lo que pone de manifiesto, que en este país la deficiencia de niacina continúa siendo un problema de salud pública, lo que probablemente se repita en otros países africanos donde el maíz es el principal alimento de la dieta diaria (26).
En un estudio llevado a cabo en 356 residentes urbanos (adultos) del noreste de Etiopía, se encontró un consumo de niacina por debajo de las recomendaciones, en el 86,2 % de los sujetos evaluados (29). En Tailandia, cuando se evaluaron 400 mujeres embarazadas en el sureste del país, se encontró una prevalencia de deficiencia de niacina del 43,2 %, la cual estuvo acompañada por la deficiencia de otros micronutrientes (vitamina c, ácido fólico, retinol, etc.). Estas deficiencias estuvieron asociadas a una serie de factores individuales como la edad de la mujer, el nivel de educación y la edad gestacional (30).
La evaluación del estado nutricional de las vitaminas B1, B2 y niacina entre niños de la zona rural y urbana realizado en la provincia de Shandong (China), mostró que 9% de los niños de la zona urbana mostró deficiencia de niacina, mientras que en la zona rural la prevalencia de deficiencia fue de 27% (31).
Por otra parte, una investigación en adolescentes femeninas de la India (2-18 años) de diferentes estratos socioeconómicos, evaluó el estado nutricional de varios micronutrientes y su relación con la talla y el peso. Las niñas y adolescentes de los estratos alto y medio, presentaron un mejor estado nutricional para todos los nutrientes estudiados en relación a las de los estratos medio y bajo. Entre otros resultados, se encontró que las participantes con baja estatura, tenían un consumo significativamente menor de calcio, cinc, hierro, betacarotenos, folato, riboflavina, vitamina C y en especial, de niacina (32).
Consumos bajos de la vitamina han sido reportados en algunos países de Latinoamérica como Colombia, Chile y Perú. En 2007, Gamboa y colaboradores determinaron el patrón alimentario y evaluaron el estado nutricional en la población de niños en edad escolar, en un sector pobre del Municipio de Piedecuesta (Departamento de Santander, Colombia). Los resultados mostraron porcentajes bajos de adecuación para el consumo de calcio, vitamina B6, hierro, cinc y niacina (33).
En la ciudad de Concepción (Provincia de Concepción, Chile), a través de un recordatorio de 24 horas por 2 días no consecutivos, se estimó el consumo de micronutrientes de 241 gestantes (20-43 años). De acuerdo con los resultados, el 86,7% de las embarazadas presentaron una adecuación menor al 75 % para la niacina (34).
En Perú, se realizó un estudio que tuvo como propósito determinar el consumo de hierro, ácido fólico, vitamina B1, vitamina B2, niacina y vitamina C en mujeres en edad fértil (15 a 49 años de edad) y niños de 12 a 35 meses en el ámbito departamental y nacional (35). Para tal fin, se emplearon las bases de datos de la Encuesta Nacional de Consumo de Alimentos (2003) (36). Las recomendaciones diarias de niacina (mg/día), no fueron cubiertas por el 85,9% de las mujeres en edad fértil. La mediana del porcentaje de adecuación de niacina en los niños de 12 a 35 meses de edad fue de 67,0%. Adicionalmente, el 77,9% de los niños presentó un consumo de niacina (mg/día) inferior a las recomendaciones (35).
Finalmente, vale la pena destacar que los pacientes con Síndrome Metabólico (SM) también pueden presentar deficiencia de niacina, tal como lo indican los resultados reportados por Odum y Wakwe en 2012 (37), que muestran valores significativamente menores en los niveles plasmáticos de algunas vitaminas hidrosolubles, entre éstas la niacina, en sujetos con SM en comparación con los controles sanos. El SM y sus componentes (hiperglicemia, trigliceridemía, hipertensión, obesidad) están relacionados con un estado de estrés oxidativo e inflamación y con una disminución de los niveles circulantes de algunas vitaminas hidrosolubles (vitamina C, tiamina, niacina, piridoxal) (37). El poder reductor del NADPH es importante para asegurar un aporte continuo de glutatión reducido. Este último es un neutralizador de radicales libres o especies reactivas de oxígeno, y un factor esencial para la actividad de la glutatión peroxidasa (enzima antioxidante). En este sentido, un bajo nivel de las vitaminas hidrosolubles puede empeorar los signos de la enfermedad e incrementar el riego de diabetes y enfermedad cardiovascular (37,38).
En contraste, en algunos países se ha encontrado un consumo elevado de niacina en determinados grupos de edad. En un estudio llevado a cabo en Canadá en una muestra de más de 30.000 participantes mayores de 1 año de uno u otro sexo, se encontró una baja prevalencia de consumos bajos de niacina y otros micronutrientes (< 30%), a excepción de las vitaminas A y D, el calcio y el magnesio. Por otra parte, cuando se consideró la utilización de suplementos, ≥10% de los usuarios en algunos grupos de edad/sexo, presentaron consumos de vitamina A y C, niacina, ácido fólico Fe, Zn y Mg, por encima del Nivel de Ingesta Máximo Tolerable (UL), alcanzando más del 80% para la vitamina A y la niacina (85% para los niños entre 1-3 años). Esto podría ser motivo de preocupación para las autoridades sanitarias de ese país, considerando que el 41% de los canadienses consume suplementos (39).
En cuanto a la situación del nutriente en nuestro país, es muy escasa la información disponible. El Informe Nacional de Seguimiento de la Aplicación del Plan de Acción de la Cumbre Mundial sobre la Alimentación 2008 (40), en relación a la situación del país en materia de seguridad alimentaria y específicamente, en lo que se refiere al consumo de alimentos y diversificación alimentaria, reporta que para el periodo 2002-2004, la adecuación de las disponibilidades en términos del aporte de niacina, se encontraba en la zona de suficiencia plena (160%).
Más recientemente, la hoja de balance de alimentos para el año 2010, en lo que concierne a la adecuación energética y nutricional de la disponibilidad alimentaria, muestra que la disponibilidad total de niacina era de 27,3 mg/persona/día, lo que equivale a una adecuación del 189,26% (41). Esta alta adecuación puede estar relacionada con el aporte importante de niacina que pueden tener los cereales a la dieta del venezolano, tomando en consideración que tanto la harina de maíz precocida, como la harina de trigo para todo uso, están enriquecidas con la vitamina (5,10 y 2,0 mg/100g; respectivamente) (42, 43). Por otra parte, los cereales constituyen los alimentos más consumidos por los venezolanos (44-46). En todo caso, vale la pena destacar, que no se realizan análisis de rutina de niacina en dichas harinas; además, la fortificación de la harina de trigo, es de carácter voluntario (47).
Por otra parte, al ser la disponibilidad un promedio nacional, no refleja las diferencias entre los estados y dependencias del país, ni las relacionadas con las zonas urbanas y rurales. Tampoco indica las diferencias asociadas con el estrato social o la edad (43). En este sentido, no es posible definir si hay algún grupo de la población en riesgo de deficiencia.
Actualmente, no se dispone de estudios suficientes en los que se haya estimado directamente el consumo de niacina o se hayan determinado indicadores del estado nutricional de esta vitamina en diferentes grupos de edad. Uno de los pocos estudios disponibles en la literatura, fue llevado a cabo por Santos y col. (2003), en 863 embarazadas (137 desnutridas actuales, 561 eutróficas, y 165 con sobrepeso-obesidad), en las cuales se evaluó el consumo de macro y micronutrientes. Se encontró en general, un consumo deficiente de macro y micronutrientes con excepción de las vitaminas A y C. En el caso de la niacina, la adecuación varió entre 59,9% para las embarazadas desnutridas y eutróficas, y 66,7% para las embarazadas con sobrepeso u obesidad (48).
En la revisión del año 2000 (Instituto Nacional de Nutrición, 2000), de los valores de referencia de energía y nutrientes para la población venezolana (49), no se contaba con información nacional sobre el consumo de niacina, situación que se mantiene en la actualidad. Por otro lado, los datos disponibles que muestran la disponibilidad de la vitamina, indican que hay un consumo adecuado de la misma (adecuación mayor al 100%).
Como se comentó anteriormente, en el país se cuenta con productos de consumo masivo enriquecidos con esta vitamina (harina de maíz precocida y harina de trigo panadera); por lo tanto, se debe mantener la disponibilidad de los alimentos fuente de la niacina y vigilar la población susceptible al déficit.
En este sentido, es conveniente que se mantengan las recomendaciones publicadas en el año 2000, que se basaron en las definidas para la población de Estados Unidos (20). Así, en la tabla 1 se presentan las recomendaciones de consumo de niacina para Venezuela, que incluyen las Ingestas Dietéticas Recomendadas (RDAs), el Requerimiento Promedio Estimado (EAR), y los Niveles de Ingesta Máximos Tolerables (UL).
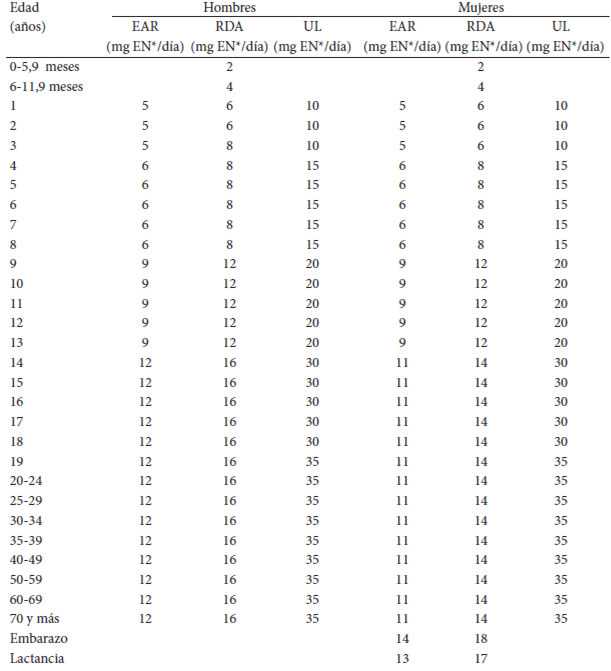
Las Ingestas Dietéticas Recomendadas (RDAs) son: menores de 1 año (2-4 mg/día), niños entre 1 y 8 años (6-8 mg/día), niños entre 9 y 13 años (12 mg/día), adolescentes y adultos del sexo femenino (14 mg/día), adolescentes y adultos del sexo masculino (16 mg/día), embarazadas (18 mg/día) y lactancia (17 mg/día).
En cuanto al Requerimiento Promedio Estimado (EAR): 5-9 mg/día para niños, 11 mg/día para adolescentes y adultos del sexo femenino y 12 mg/día para adolescentes y adultos del sexo masculino, aumentado a 14 mg/día para embarazadas y a 13 mg/día durante la lactancia.
Finalmente, los Niveles de Ingesta Máximos Tolerables (UL) para la niacina son: niños entre 1 y 3 años (10 mg/día), niños entre 4 y 8 años (15 mg/día), niños entre 9 y 13 años (20 mg/día), adolescentes (30 mg/día) y adultos (35 mg/día).
Vale destacar, que estas ingestas recomendadas de niacina, son similares a las establecidas para algunos países de la Unión Europea, como Reino Unido, España, Francia e Italia (50); así como a las reportadas por la FAO/WHO en el 2002 (51).
Es necesario realizar estudios donde se evalúe el estado nutricional de esta vitamina en diferentes grupos de la población, que incluya no solo la estimación del consumo, sino la utilización de indicadores bioquímicos, como la medición de los niveles de las coenzimas NAD y NADP en eritrocitos o sangre completa y la determinación de los principales metabolitos urinarios de la vitamina (1-metilnicotinamida and 1-metil-2-piridona-5-carboxamida) (52). Igualmente sería conveniente realizar ensayos en el país, con el objetivo de evaluar los efectos de la niacina (ácido nicotínico), en el metabolismo lipídico.