El endurecimiento de los granos de Phaseolus vulgaris almacenados a alta temperatura y alta humedad relativa es una de las principales limitantes para su consumo. El objetivo de esta investigación fue evaluar por microscopia de barrido electrónico los cambios estructurales ocurridos en los cotiledones y en la testa de los granos endurecidos. Los granos recién cosechados se almacenaron durante doce meses bajo dos condiciones: 5°C-34% HR y 37°C-75% HR. Esta última con el fin de propiciar el endurecimiento. Los granos almacenados crudos y cocidos se liofilizaron y se fracturaron. Las secciones de testa y cotiledones se observaron en un microscopio electrónico JSM-6390. Al cabo de doce meses se constató que los granos almacenados a 37°C-75% HR aumentaron su dureza en un 503%, mientras que los granos almacenados a 5°C-34% HR no incrementaron su dureza significativamente. A nivel microestructural, en los cotiledones de los granos crudos se notaron claras diferencias en el aspecto de la pared celular, en el tamaño del espacio intercelular y en la textura de la matriz proteica. Mientras que en la testa de los granos crudos se evidenciaron diferencias en la compactación de la empalizada y de la capa sub-epidérmica. En los granos cocidos se observó una total separación entre las células de los cotiledones de los granos blandos y una muy limitada separación en los granos duros. Se concluye que las diferencias observadas en los granos duros y blandos, demostraron una participación importante de ambas estructuras, cotiledones y testa, en el endurecimiento de los granos.
Palabras clave: Cambios microscópicos, cotiledones, endurecimiento, Phaseolus vulgaris, testa.
The hardening of Phaseolus vulgaris beans stored at high temperature and high relative humidity is one of the main constraints for consumption. The objective of this research was to evaluate by scanning electron microscopy, structural changes in cotyledons and testa of the hardened beans. The freshly harvested grains were stored for twelve months under two conditions: 5 ° C-34% RH and 37 ° C-75% RH, in order to promote hardening. The stored raw and cooked grains were lyophilized and fractured. The sections of testa and cotyledons were observed in an electron microscope JSM-6390. After twelve months, grains stored at 37 ° C-75% RH increased their hardness by 503%, whereas there were no significant changes in grains stored at 5 ° C-34% RH. At the microstructural level, the cotyledons of the raw grains show clear differences in appearance of the cell wall, into the intercellular space size and texture matrix protein. There were also differences in compaction of palisade and sub-epidermal layer in the testa of raw grains. After cooking, cotyledon cells of the soft grains were well separated while these of hard grains were seldom separated. In conclusion, the found differences in hard and soft grains showed a significant participation of both structures, cotyledons and testa, in the grains´ hardening.
Key words: Microscopic changes, cotyledons, hardening, Phaseolus vulgaris, testa.
Departamento de Procesos Agroindustriales. Universidad Centroccidental Lisandro Alvarado, Barquisimeto, Venezuela. Departamento de Tecnología de Servicios. Universidad Simón Bolívar, Caracas, Venezuela.
La mayoría de las leguminosas de grano se consumen en forma de sopas, cremas o ensaladas. A nivel mundial, los granos de Phaseolus vulgaris (conocida comúnmente como caraota en Venezuela y frijoles, frejoles o judías en otros países de habla hispana) son consumidos en diferentes formas, siendo la más frecuente la sopa. El proceso tradicional de cocción de los granos generalmente implica un remojo previo durante toda la noche (10 a 16 h), cuyo fin es reducir los tiempos de cocción (1) y remover azúcares flatulentos. La temperatura es uno de los factores importantes del remojo, puesto que a mayor temperatura se incrementa la velocidad de hidratación, disminuyendo el tiempo para alcanzar el equilibrio.
Los principales cambios químicos y estructurales que ocurren durante la cocción de los granos son la hidrólisis y solubilización de los polisacáridos pécticos de la pared celular, la gelatinización del almidón y la coagulación de la proteína. Los tratamientos térmicos inicialmente producen un ablandamiento debido al rompimiento de la membrana plasmática; sin embargo, el ablandamiento más significativo ocurre seguidamente como resultado del incremento en la separación celular. Esto ha sido generalmente atribuido a la degradación β-eliminativa de los ácidos poligalacturónicos metilesterificados contenidos en la laminilla media, los cuales juegan un papel importante en la adhesión celular. Este tipo de degradación implica el rompimiento de los enlaces glucosídicos bajo condiciones no acídicas y es típica de los procesos térmicos. El control del pH y de los niveles de cationes mono y divalentes en el medio de cocción puede influenciar la velocidad de ablandamiento (2).
El “Hard to Cook (HTC)” o “Duro para cocinar” es un defecto de textura que afecta a las leguminosas de grano almacenadas por largos períodos en condiciones de alta temperatura y alta humedad relativa, y se define como la resistencia de los granos a ablandarse durante la cocción. A nivel microestructural se caracteriza por una falla en la separación de las células de los cotiledones durante la cocción, causada por la rigidez de la pared celular y específicamente por la resistencia de la laminilla media a disolverse.
Algunos autores consideran que existen dos tipos de endurecimiento en los granos almacenados bajo condiciones adversas, uno a nivel de la testa al cual denominan “Hard Shell” y otro a nivel de los cotiledones que corresponde al “Hard to Cook”. El “Hard Shell” se ha asociado a impermeabilidad de la testa lo que genera una reducción de la capacidad de absorción de agua en el grano, y el “Hard to cook”, tal como se describió, se relaciona con una reducida separación celular en los cotiledones durante la cocción (3).
El HTC implica un deterioro del valor nutritivo puesto que los tiempos largos de cocción generan pérdidas de vitaminas hidrosolubles y una reducción de la calidad proteica (4, 5). Por otra parte, desde el punto de vista económico, es de esperarse que el HTC genere pérdidas a los productores y distribuidores, puesto que los consumidores rechazan los granos que poseen este defecto (6, 7).
Se han propuesto varios mecanismos para explicar la causa del endurecimiento de las leguminosas: i) hidrólisis de los fitatos y desmetoxilación de las pectinas con la consecuente formación de pectatos insolubles, ii) lignificación de la laminilla media, iii) predominio de la coagulación de la proteína sobre la gelatinización del almidón durante la cocción, iv) formación de puentes fenólicos entre polisacáridos de la pared celular y v) mecanismo múltiple, en el cual está involucrado más de un tipo de tejido y más de una clase de reacción bioquímica (8).
Estudios de microscopia electrónica de barrido han revelado que las paredes celulares primarias y secundarias de granos duros y blandos responden en forma similar frente a la cocción, a diferencia de la laminilla media que se degrada en los granos blandos pero permanece intacta en los granos duros (9). No obstante, aún no está completamente dilucidado el mecanismo de endurecimiento de las leguminosas, de allí la importancia de aportar nuevas evidencias que apoyen una u otra de las hipótesis planteadas. En este sentido, el objetivo de la presente investigación fue evaluar por microscopia de barrido electrónico los cambios estructurales ocurridos en los cotiledones y en la testa de los granos endurecidos, comparándolos con los granos blandos, y relacionarlos con los mecanismos de endurecimiento propuestos.
Los granos de Phaseolus vulgaris recién cosechados se almacenaron durante 12 meses bajo dos condiciones: baja temperatura-baja humedad (BTBH), 5°C-34% HR, y alta temperatura-alta humedad (ATAH), 37°C-75% HR. Esta última con el fin de propiciar el endurecimiento. Las cámaras de almacenamiento consistieron en recipientes de vidrio con tapa, dentro de los cuales se colocaron soluciones salinas saturadas de MgCl2 y NaCl para alcanzar valores de humedad relativa de 34 y 75%, respectivamente (10). A su vez, estas cámaras permanecieron dentro de una cava y una incubadora con temperaturas controladas de 5 y 37°C, respectivamente.
La dureza de los granos cocidos, equivalente a la fuerza requerida para penetrarlos con una sonda, se midió con un texturómetro TA-XT2i (Stable Micro Systems, R.U). La velocidad del ensayo fue de 1,0 mm/s, se usó una celda de 5 kg y una sonda múltiple para guisantes, con la cual se analizan 18 granos a la vez. Para la cocción se remojó una muestra de 20 g de granos enteros en 100 mL de agua destilada por 18 h a temperatura ambiente, luego se drenó el agua y los granos se colocaron en 100 mL de agua destilada a la temperatura de ebullición, para cocinarlos por 60 min.
El análisis microscópico de los granos almacenados crudos y cocidos se realizó previa liofilización y fractura de los mismos (11). Las secciones de testa y cotiledones se observaron en un microscopio electrónico JSM-6390 (JEOL, USA) con un voltaje de aceleración de 25 kv.
Análisis Estadístico: La dureza de los granos se expresó como el promedio ± desviación estándar. La comparación entre los granos almacenados en las dos condiciones, por diferentes periodos, se hizo con la prueba pareada t. El nivel de significancia fue definido a p ≤ 0,05.
Al cabo de doce meses se constató que los granos almacenados a 37°C-75% HR aumentaron su dureza en un 503%, desde 20,8 ± 1,0 N hasta 125,4 ± 6,0 N, mientras que los granos almacenados a 5°C-34% HR no incrementaron su dureza significativamente, manteniéndose en 18,5 ± 2, 0 N.
En las Figuras 1 a la 3 se muestran las imágenes obtenidas por microscopia electrónica de barrido de los granos crudos, con 12 meses de almacenamiento a ATAH y BTBH. Cabe destacar, que también se analizaron las muestras almacenadas por 4 meses, no obstante, el efecto de las condiciones de temperatura y humedad relativa fue más notorio en las muestras almacenadas durante 12 meses. En las ampliaciones x10000 y x5000 (Figura 1) se señalan las paredes celulares de células contiguas de los cotiledones, y en los granos suaves se puede observar claramente la separación entre la pared de una célula y otra, mientras que en los granos duros no se distingue esta división, lo cual puede afectar la separación de las células durante la cocción.

Por otra parte, se puede notar que el espacio intercelular (EI) es mayor en los cotiledones de los granos duros, posiblemente por la reducción del espesor de la pared celular. Es importante aclarar que estos espacios se encuentran en la unión de tres células, y se forman durante el desarrollo del grano, para proveer de una estructura tridimensional al tejido que le permita el flujo de gases. En las esquinas de estos espacios se unen las laminillas medias de las dos células contiguas.
En la Figura 2 se indican ampliaciones menores, x1000 y x300, en la primera de las cuales se puede notar claramente, en los granos duros, la pared celular rodeando a los gránulos de almidón, mientras que en los granos suaves no se distingue de la matriz proteica, lo cual puede estar relacionado con un aumento de la rigidez de la pared celular en los cotiledones de los granos duros. Esto se confirma en la imagen de la ampliación x300, puesto que en el parénquima de los cotiledones de los granos suaves no se diferencia la división entre una célula y otra, mientras que en los granos duros se puede observar esta separación, con un aspecto de “panal de abejas”, e incluso se pueden ver algunas células no fracturadas. Esta resistencia a la fractura demuestra a nivel microscópico el endurecimiento de los cotiledones en los granos duros.
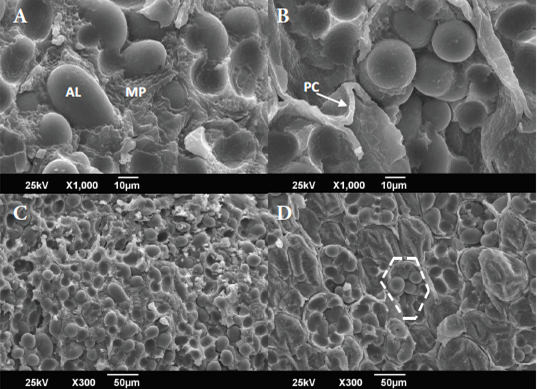
Adicionalmente, en ambas ampliaciones, se puede distinguir entre la textura de la matriz proteica de unos granos y otros, siendo de aspecto liso en los granos duros y rugosa en los granos suaves, lo cual concuerda con lo observado en otros estudios (1, 11, 12). Por otra parte, es importante destacar que en todas las muestras los gránulos de almidón se mantuvieron intactos y presentaron forma elipsoidal.
Las imágenes relacionadas con la testa se muestran en la Figura 3, con ampliaciones de x1000 y x100. En la primera de ellas, se distinguen las células de la empalizada en la parte superior, y debajo de estas se encuentran las células sub-epidérmicas. En los granos duros se observa una mayor compactación en ambas capas, lo cual puede afectar la capacidad de imbibición del grano y por ende su facilidad para ablandarse. Igualmente, en la ampliación x100 se puede notar una total separación de la testa al fracturar los granos duros, en tanto que se mantiene unida a los cotiledones en los granos suaves, aspecto que puede estar asociado al incremento de la dureza en ambos tejidos en la condición de alta temperatura y alta humedad relativa.

La microestructura de los granos cocidos se muestra en las Figuras 4 a la 6. En la ampliación x5000, de la Figura 4 se confirma lo observado en los granos crudos, en relación al aspecto de la matriz proteica, la cual es de apariencia lisa en los granos endurecidos (almacenados a ATAH) y rugosa o con múltiples relieves en los granos blandos (almacenados a BTBH). La pérdida del aspecto granular de la matriz proteica en los granos duros ha sido relacionada con una desnaturalización parcial de la misma (1). Esto, hace que prevalezca su coagulación sobre la gelatinización de los gránulos del almidón durante la cocción, lo que le permite actuar como una barrera física que impide la absorción de agua por los gránulos de almidón. Todo lo cual conduce a un aumento de la dureza de los granos y aporta evidencias a la hipótesis basada en los cambios de las proteínas de almacenamiento para explicar este endurecimiento.

En la ampliación x1000 se observa una célula de los cotiledones de los granos blandos separada de las células adyacentes, mientras que en los granos duros se puede notar una célula que aún se encuentra unida a las células vecinas luego de la cocción. Diversos autores afirman que la separación celular durante la cocción se debe al rompimiento o desintegración de la laminilla media y que esto a su vez se traduce en ablandamiento del tejido (12). A través de estudios de microscopia electrónica de barrido, se ha encontrado que las paredes celulares primarias y secundarias de granos duros y blandos responden en forma similar frente a la cocción, a diferencia de la laminilla media que se degrada en los granos blandos pero permanece intacta en los granos duros (9). De manera que la hipótesis que cobra más fuerza para explicar el mecanismo de endurecimiento de los granos de P. vulgaris es la que apoya la existencia de un mecanismo múltiple y complejo que abarca diversas estructuras y compuestos del grano, tales como la matriz proteica, los gránulos de almidón y la laminilla media de las células de los cotiledones, así como las capas de la testa.
En las imágenes con ampliaciones de x550 y x300 (Figura 5) se comprueba una total separación entre las células de los cotiledones de los granos suaves y una muy limitada separación en los granos duros.

Adicionalmente, se observan restos de una capa desintegrada en la superficie de las células de los granos blandos, mientras que en los duros la superficie es lisa y compacta. Los espacios vacios son notorios en los granos blandos producto de la elevada disgregación del parénquima de los cotiledones. En este sentido, en otros estudios de microscopia electrónica de barrido se ha observado un empaquetamiento denso de las células de los cotiledones, con una mínima separación, en granos duros, luego de someterlos a cocción (13).
Con respecto a las diferencias en la microestructura de la testa, observadas en la Figura 6, se tiene que en los granos duros cocidos las células de la empalizada mantuvieron un aspecto similar al que presentaron en los granos duros crudos. Esto, puede significar que este tejido resistió los cambios propiciados por el remojo y la cocción. Por el contrario, en los granos blandos se observaron deformaciones en la capa empalizada que denotan flexibilidad o suavidad y una reducción en la altura de las células de esa capa. Mientras, la capa subepidérmica aumentó su espesor posiblemente por un efecto de hinchamiento causado por el agua absorbida durante el remojo y la cocción. Por otra parte, en la ampliación x100, al igual que en los granos crudos, se observó una completa separación de la testa y de los cotiledones en los granos duros, mientras que en los granos blandos permanecieron unidos.

Las observaciones realizadas en esta investigación acerca de la microestructura de los granos suaves y duros permiten afirmar que el “Hard to Cook” es un defecto de textura que involucra cambios tanto en los cotiledones como en la testa de los granos, lo que conlleva a apoyar la hipótesis de mecanismo múltiple planteada por algunos autores, según la cual participa más de un tipo de tejido y más de una clase de reacción bioquímica (14, 15).
La mayor compactación de las paredes entre células contiguas de los cotiledones en los granos duros (Figura 1) puede relacionarse con un mayor grado de entrecruzamiento en las mismas, propiciado por la formación de puentes de calcio entre las moléculas de pectina, y/o por incremento de puentes fenólicos entre las moléculas de lignina y entre polisacáridos de la pared celular. Todo lo cual conlleva a aumento de la rigidez del tejido y por lo tanto a un incremento de la resistencia al blandamiento durante la cocción.
Las diferencias en la textura de la matriz proteica de las células de los cotiledones observadas en la Figura 2, concuerdan con la hipótesis que se fundamenta en los cambios de la matriz proteica como mecanismo de endurecimiento de los granos, planteada por algunos investigadores (1, 16). Puesto que la textura lisa de esta matriz en los granos duros puede estar relacionada a la desnaturalización de la proteína y por tanto a la prevalencia de su coagulación frente a la gelatinización de los gránulos de almidón, afectando así el grado de ablandamiento de los granos durante la cocción.
A la luz de este mecanismo, la calidad de cocción de los granos depende parcialmente de la secuencia de coagulación de las proteínas intracelulares y del hinchamiento de los gránulos de almidón durante la cocción. Sí la coagulación de la proteína prevalece, esta actuará como una barrera física que restringirá el paso del agua hacia los gránulos de almidón, lo que resultará en un limitado hinchamiento de estos y en granos cocidos más duros. Sí el hinchamiento del almidón predomina, la coagulación de la proteína no podrá evitar la completa gelatinización del almidón y los granos cocidos resultaran suaves (1, 16).
En los granos recién cosechados, o en los almacenados a baja temperatura y baja humedad relativa, las proteínas son muy solubles en agua y estables térmicamente. Durante la cocción, las proteínas no coagulan fácilmente antes de la gelatinización del almidón, de forma que los gránulos de almidón absorben agua libremente a través de la matriz proteica. En granos endurecidos este proceso ocurre de una forma distinta, las proteínas se desnaturalizan lentamente durante el almacenamiento en condiciones adversas y la mayor parte se hace insoluble en agua. El resto, que es soluble, coagula fácilmente a temperaturas inferiores a la de gelatinización del almidón debido a su baja estabilidad térmica (1, 16). En este orden de ideas, el grado y la velocidad de hidratación de la matriz almidón/proteína influyen en la velocidad de cocción y en la textura final de los granos cocidos (17).
En relación a lo observado en la testa de los granos crudos (Figura 3), se tiene que la compactación de las capas empalizada y sub-epidérmica de los granos endurecidos coincide con lo encontrado en otras investigaciones, donde se ha reportado una disminución significativa del espesor de la testa en leguminosas como caraota (Phaseolus vulgaris), haba (Vicia faba) y lenteja (Lens culinaris) (18, 19, 20). Concluyendo estos estudios que la facilidad de cocción de los granos está relacionada con la microestructura de la testa.
El análisis de la microestructura de los granos cocidos suaves y duros (Figura 4) confirma lo encontrado en los granos crudos en relación al aspecto de la matriz proteica, la cual presentó textura lisa en los granos duros, y rugosa o granular en los granos suaves. Esto, aporta así evidencia de un posible predominio de la coagulación de la proteína sobre la gelatinización del almidón durante la cocción, como parte del mecanismo de endurecimiento de los granos. Asimismo, se comprobó que los cotiledones de los granos duros presentaron fallas en la separación celular durante la cocción (Figuras 4 y 5), condición necesaria para el ablandamiento de los granos. La composición de la laminilla media de la pared celular ha sido estrechamente relacionada con este hecho, siendo su componente principal los polisacáridos pécticos. Específicamente, el ablandamiento de los granos durante la cocción ha sido generalmente atribuido a la degradación β-eliminativa de los ácidos poligalacturónicos metilesterificados contenidos en la laminilla media, la cual implica el rompimiento de los enlaces glucosídicos bajo condiciones no acídicas (11, 21, 22, 23).
Las diferencias en el aspecto de las paredes celulares de los cotiledones y de las capas de la empalizada y subepidérmica de la testa, de los granos duros y blandos, demostraron una participación importante de ambos tejidos en el endurecimiento de los granos generado en condiciones de alta temperatura y alta humedad relativa.
Al Consejo de Desarrollo Científico, Humanístico y Tecnológico (CDCHT) de la Universidad Centroccidental Lisandro Alvarado (UCLA) por el financiamiento de esta investigación. Al Laboratorio de Microscopia Electrónica de la Universidad Simón Bolívar, en especial al Lic. Gleen Rodríguez por el apoyo suministrado en la ejecución de los análisis microscópicos. A la Prof. María Soledad Tapia y a la TSU Bernardette Da Fonte del Instituto de Ciencia y Tecnología de Alimentos de la Universidad Central de Venezuela, por facilitarnos el uso del texturómetro.
Recibido: 24-10-2014
Aceptado: 30-01-2015