La composición química, minerales, azúcares neutros, compuestos fenólicos y capacidad antioxidante fueron analizados en la cascarilla de garbanzo. La cascarilla de garbanzo presentó 72% de fibra dietaria, del cual el 24.4% fue celulosa. Los compuestos fenólicos y actividad antioxidante de de la cascarilla de garbanzo fueron evidentes, predominando los taninos condensados totales con 13.28 mgEC/g, donde la fracción soluble fue mayor respecto a la fracción ligada. El contenido de proteína y grasa fue de 4.5 y 0.4%. En conclusión, la cascarilla de garbanzo tiene propiedades nutricionales y funcionales que pueden ser consideradas en el diseño de nuevos productos alimenticios para mejorar la salud de los consumidores.
Palabras clave: Composición química, fibra dietaria, azúcares neutros, compuestos fenólicos, actividad antioxidante, Cicer arietinum.
The chemical composition, minerals, neutral sugars, phenolic compounds and antioxidant capacity were analyzed in the chickpea husk. Chickpea husk presented 72% of dietary fiber of which 24.4% was cellulose. The content of phenolic compounds and antioxidant capacity of chickpea husk was evident, predominating condensed tannins with a total content of 13.28 mgECat/g, of which soluble fraction was the higher than bound fraction. The content of protein and fat was 4.5 and 0.4 %, respectively. In conclusion, chickpea husk has nutritional and functional properties that can be considered in the design of new food products to improve the health of consumers
Key words: Chemical composition, dietary fiber, neutral sugars, phenolic compounds, antioxidant capacity, Cicer arietinum.
Universidad Autónoma de Nuevo León, Facultad de Agronomía, Nuevo León, México.
Centro de Investigación en Alimentación y Desarrollo (CIAD), Culiacán, Sinaloa, México.
Universidad Autónoma de Nuevo León, Facultad de Salud Pública y Nutrición. Monterrey, Nuevo León, México.
El consumo de leguminosas es importante, sus granos o semillas tienen más proteínas que los cereales, alto porcentaje fibra dietaria, minerales y almidón (1); además poseen efectos fisiológicos benéficos en la prevención de la diabetes, problemas de obesidad, enfermedades cardiovasculares y cáncer de colon (2). La cascarilla, pericarpio o cubierta de las leguminosas normalmente son destinadas como alimento para ganado después del procesamiento del grano. Son un material de desecho de algunas industrias alimentarias como la aceitera y harinera, representan un subproducto del 20% del total de la leguminosa procesada (3). Este tipo de industrias generan residuos con potencial antioxidante, antimicrobiano, así como compuestos bioactivos, tal es el caso de la cascarilla de garbanzo. Además de ser un subproducto de bajo costo, la cascarilla de garbanzo posee un alto contenido de fibra dietaria y polifenoles. La fibra dietaria, se constituye de celulosa, hemicelulosa, pectina, lignina, gomas y su consumo trae consigo beneficios al organismo humano como la disminución del colesterol, lipoproteínas de baja densidad (LDL), problemas del tracto digestivo e incidencia de cáncer de colon (4). Por su parte, los compuestos fenólicos son metabolitos secundarios esenciales para el desarrollo y crecimiento de las plantas, usados como mecanismo de defensa. Los polifenoles (flavonoides, taninos, ácidos fenólicos) desde el punto vista nutricional tienen un alto impacto por su actividad antioxidante (5). Los antioxidantes reducen el estrés oxidativo y participan en la prevención de enfermedades degenerativas como el cáncer y padecimientos cardiovasculares, poseen propiedades antiinflamatorias, y su efectividad depende de la cantidad consumida y su biodisponibilidad (6). El objetivo de este estudio fue evaluar la composición química, minerales, azúcares neutros, compuestos fenólicos y capacidad antioxidante de la cascarilla de garbanzo.
Grano de garbanzo tipo Kabuli Variedad ʽJumboʼ de coloración crema fue donado por la Unión Nacional de Productores y Exportadores de Garbanzo (UNPEG, Culiacán, Sinaloa, México). Dos muestras de 6.25 kg con dos replicas (n=4) se utilizaron para la caracterización. El grano fue humedecido en agua a 40°C durante 2 h, posteriormente la cascarilla del grano fue separada manualmente y secada durante la noche a 45°C. Finalmente, la cascarilla fue molida y tamizada a tamaño de partícula de 420 μm (malla 40), obteniendo un rendimiento de 3.5 %.
El análisis proximal y de minerales fue realizado de acuerdo a las metodologías oficiales de la AOAC (7): humedad (método 925.09), grasa (Soxhlet, método 923.03), fibra cruda (método 920.86), proteínas (micro-Kjeldahl, método 960.52) y cenizas (método 923.03); el contenido de carbohidratos fue estimado por diferencia y los carbohidratos totales fueron obtenidos por diferencia más el contenido de fibra cruda. El contenido de fibra dietaria total (FDT) fue determinado basado en el método 985.29, utilizando el kit de fibra dietaria Megazyme®. En la determinación de minerales (método 955.06), las muestras fueron sometidas a una digestión ácida (HCl) y posteriormente se determinó el contenido de minerales en un espectrómetro de absorción atómica SpectrAA-220 (Varian). Los elementos de K y Na se analizaron por emisión de flama a 589.6 y 769.9 nm, respetivamente. El contenido de Ca, Mg, Zn, Cu, Fe, Mn se determinó por absorción atómica a 422.7, 285.2, 213.9, 324.7, 248.3 y 279.5 nm, respectivamente.
La determinación de AN fueron realizados por cromatografía de gases; 3 mg de cascarilla fueron tratados con 500 μL de ácido trifluoroacético 2N durante 1 h a 120°C, utilizando 200 μg de mio-inositol como estándar interno. Enseguida la muestra fue centrifugada, el sobrenadante recuperado, tratado con 150 μL de NaBH4 (20 mg/mL en NH4OH 1N) y posteriormente fue llevada a cabo la acetilación con 200 μL de anhídrido acético y 20 μL de 1-metilimidazol como catalizador; 2 mL de agua y 3 mL de cloroformo fueron agregados al material derivatizado y la fase clorofórmica fue recuperada y evaporada, así los acetatos de alditol fueron resuspendidos en acetona para su inyección en un cromatógrafo de gases Varian CP-3800 con detector FID (250°C), con columna capilar DB-23 de 30 m x 0.25 mm (210°C) y helio como gas acarreador a flujo constante de 3 mL/min. La integración de áreas fue hecho con el software MS Workstation versión 6.5 (SP1) (Varian Inc.), y los cálculos fueron realizados a partir de curvas estándares de ramnosa, fucosa, arabinosa, xilosa, manosa, galactosa y glucosa.
El pellet resultante del análisis de azúcares neutros se hidrolizó durante 5 h con H2SO4 concentrado y el contenido de azúcares totales se determinó por el método de antrona propuesto por Yemm y Willis (8); 100 μL del extracto se tomaron, adicionándoles 400 μL de agua destilada y 1000 μL de antrona al 0.2% en H2SO4 concentrado, se calentó en baño húmedo a 80°C por 10 min, posteriormente se enfrió en hielo y finalmente se tomó la lectura de las muestras a 620 nm en un espectrofotómetro Cary 60 UV-Vis (Agilent Technologies). La determinación del contenido de celulosa se basó en una curva de calibración con glucosa y los resultados se expresaron en porcentaje.
La extracción de fenólicos libres y ligados fue realizada de acuerdo al método de Urías-Orona et al. (9) con modificaciones. En la extracción de fenólicos libres se tomaron 100 mg de cascarilla de garbanzo y fueron suspendidos en 5 mL de metanol al 80%, enseguida la muestra fue tratada con flujo de argón durante 30 s y agitada a 200 rpm por 2 h. La muestra fue centrifugada a 4650 g, el sobrenadante fue recuperado y almacenado a -20°C hasta su análisis para fenólicos y capacidad antioxidante. En la extracción de fenólicos ligados, el pellet recuperado de la obtención de fenólicos libres fue tratado con 5 mL de NaOH 2M, flujo de argón por 30 s y agitado a 200 rpm por 4 h. Enseguida, el pH fue ajustado a 2.5 con HCl concentrado y centrifugado a 4650 g. El sobrenadante fue recuperado y se agregaron 5 mL de acetato de etilo en dos ocasiones. Los extractos de acetato de etilo fueron combinados y evaporados a 40°C con flujo de argón y almacenados a -20 °C. Al momento del análisis el extracto fue resuspendido en 3 mL de metanol al 80%.
Los ensayos de compuestos fenólicos y capacidad antioxidante fueron realizados de acuerdo a López-Contreras et al. (10). La determinación del contenido de fenoles totales (FN) fue llevada a cabo utilizando el reactivo Folin-Ciocalteu, usando ácido clorogénico como estándar (0 a 200 mg/L) y el resultado fue expresado como miligramos equivalentes de ácido clorogénico por gramo de muestra (mgEAC/g). El contenido de flavonoides totales (FL) fue determinado con base al ensayo del cloruro de aluminio utilizando catequina como estándar (0 a 200 mg/L), y el resultado fue expresado como miligramos equivalentes de catequina por gramo de muestra (mgECat/g). El contenido de taninos condensados (TC) fue determinado con base en la prueba vainillina-HCl utilizando catequina como estándar (0 a 200 mg/L) y el resultado fue expresado como miligramos equivalentes de catequina por gramo de muestra (mgECat/g). La capacidad antioxidante fue evaluada con base en la reducción de absorbancia de los radicales 2,2-Difenyl-1-picrylhydrazilo (DPPH) y ácido 2,2-azino-bis(3-etilbenzotiazolin)-6-sulfónico (ABTS), utilizando Trolox como estándar (0 a 800 μmol/g) y expresados como micromoles equivalentes de Trolox por gramo de muestra (μmolET/g).
Los datos fueron expresados como media ± desviación estándar (yi = μ ± εi, n=4), obtenidos de los resultados de la estadística descriptiva para cada variable evaluada; el software Minitab14.0 (Minitab, 2004) fue usado para estas determinaciones.
El contenido de humedad, cenizas, proteínas, grasa, carbohidratos, minerales y azúcares neutros se muestra en la Tabla 1. Los carbohidratos representaron el mayor contenido en la cascarilla de garbanzo, seguidos por proteína, humedad, cenizas y grasas. El contenido de fibra dietaria total fue de 78.8% siendo el principal componente polisacáridos no celulósicos (54.4%) seguido por la celulosa (24.4%).

El contenido de minerales encontrado en el presente estudio mostró en mayor proporción fue Ca, seguido por K y Mg (Tabla 2) con niveles de 9316, 7699 y 2799 ppm, respectivamente, mientras que Fe y Zn minerales esenciales en la nutrición humana con se encontraron en concentraciones de 83 y 29 ppm, respectivamente.
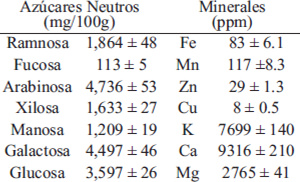
La Tabla 2 muestra la composición de azúcares neutros en la cascarilla de garbanzo, siendo los mayoritarios arabinosa (26.83%), galactosa (25.48%) y glucosa (20.38%), seguidos por ramnosa (10.56%), xilosa (9.25%) y manosa (6.85%), mientras que el azúcar de menor concentración fue fucosa (0.64%).
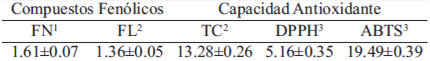
En la Tabla 3, se observa el contenido de compuestos fenólicos de la cascarilla de garbanzo. En fenoles totales las fracción libre presentó 1.50 mgEAC/g, mientras que el contenido de la fracción ligada fue de 0.11 mgEAC/g. En flavonoides totales el contenido de la fracción ligada y libre fue con 0.94 y 0.42 mgECat/g, respectivamente. En el contenido de taninos condensados la fracción libre y ligada arrojaron valores de 7.38 y 5.90 mgEAC/g, por lo que predomina la presencia de este grupo fenólico en la cascarilla de garbanzo. En cuanto a la capacidad antioxidante, la cascarilla de garbanzo presentó niveles de 2.81 y 2.35 μmolET/g en la fracción libre y ligada, respectivamente en el método DPPH, mientras que por el método ABTS la capacidad antioxidante fue mayor, observando que la fracción libre fue mayor a la ligada con 12.97 y 6.52 μmolET/g, respectivamente.
Bose y Shams-Ud-Din (11) reportaron para cascarilla de garbanzo Bengal-gram un contenido de 5.25 de proteína, 4.79 grasa y 4.79 ceniza (g/100g), donde la ceniza mostró una diferencia de 3.49 g con respecto a la obtenida en este estudio. La fibra dietaria total es uno de los componentes más importantes en las leguminosas y se clasifica en fracciones soluble e insoluble, incluyendo la primera gomas, mucilagos, pectinas y algunas hemicelulosas, mientras que la segunda se compone de celulosa, lignina, y el resto de las hemicelulosas son parte de la fracción insoluble. Khan et al. (12) reportaron contenidos de 22% de fibra dietaria total, 6.5% de celulosa y 2.7% de pectina para grano de garbanzo sin cascarilla, observándose una gran diferencia con el presente estudio, ya que la cascarilla del grano se constituye principalmente de estos componentes. Bose y Shams-Ud-Din (11) utilizaron cascarilla de garbanzo a diferentes concentraciones en la formulación de galletas tipo cracker biscuits y observaron un incremento del 2.58% en el contenido de fibra cruda. Los carbohidratos son una fuente nutritiva importante y son clasificados en monosacáridos, oligosacáridos y polisacáridos; Wood y Grusak (13) reportaron un contenido de carbohidratos en grano entero de garbanzo tipo Desi de 51-65%, mientras que para el tipo Kabuli el 54-71%.
Las leguminosas son una fuente importante de minerales indispensables para el organismo humano, dentro de los principales en la nutrición humana están el Ca, Fe y Zn. Sandberg (14) evaluó el contenido de minerales en grano entero de garbanzo y reportó valores de 69, 35, 1240, y 1550 ppm para Fe, Zn, Ca y Mg, respectivamente, siendo los niveles de Fe y Zn cercanos a lo encontrado en el presente estudio, sin embargo sus niveles de Ca y Zn son inferiores a nuestros resultados. La biodisponibilidad de minerales en leguminosas está relacionado con el contenido de ácido fítico ya que este tiene un efecto negativo en su absorción. En este sentido, Wang et al. (15) reportó para garbanzo tipo Kabuli un contenido de 9.6 g/kg de ácido fítico el cual fue menor al compararlo con seis variedades de frijol con 12.2 g/kg en promedio, lo que sugiere que el garbanzo tiene mayor biodisponibilidad de minerales que el frijol, siendo este último la leguminosa la de mayor consumo en México.
Así mismo, en las leguminosas están presentes azúcares digeribles e indigeribles; en el grano entero de garbanzo han sido reportados azúcares libres (monosacáridos) como glucosa y galactosa en niveles de 700 y 50 mg/100g, respectivamente (16). En la determinación de los monosacáridos cuantificados para la cascarilla de garbanzo, arabinosa y galactosa se encuentran como componentes mayoritarios, lo que indica la presencia de arabinogalactanos y ramnogalacturonanos los cuales son componentes de las pectinas (17).
Los compuestos fenólicos ligados se encuentran interaccionando con las hemicelulosas presentes en la fibra dietaria mediante un enlace tipo éster, lo cual explica su mayor contenido en las fracciones ligadas sometidas a condiciones de alcalinidad durante su extracción, ya que bajo estas condiciones se lleva a cabo la ruptura de este enlace (18). Segev et al. (19) reportaron en cascarilla de garbanzo tipo Kabuli un contenido de fenoles totales entre 0.2-1.1 mgECat/g, mientras que Kanatt et al. (3) reportaron en cascarilla de garbanzo Bengal gram, fenoles y flavonoides totales un contenido de 70 y 10 mgECat/g respetivamente; la diferencia observada con estos autores se debe al método de extracción empleado, así como a las características propias del grano, principalmente el color de la cascarilla. Diversos estudios han empleado diferentes técnicas como el descascarillado del grano, germinado, remojo y molienda con la finalidad de disminuir el tiempo de cocción, mejorar el sabor, la biodisponibilidad de minerales, proteínas y otros nutrientes, sin embargo cabe resaltar que esta acción afecta considerablemente la pérdida de los compuestos fenólicos presentes en este material vegetal (20). Los taninos son un grupo de polifenoles solubles en agua, forman complejos con polisacáridos y proteínas. Éstos se clasifican en taninos hidrolizables y taninos condesados (21). Han y Baik (22) reportaron para el grano de garbanzo una actividad antioxidante por ABTS en la fracción libre y ligada de 1.5 y 0.5 μmolET/g, respectivamente, los cuales están por debajo a lo obtenido en este estudio, con una diferencia del 11.47 y 6.02 μmolET/g. Ziu-Ul-Haq et al. (23) reportaron para garbanzo tipo Desi un contenido de fenoles totales, flavonoides totales y taninos condensados de 0.92-1.12, 0.79-0.99 y 0.58-0.69 mg/g, respectivamente, que fueron más bajos a lo reportado en este estudio, aun que la actividad antioxidante por DPPH y ABTS reportada por estos autores fue de 1.05-1.24 y 37.24-45.32 μmolTE/g, donde este último fue mayor a los obtenidos en este estudio.
La cascarilla de garbanzo tiene contenido de proteína considerable, un alto contenido de fibra dietaria total, además presenta contenidos elevados contenidos de Ca, K y Mg, así como de los azúcares arabinosa, galactosa, glucosa. Finalmente, también presenta contenidos elevados de compuestos fenólicos y altos niveles de capacidad antioxidante. Por estas características, la cascarilla de garbanzo puede considerarse con un buen valor nutritivo y funcional apto para mejorar la salud de los consumidores. También es posible considerar la cascarilla del garbanzo como una alternativa para potencializar la funcionalidad de otros alimentos.
Al Programa de Apoyo a la Investigación Científica y Tecnológica (PAICYT) 2015 de la Universidad Autónoma de Nuevo León por el financiamiento otorgado. A Rosabel Vélez de la Rocha y Werner Rubio Carrasco, por la asistencia técnica brindada.
Recibido: 26-07-2016
Aceptado: 09-10-2016