La Moringa oleifera es un árbol originario de determinadas regiones Asia y África, con capacidad de adaptación a territorios de climas calurosos y pluviometrías escasas. Las diferentes estructuras de la planta (hoja, raíz, corteza, flores, vainas…) se consumen como terapéutico para diferentes dolencias. Estas estructuras posee un elevado poder nutritivo (vitaminas, minerales o aminoácidos esenciales entre otros) que le otorgan un importante papel potencial en la prevención y lucha de la desnutrición. La literatura científica recoge numerosos efectos saludables de las diferentes partes de la moringa tales como efecto antioxidante y antiinflamatorio o bactericida entre otros. Con el objetivo de hacer llegar las propiedades de la moringa al consumidor se están desarrollando estudios con diferentes alimentos, principalmente productos cárnicos y panes, en los que se incorpora la moringa (hoja, semilla, extractos, etc.) como ingrediente. En los productos cárnicos se utiliza como aditivo conservante y antioxidante con muy buenos resultados sin afectar las características sensoriales del producto final. En el sector de la panadería el objetivo suele ser el enriquecimiento nutricional del alimento. En estos casos las características sensoriales son más variables dependiendo de la dosis utilizada y el producto en estudio (pan, galletas, etc.). La industria alimentaria tiene un interesante reto por delante: la incorporación de la moringa como ingrediente, sustituyendo diferentes conservantes y antioxidantes químicos por otros naturales y al mismo tiempo la preparación de productos básicos, como el pan, altamente nutritivos, ideales para determinados grupos poblacionales en mayor riesgo de desnutrición.
Palabras clave: Moringa oleifera, antioxidante, alimentos, productos cárnicos, pan
Moringa oleifera is a tree native to certain regions Asia and Africa, adaptable to territories of hot weather and low precipitation rates. In some areas different parts of the tree (leaves, roots, bark, flowers, pods...) are consumed as a therapeutic for different illnesses. These structures have also a high nutritional value (vitamins, minerals and essential amino acids among others) giving an important potential role in the prevention of malnutrition. The scientific literature describes many salutary effects of the different parts of the moringa such as an antioxidant and anti-inflammatory or bactericide, among others. With the aim of bringing the properties of moringa to consumers, a few studies have been developed with different foods, mainly meat and bread, in which the moringa is incorporated as an ingredient (leaf, seed, extracts, etc). In meat products it is used as a preservative and antioxidant additive with very good results without affecting the sensory characteristics of the final product. In the field of bakery the objective is usually as nutritional fortification. In these cases the sensory characteristics are variable depending on the dose used and the product under study (bread, cookies, etc). The food industry has an interesting challenge ahead: the incorporation of moringa as a natural ingredient, as a substituting different classical preservatives and antioxidant and at the same time preparing food commodities, such as bread, with high nutritional value, ideal for certain population groups in risk of malnutrition.
Key words: Moringa oleifera, antioxidant, food, meat products, bread
Universidad de Murcia, España. Universidad de Córdoba, Colombia.
La Moringa oleifera es un árbol caducifolio, de crecimiento rápido, con raíces tuberosas y gruesas, hoja verde claro, de floración abundante, con frutos en cápsulas alargadas y colgantes y que contienen semillas oscuras. Se asocia a zonas tropicales y subtropicales, bastante resistente a la sequía, con una temperatura de crecimiento ideal de 25-35ºC, aunque puede tolerar hasta los 48ºC (1).
Recibe diferentes nombres, tales como Drumstick tree, Horse Radish tree o Ben oil tree (2). Es originario de la India, Pakistán, Asia Menor, Arabia y África pero se ha extendido hacia otras regiones como Filipinas, todo el continente americano y Caribe (3). En muchas de estas zonas el consumo de la moringa (hojas, frutos, vaina, flores o raíz) está arraigado en la cultura popular debido a las propiedades curativas que se le atribuyen para el tratamiento de diferentes afecciones, por lo que también se la denomina “árbol milagro” y se utiliza habitualmente como remedio natural para gran diversidad de afecciones como las fiebres de la malaria o fiebres tifoideas, otitis, infecciones oculares, hiperglucemia, hipertensión, parasitosis intestinales, anemias o dermatitis entre otras. En Nigeria la forma más habitual de consumo es de hojas troceadas en sopa, en infusión, en ensalada, como especia o consumidas crudas como tentempié (4).
Los motivos para esta gran variedad de funciones pueden ser debido a su alto poder nutritivo. Se describe que “onza por onza, las hojas de moringa contienen más vitamina A que las zanahorias, más calcio que la leche, más hierro que las espinacas, más vitamina C que las naranjas, y más potasio que los plátanos” (5). Por otro lado la comunidad científica describe en los últimos años el mecanismo de acción en muchas de estas propiedades curativas, en multitud de estudios con diferentes partes de la estructura de la moringa y con diferentes diseños metodológicos, tanto in vivo como in vitro (3, 6). En ellos se describe los efectos potenciales para la salud de las diferentes partes del árbol, actividad antihipertensiva, diurética, hipocolesterolemiante, antiulcerosa, hepatoprotectora, antitumoral, antibacteriana y antifúngica entre otras, así como propiedades de purificación de aguas.
Stohs y Hartman (2) recopilan los trabajos realizados en torno a la seguridad alimentaria respecto al consumo de diferentes partes del árbol o sus extractos, posibles efectos tóxicos y eficacia con estudios en humanos, en animales de laboratorio y en cultivos celulares, concluyendo con la existencia de un amplio margen de seguridad.
La finalidad de este trabajo es recopilar los trabajos más actuales en aquellas facetas más importantes de la moringa y su uso como ingrediente alimentario, donde se estudian las propiedades sobre el alimento y las repercusiones sobre la calidad sensorial de los alimentos diseñados.
En los últimos años han proliferado los estudios relativos a las distintas actividades de los compuestos presentes en diferentes partes de la Moringa oleifera. La Tabla 1 recoge los estudios más recientes que demuestran las actividades biológicas de los compuestos de la moringa en el organismo.
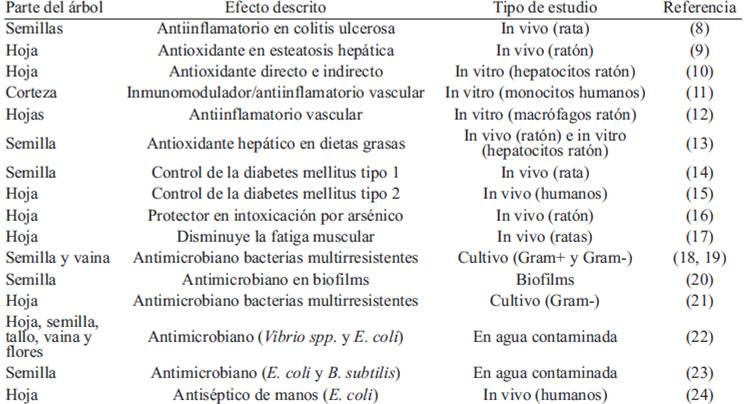
Los efectos antiinflamatorios se deben principlamente a la gran cantidad de flavonoides presentes en la hoja de moringa, donde se han descrito hasta doce compuestos distintos, derivados de la quercitina y kaempferol (7).
Minaiyan et al (8) investigaron la actividad antiinflamatoria del extracto semillas de moringa en el tratamiento de colitis ulcerosa inducida. Los autores determinaron el grado de las lesiones mediante análisis macroscópico valorando el aspecto visual, peso del colon distal y la extensión de las úlceras. También estudiaron el daño microscópico determinando la severidad y extensión de la inflamación y el daño de las criptas. El estudio se llevó a cabo con 54 ratas Wistar macho de entre 180-260 g de peso divididas en nueve grupos. Al grupo 1 (referencia) se le suministró suero salino (1ml/kg) de tratamiento placebo y no recibió inducción de colitis. Al grupo 2 (control) se le indujo la colitis (2ml de solución de acético 4% vía intracolónica) y se le suministro solución salina de tratamiento. El grupo 3 (de referencia) recibió la inducción y tratamiento farmacológico (prednisolona). Los grupos 4, 5 y 6 recibieron inducción y tratamiento con fracción hidroalcohólica del extracto de semilla de moringa a concentraciones de 50, 100 y 200 mg/kg respectivamente. Los grupos 7, 8 y 9 recibieron la inducción y el tratamiento con la fracción cloroformo del extracto a las dosis de 50, 100 y 200 mg/kg respectivamente. El tiempo de ensayo fue de cinco días. Tras el análisis de los resultados los investigadores observaron que el extracto hidroalcohólico fue el tratamiento más eficaz mostrando diferencias estadísticamente significativas (p<0.01) en los parámetros indicadores de inflamación de los grupos tratados con el extracto a 100 y 200 mg/kg respecto al grupo control. Los autores concluyen que el extracto de semilla de moringa reduce los índices de las lesiones tanto a nivel macroscópico como microscópico, mostrándose como un antiinflamatorio eficaz en el tratamiento de la colitis ulcerosa.
Das et al (9) evaluaron la actividad antioxidante del extracto etanol de hoja de moringa en el tratamiento de la esteatosis hepática no alcohólica inducida mediante dieta rica en grasa. El extracto se obtuvo a concentración de 5 mg/l y se establecieron cinco grupos de ensayo (seis ratones albino suizo macho de 20 g aprox. por grupo) combinando dieta normal y dieta grasa, con y sin suplementos del extracto y diferenciando el posible efecto terapéutico o preventivo, con una duración del ensayo de 15 días. El grupo 1 (control) recibió un dieta estándar, grupo 2 recibió dieta estándar y suplemento de 150 mg/kg del extracto vía esofágica, grupo 3 con dieta grasa, grupo 4 con dieta grasa durante 15 días y tratamiento con extracto los últimos cinco días (se evalúa el efecto terapéutico), y grupo 5 con dieta grasa y extracto simultáneamente durante 15 días (evalúa el efecto preventivo). Los indicadores para medir la alteración hepática fueron el análisis histológico y los niveles séricos de enzimas hepáticas. Los resultados mostraron una disminución de los marcadores de daño hepático y de los signos histológicos en los grupos 4 y 5 (tratamiento terapéutico y preventivo) respecto al grupo 3 (dieta grasa), en ambos casos con diferencias estadísticamente significativas (p<0.05). En base a estos resultados los autores concluyen que el extracto de hoja de moringa tiene efecto preventivo y terapéutico de la esteatosis hepática no alcohólica provocada por una dieta rica en grasas.
Tumer et al (10) estudiaron el mecanismo por el cual las hojas de moringa ejercen su función antioxidante. Se realizó un estudio in vitro con líneas celulares hepáticas Hepa 1c1c7 de ratón. El extracto de las hojas se separó en dos fases, una rica en polifenoles y otra en isotiocianatos. Para evaluar la acción antioxidante se diferenció entre una actividad indirecta (actividad de la NAD(P)H quinona oxidorreductasa1-NAQO1) y una actividad directa (capacidad de absorción de radicales de oxigeno-ORAC). Tras la adición del extracto y evaluación del mismo los autores observaron que la en fracción rica en polifenoles hubo una mayor actividad de la NAQO1 mientras que la fracción rica en isotiocianatos produjo mayor absorción de radicales de oxígeno. De esta manera los autores explican que la actividad antioxidante de la hoja de moringa y su potencial terapéutico se debe, en parte, a la doble forma de actuación descrita.
Vasanth et al (11) valoraron in vitro la actividad antiinflamatoria del extracto etanólico de la corteza del tronco de la moringa. Provocaron la inducción mediante exposición a lipopolisacáridos (LPS) de sustancias pro inflamatorias en líneas celulares humanas de monocitos THP-1. Se realizaron seis cultivos celulares: un control negativo sin exposición LPS (referencia), un control positivo con exposición a LPS (1.5 μg/ml durante 24h) y cuatro cultivos de ensayo con exposición a LPS (24h) y tratamiento con distintas concentraciones del extracto (31.25, 62.50, 125 y 250 μg/ml respectivamente durante 24h). Se determinó el grado de inflamación valorando la liberación de interleukina 1β (IL-1β) e interleukina 6 (IL-6) y de α-interferón (α-TNF). En todos los cultivos tratados con el extracto se observaron reducciones estadísticamente significativas (p<0.01) en las concentraciones de IL-1β, IL-6 y α-TNF. Estos resultados mostraron que el extracto de corteza de moringa puede ser útil en el tratamiento de las complicaciones vasculares asociadas a la inflamación.
Waterman et al (12), evidenciaron que, a nivel cromosómico, los isotiocianatos presentes en un concentrado de hojas frescas de moringa modulan la expresión génica para la liberación de sustancias pro inflamatorias. Los autores obtuvieron el extracto metanólico de las hojas de moringa, del cual separaron mediante un HPLC semipreparativa la fracción rica en isotiocianatos. Esta fracción se utilizó para valorar los cambios en la expresión de aquellos genes responsables de la síntesis de óxido nítrico sintetasa (iNOS), IL-1β, α-TNF e IL-6 en líneas celulares de macrófagos RAW. Estas líneas celulares fueron expuestas a diferentes concentraciones del concentrado de moringa (0, 5, 10, 50 y 100 μg/ml respectivamente) y 2 h después se indujo la respuesta inflamatoria mediante la exposición a LPS (1 μg/ml) durante 6 h. Se prepararon a su vez dos cultivos celulares, uno sin tratamiento ni exposición (control negativo) y otro con exposición y sin tratamiento (control positivo). Tras analizar los resultados de la expresión génica se observó, a la concentración de 100 μg/ml, una supresión casi total de los genes responsables de la síntesis de iNOS (p<0.001), IL-1β (p<0.05) e IL-6 (p<0.05) mientras que los genes responsables de la síntesis de α-TNF apenas se vieron afectados. Al mismo tiempo no se observó ningún sigo de citotoxicidad con ninguno de los ensayos realizados. De esta forma valoraron la pertinencia del concentrado de hojas de moringa como producto de uso alimentario para disminuir la inflamación vascular asociada a enfermedades crónicas.
Das et al (13), valoraron la capacidad del extracto de semilla de moringa (ESM) para neutralizar, in vivo, las especies reactivas del oxígeno (ERO), secundarias a una dieta rica en grasa, así como la posible protección (in vitro) que ejerce sobre los núcleos celulares y el ADN. Los autores realizaron el estudio con 26 ratones albino suizo macho y conformaron cuatro grupos, grupo 1 con dieta estándar (control negativo), grupo 2 con dieta grasa sin suplemento (control positivo), grupo 3 con dieta normal y ESM (150 mg/kg de peso vivo mediante sonda esofágica) y un grupo 4 con dieta grasa y ESM.
Los autores analizaron los siguientes indicadores: glutatión reducido (GSH), actividad superóxido dismutasa (SOD), actividad catalasa y actividad glutatión peroxidasa (GP). Los resultados mostraron en el grupo control positivo una disminución significativa de todos los indicadores respecto al grupo control negativo (p<0.05) lo que indicaba un agotamiento de los mecanismos antioxidantes del hígado frente a una dieta rica en grasa. Además, en el grupo con dieta grasa y suplemento de moringa, estos valores aumentaron significativamente (p<0.05) respecto al grupo control positivo, pasando los niveles de GSH de 0.38 a 1.42 μmol/mg de proteína, los de actividad de SOD de 0.78 a 2.14 U/mg de proteína, los de catalasa de 1.15 a 4.10 U/μg de proteína y los de GP de 0.74 a 1.81 U/ml de enzima/mg de proteína.
Los ensayos in vitro consistieron en el estudio del daño a los núcleos de los hepatocitos tras la generación de radicales hidroxilo. Se utilizaron tres tubos con tejido hepático a los cuales se les adicionó Fe-EDTA para H2O2 provocar la posterior reacción de Fenton con H2O2 y la consiguiente formación de radicales hidroxilo. Uno de los tubos se utilizó como control (sin adición de H2O2), a otro se le añadió H2O2 y al tercero se le añadió H2O2 y ESM simultáneamente. Tras analizar los hepatocitos mediante microscopio de fluorescencia los autores describen que en el primer tubo no hubo daño nuclear mientras en el tubo con H2O2 los radicales hidroxilo provocaron la ruptura de la membrana y liberación de ácidos nucleicos. En el tubo con H2O2 y ESM los núcleos se muestran sin daño o con daños visiblemente menores al caso anterior (cuantificación no realizada en el estudio), demostrando el efecto protector del ESM frente a los radicales hidroxilo. Se concluye la utilidad del ESM como protector frente a las especies reactivas del oxigeno que se origina de forma secundaria en las dietas ricas en grasa así como protector de los núcleos celulares frente a radicales hidroxilo en los hepatocitos.
Sulistyorini et al (14) realizaron un estudio para determinar el mecanismo de acción del extracto de hoja de Moringa oleifera en el tratamiento de la insulitis pancreática inducida mediante streptozocina y la expresión de insulina en el páncreas. Se realizó un ensayo in vivo con tres grupos de animales (ratas Sprague Dawley macho de 2-3 semanas de edad) con hiperglucemia inducida mediante streptozocina (40 mg/kg de peso). Uno de los grupos se mantuvo sin tratamiento con moringa (control), y otros dos grupos fueron tratados con extracto a dosis de 250 y 500 mg/kg/día respectivamente. Tras 21 días de ensayo se realizaron análisis histopatológicos de las muestras de páncreas, valorando en grado de infiltración de células inflamatorias y por otro lado la expresión de insulina pancreática. Los resultados obtenidos mostraron que en los dos grupos tratados con el extracto hubo una reducción significativa (p<0.05) en el grado de insulitis (medida cuantificando la infiltración de células inflamatorias mononucleares) pero sin diferencias entre ambos grupos tratados. Respecto a la expresión de insulina, se cuantificó la presencia de células β en los islotes de Langerhans mediante la escala 0-8 de Alfred, observando un incremento significativo (p<0.05) entre el grupo control (4.80) y los grupos tratados con 250 y 500 mg/kg (7.58 y 7.85 respectivamente) pero sin diferencias según el tratamiento. En base a estos datos los autores concluyeron que el extracto de hoja de moringa aumenta la expresión de insulina y disminuye la insulitis a nivel pancreático.
Pimjai et al. (15) desarrollaron otro estudio en humanos sanos a los que se les suministró vía oral dosis de 0, 1, 2 y 4 g de hoja de moringa en polvo encapsulado en cuatro ensayos separados por dos semanas y tras 12 horas de ayuno en cada uno. Tras la realización de los análisis los niveles de glucosa en sangre se mantuvieron sin diferencias significativas entre las distintas dosis (77, 78, 79 y 79 mg/dl, respectivamente) pero los niveles de insulina en sangre aumentaron en función de la dosis suministrada (2.3, 2.7, 3.3 y 4.1 μU/ml respectivamente), siendo la diferencia entre las dosis de 4 g y el resto resultaron estadísticamente significativas (p=0.03). Los autores concluyeron que dosis altas de polvo de hoja de moringa encapsulado (4 g) incrementa significativamente la secreción de insulina, resultando un tratamiento potencial de la diabetes mellitus tipo 2.
Se ha evaluado también la capacidad de la hoja de moringa para atenuar el daño a nivel cardiocirculatorio y hepático en ratones suizos albinos macho de cuatro semanas de edad frente a ingestas elevadas de arsénico (16). Se utilizaron 24 animales conformado cuatro grupos con seis animales cada uno: grupo 1 con dieta estándar (control negativo), grupo 2 con dieta suplementada en polvo de hoja de moringa en (50 mg/kg/día), grupo 3 con dieta con arsenito de sodio en el agua de bebida (control positivo) (10 mg/kg/día) y grupo 4 con dieta con arsenito de sodio y hoja de moringa (combinación de los dos anteriores). Tras las 16 semanas de duración del experimento se evidencia en el grupo control positivo frente al control negativo el aumento de triglicéridos (125.47 vs. 80.30 mg/dl) y glucosa (160.00 vs. 121.54 mg/dl) y la disminución de lipoproteínas HDL (40.81 vs. 54.16 mg/dl) al mismo tiempo que aumenta las enzimas ALP (120.16 vs. 137.10 UI/l) y AST (118.28 vs. 86.22 UI/l), todos ellos con diferencias estadísticamente significativas (p <0.05). Además, en el grupo 4 (arsenito y moringa) se observaron unos valores significativamente diferentes respecto al grupo 3 (arsenito) con niveles los niveles de triglicéridos en 85 mg/dl, HDL en 57.00 mg/dl, glucosa en 120.86 mg/dl, ALP en 123.98 UI/l y AST en 89.19 UI/l; todos muy similares a los del grupo control negativo. Este estudio demuestra la efectividad de la hoja de moringa en la reversión de los daños causados por la intoxicación por arsénico.
Lamou et al. (17) realizaron un estudio en el que suministraron un extracto acuoso de hoja de moringa a ratas Wistar macho de entre 130-132 g de peso para valorar posteriormente la fatiga muscular frente a un ejercicio continuado. Se realizaron cuatro grupos de estudio; el grupo 1 o grupo control, y los grupos de tratamiento 2, 3 y 4 a los que se les suministraron vía oral 100, 200 y 400 mg/kg, respectivamente, del extracto acuoso de hoja de moringa en una dosis única diaria durante 28 días. Los animales se sometieron a pruebas de resistencia de flotación con peso añadido y otras a resistencia sin peso. Los investigadores midieron el tiempo máximo de resistencia así como parámetros bioquímicos de sangre, músculo e hígado. Tras analizar los resultados los autores describen un tiempo mayor de resistencia al ejercicio forzado (p<0.05) en las ratas de los grupos tratados (135.75, 140.12 y 131.25 segundos respectivamente) con el extracto de moringa respecto a los del grupo control (89.75 segundos). Los análisis bioquímicos evidenciaron que, en los tres grupos tratados con extracto de hoja de moringa, se produjo, de manera significativa (p<0.05), una mayor acumulación de glucógeno en el tejido muscular siendo de 2.06, 2.76 y 2.68 mg/g frente a 1.19 mg/g del grupo control. En el tejido hepático ocurrió lo mismo siendo de 21.57, 22.69 y 22.64 mg/g frente a 17.68 mg/g del grupo control. Tras el ejercicio también hubo diferencias significativas entre los grupos tratados y el grupo control en los niveles sanguíneos de lactato (24.14, 19.37 y 18.87 mmol/l vs. 31.27 mmol/l), glucosa (145.01, 147.4 y 163.9 mg/dl vs. 119.9 mg/dl), urea (26.78, 26.41 y 28.21 mg/dl vs. 45.03 mg/dl) y triglicéridos (75.05, 125.28 y 58.42 mg/dl vs. 176.77 mg/dl). De esta manera los autores concluyen que el extracto acuoso de hoja de moringa tiene propiedades anti fatiga frente al ejercicio físico facilitando la movilización de los depósitos de grasa del organismo, retardando el agotamiento de las reservas de glucógeno y disminuyendo la acumulación de lactato y urea en sangre.
Diversos estudios in vitro demuestran la actividad antimicrobiana de los biocomponentes de la cubierta de la semilla y de la vaina de la moringa inhibiendo el crecimiento de bacterias multirresistentes gram+ y gram-(18, 19). Estos mismos investigadores observaron efectos similares de la cubierta de la semilla inhibiendo la formación de biofilms de Staphylococcus aureus, Pseudomona aeruginosa y Candida albicans entre un 76-86%, similar al efecto obtenido con la aplicación del antibióticos (gentamicina para S. aureus y P. aeruginosa y anfotericina para C. albicans) (20). También se ha comparado la eficacia antibiótica de extractos de diferentes especies vegetales (hojas de Xanthosoma mafaffa y Moringa oleifera y los frutos de Passiflora edulis) demostrado que el extracto de hoja de moringa presenta un actividad antibiótica de mayor espectro inhibiendo el crecimiento de diversas cepas bacterianas gram-multirresistentes (Escherichia coli, Enterobactera aerogenes, Klebsiella pneumoniae, Pseudomona aeruginosa y Providencia stuartii) siendo E. coli la más sensible de todas con una concentración mínima inhibitoria de 128 μg/ml (21).
Nogueira Brilhante et al. (22) evaluaron la capacidad extractos de hojas, semilla, tallo, vaina y flores de la moringa en la inhibición del crecimiento de especies del género Vibrio (V. cholera, V. vultificus, V. mimicus) y E. coli en el agua de cría de camarón (Macrobrachium amazonicum) contaminada. El tratamiento con mayor espectro de inhibición fue el realizado con el extracto de la vaina, efectivo frente a V. cholera, V. vultificus, V. mimicus y E. coli, a concentraciones mínimas inhibitorias de 0.3125, 5, 1.25 y 2.5 mg/ml respectivamente. El extracto de semillas resultó ser el menos efectivo, inhibiendo solamente el crecimiento de V. cholera y a concentración de 2.5 mg/ml. Así, los autores concluyes que estos derivados de la moringa pueden ser útiles para disminuir la contaminación de determinadas especies de Vibrio spp. y E.coli en los criaderos de camarón, reduciendo así los posibles casos de diarrea por la ingestión de estos crustáceos.
Dasgupta et al. (23) desarrollaron un estudio para valorar la capacidad del extracto de semilla de moringa de disminuir la concentración bacteriana en agua de bebida contaminada con E. coli y Bacillus subtilis. Elaboraron extractos de la semilla a concentraciones crecientes de 1-5% de las cuales añadieron volúmenes crecientes de 2 a 10 ml en agua a purificar (100ml). La reducción máxima de E. coli y B. subtilis se encontró al añadir 10ml del el extracto al 5%, siendo del 93.2% y 96.2% respectivamente.
Su poder desinfectante también se ha demostrado en un estudio realizado por Torondel et al. (24) valorando la efectividad de la hoja triturada en el lavado de manos, comparado con el jabón. Se contrastaron un triturado fresco y otro desecado frente al jabón en manos de 15 voluntarios previamente contaminadas con E. coli. Se comparó el efecto inhibitorio de E. coli con 2, 3 y 4 g de moringa y desecada frente a 5 ml de jabón no medicado. En el ensayo con 2 g la reducción logarítmica media fue de 2.44 con el triturado fresco y 2.70 con el seco, mientras que con el jabón fue de 3.00. Con 3 g la reducción fue de 2.58, 2.84 y 2.99 respectivamente y para 4 g de 2.70, 2.91 y 2.97, respectivamente. En ningún caso se observaron diferencias estadísticamente significativas (p>0.05) entre la eficacia de la moringa ni el jabón. De esta forma, la hoja de moringa puede emplearse como higienizante de manos en zonas rurales donde no sea fácil la obtención de jabón.
El uso de moringa en alimentos queda reducido casi exclusivamente a panes, galletas y productos cárnicos (Tabla 2). En los primeros se utiliza con un fin nutritivo, mientras que en los segundos con un fin tecnológico, como antioxidante y conservante principalmente.
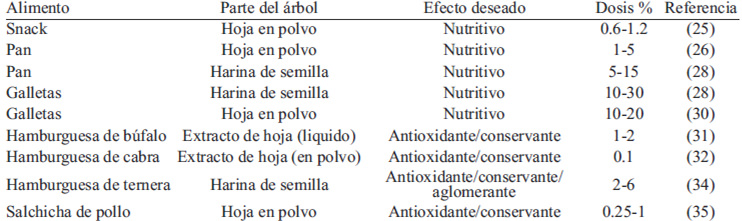
Rakotosamimanana et al (25) compararon el conocimiento local acerca de la moringa y su consumo, comparándola con el de la mandioca. Se realizó una encuesta a 1000 familias de diferentes zonas geográficas y nivel socio-económico acerca de si conocían o no el producto, por qué motivos lo utilizaban, forma de consumo y motivo de no consumirlo, entre otras cuestiones. La mandioca resultó ser mucho más conocida y consumida, a pesar de que los encuestados decían conocer sus propiedades poco nutritivas, e incluso tóxicas si se consumía en grandes cantidades. Por el contrario las hojas de moringa eran menos conocidas y consumidas, aun conociendo sus propiedades nutritivas. Los autores determinaron que esta diferencia se consumo se debía a factores culturales, de disponibilidad y de precio, y también por el mayor efecto saciante de la mandioca. Ante estos resultados los investigadores desarrollaron cuatro tipos de snack: (A) 100% mandioca, (B) 99.4% mandioca y 0.6% de hoja de moringa, (C) 89.4% mandioca, 0.6% moringa y 10% azúcar y (D) con 89.4% mandioca, 1.2% moringa y 10% azúcar. Tras el ensayo, los niños prefirieron los snack del grupo (C) y (D). Los autores concluyen que es recomendable potenciar campañas de información y el cultivo de plantaciones de moringa para hacerlas llegar a los consumidores, ya que una vez consumida en determinadas preparaciones puede ser aceptada, especialmente en los niños por su elevado contenido en aminoácidos esenciales, ácido α-linoleico y minerales.
En este caso la adición de los diferentes derivados de la moringa persigue el objetivo de incrementar el valor nutritivo de estos alimentos. Se ha desarrollado pan suplementado con hoja de moringa (26). El estudio se llevó a cabo con 5 mezclas a distinta concentración de hoja de moringa en polvo con harina de trigo (1%, 2%, 3%, 4% y 5%) y la harina control (100% trigo). En todos los casos se produjo un incremento de proteínas, grasas, fibra y cenizas y los niveles de Fe, Cu, Mg, Ca y β-caroteno aumentaron significativamente (p<0.05).
En cuanto a las propiedades físicas del pan elaborado, el incremento de volumen de las piezas se vio disminuido conforme incrementaba la concentración de hoja de moringa, desde un volumen final de 796 cm3 en el pan con 100% de trigo hasta 496 cm3 en el pan con 5% moringa. Según los autores este cambio se debió a la menor capacidad de fermentación y la menor cantidad de gluten presente conforme se aumentaba la cantidad de hoja de moringa en la mezcla de harina. Por otro lado, a adición de hoja de moringa en polvo condujo a unas propiedades sensoriales disminuidas penalizadas por el cambio en el color, sabor y textura. Por este motivo los autores recomendaban la utilización de la hoja de moringa pero con adición de sustancias aromatizantes para enmascarar el sabor de la misma.
Respecto al cambio de coloración del pan tras la adición de moringa la hoja de moringa, existe otra publicación de pan enriquecido con espinacas y acelgas (27). En este caso los autores utilizaron concentraciones de 20g y 40g espinacas y acelgas troceadas (no molidas) por 100g de harina sin que se produjera, en general, rechazo en las propiedades sensoriales por parte de los consumidores. Es posible que para evitar un rechazo por el color verdoso sea conveniente informar al consumidor previamente de los cambios y propiedades del pan para evitar el impacto visual o trocear las hojas del producto vegetal a introducir en vez de utilizar un triturado en polvo para evitar en la medida de lo posible la difusión de color a toda la masa de pan.
En otro estudio se incorporó harina de semilla de moringa en pan y galletas (28). En este caso los autores utilizaron harina de semillas de moringa que, previamente, fueron hervidas y desecadas para eliminar las sustancias responsables del sabor amargo característico de las semillas crudas. Para la elaboración del pan realizaron mezclas de de 95/5, 90/10 y 85/15 mientras que para la elaboración de galletas las mezclas fueron de 90/10, 80/20 y 70/30. En ambos casos se utilizaron productos control a base de harina de trigo (100/0).
Las propiedades nutritivas de panes y galletas elaboradas a partir de las harinas enriquecidas mejoraron notablemente. En cuanto a las propiedades reológicas del pan, las mezclas del 0 al 15% de harina de semilla de moringa resultaron reducir significativamente el volumen de la pieza de pan y la textura de la miga. Las propiedades sensoriales se vieron perjudicadas, tanto en la corteza como en la miga, debido principalmente a la menor cantidad de gluten en la harina resultante. Par corregir estas deficiencias, se realizó otra prueba con harina 90/10 con un 10% adicional de una mezcla de aditivos químicos (gluten deshidratado, ácido ascórbico y estearoil-lactilato de sodio), muy utilizado en panadería como emulsionante y conservante (29) en la que se observó una mejoría en el volumen, la textura y las características de la corteza y la miga del pan.
En el caso de las galletas se observó que concentraciones superiores al 20% de harina de moringa afectaba negativamente al crujido y al color de la superficie. Se describe un sabor semejante al de las nueces, atípico de las galletas. Pero las galletas al 20% ofrecen unas características físicas y sensoriales muy aceptables, teniendo en cuenta el gran incremento en el poder nutritivo de las mismas.
Los autores de este estudio concluyeron que es factible realizar panes con un 10% de harina de semilla de moringa, y galletas con un 20%, tratando previamente las semilla para eliminar sustancias amargantes.
Nwakalor et al. (30) desarrollaron también galletas, pero en este caso mezclando la harina de trigo con hoja de moringa en polvo en concentraciones de 100/0 (control), 90/10, 80/20, 70/30 y 50/50. Los nuevos productos se evaluaron sensorialmente y los resultados fueron positivos en las galletas con 10% de hoja de moringa ya que no mostraron diferencias significativas respecto al grupo control. Las galletas con 20% de hoja de moringa fueron penalizadas en el color y el aroma pero no en la aceptación global, mientras que las galletas al 30 y 50% presentaron una disminución significativa en todos los parámetros evaluados, crujido, gusto, color, aroma y aceptación global. De esta forma los autores recomiendan la concentración del 10% de hoja triturada de moringa en harina de trigo para la elaboración de galletas.
Se han desarrollado diversos estudios en productos cárnicos. Diferentes partes del árbol de la moringa presentan gran cantidad de antioxidantes y sustancias antimicrobianas (21). En estos casos se buscó evaluar la eficacia como potencial antimicrobiano y antioxidante, pudiendo ser utilizado como conservante natural.
Hazra et al. (31) estudiaron la adición de extracto acuoso de hoja de moringa en hamburguesas de carne de búfalo, evaluando los efectos en las propiedades físico-químicas, sensoriales y de estabilidad durante el cocinado. El extracto se añadió en concentraciones de 1, 1.5 y 2% a la mezcla de preparación de las hamburguesas, manteniendo unas preparaciones control sin extracto añadido. Se realizaron pruebas de pH, retención de agua, pérdida de peso tras el cocinado, capacidad antioxidante (determinando los mg de manolaldehído/kg de muestra), crecimiento microbiano y determinaciones sensoriales. Las tres preparaciones con el extracto de hoja resultaron tener valores de pH significativamente mayores (pH 6.0) que la muestra control (pH 5.5). La capacidad de retención de agua también se incrementó de forma significativa al incrementar la dosis de extracto hasta la concentración del 1.5% (15.1%) frente al control (12.2%). Esto provocó una menor pérdida de peso tras el cocinado en la misma relación siendo la menor en las hamburguesas enriquecidas al 1.5 y 2% (34.8%) y la máxima en la hamburguesas control (36.7%). En todos los casos las diferencias fueron estadísticamente significativas (p<0.05).
La capacidad antioxidante medida mediante las sustancias reactivas al ácido tiobarbitúrico (TBARS) fue mayor en la muestra enriquecida al 1% (0.27 mg de manolaldehido/kg) frente al control (0.42 mg/kg). Respecto al crecimiento microbiano, todas las hamburguesas mostraron valores muy bajos siendo menores en las preparaciones enriquecidas (2.95, 2.72 y 2.65 CFU/g respectivamente) frente a las muestras control (2.96 CFU/g), demostrando la capacidad antimicrobiana de estos extractos.
Finalmente, el análisis sensorial tras el cocinado (160°C durante 10 min) demostró una mejoría en el color de las hamburguesas enriquecidas, debido a la menor oxidación de la mioglobina; una mayor jugosidad y terneza, relacionada con la mayor retención de agua en estas preparaciones; un sabor mejor valorado relacionado con la menor presencia de peróxidos debido al poder antioxidante; en definitiva, una mejor valoración sensorial en las hamburguesas enriquecidas respecto a las control.
Con base a estos resultados, los autores concluyeron que la adición de extracto acuoso de hoja de moringa deshidratado al 1%, 1.5% o 2% en hamburguesas de búfalo disminuyó la oxidación de las mismas y el crecimiento microbiano, al mismo tiempo que mejora sus cualidades sensoriales, debiendo ser promocionado como ingrediente a tener en cuenta en éste y otros producto cárnicos.
Otro estudio donde se utiliza el extracto de hoja de moringa como antioxidante es el realizado por Das et al. (32) en hamburguesas de carne de cabra. En este caso los autores emplean el extracto acuoso de hojas de moringa (concentrado al 8% del volumen inicial) para comparar su efecto antioxidante frente al butil hidroxil tolueno (BHT), antioxidante habitual en productos cárnicos, pero con reconocida actividad tóxica (33). Para realizar esta comparación se elaboraron dos tipos de hamburguesas, unas con un 0.1% de BHT y otras con 0.1% de EHM, con un tiempo de almacenamiento de 15 días. Se utilizó una preparación de hamburguesas sin ningún aditivo como control. Tras la elaboración de las hamburguesas se determinaron los niveles de compuestos fenólicos que resultaron ser significativamente mayores en las elaboradas con el extracto de hoja de moringa, lo que justificaría su uso como ingrediente para aumentar el poder antioxidante de las hamburguesas. Las hamburguesas con extracto de hoja y BHT mostraron menor oxidación (TBARS), a los 15 días de almacenamiento siendo de 0.53 y 0.6 mg de manolaldehido/kg respectivamente, significativamente infereiores (p<0.05) que las que no tenían ningún antioxidante añadido (1.2 mg de manolaldehido/kg). A nivel sensorial (apariencia, sabor, textura, jugosidad y palatabilidad general) los autores describen que con la adición del extracto no hubo pérdida de calidad, siendo aceptadas tras los 15 días de almacenamiento. De esta forma se demuestra la validez del extracto de hoja de Moringa oleifera como antioxidante en las hamburguesas de cabra sin alterar las características sensoriales de las mismas.
Al-Juhaimi et al. (34) investigaron los efectos de la adición de harina de semillas de Moringa oleifera en hamburguesas de ternera como agente aglomerante, aprovechando al mismo tiempo sus cualidades antioxidantes y conservantes. En este caso se realizaron hamburguesas con 0%, 2%, 4% y 6% de harina de semilla, reduciendo en los mismos porcentajes la cantidad de carne magra presente en la fórmula.
Las hamburguesas se cocinaron en horno a 180°C durante 20 min hasta temperatura interna de 75°C. Posteriormente se evaluaron las diferentes muestras y se observaron diferencias estadísticamente significativas (p<0.05) en varios parámetros. Las hamburguesas enriquecidas presentaron mayor rendimiento en el cocinado (valorado como la relación entre el peso después y antes del cocinado) respecto a las hamburguesas control. Este rendimiento fue proporcional a la cantidad de harina de semilla añadida, siendo del 60.04, 68.52, 72.90 y 81.81% en las muestras al 0, 2, 4 y 6% respectivamente. Estas diferencias se debieron principalmente a la mayor retención de agua (48.54, 57.13, 64.16 y 72.19%, respectivamente) y grasa (56.17, 65.11, 69.40 y 78.29% respectivamente).
Otras variables como la oxidación, pH y crecimiento microbiano se analizaron durante el almacenamiento a los días 0, 7, 14 y 21. En cuanto a la oxidación, los autores revelan que fue significativamente menor en las hamburguesas con harina de moringa frente a las hamburguesas control al igual que los valores de pH fueron mayores cuanto mayor era la concentración de harina de semilla (5.68, 6.01, 6.11 y 6.16 respectivamente medidos a los 21 días). El estudio microbiológico para determinar crecimiento de microorganismos aerobios mesófilos a 4°C reveló diferencias significativas en el recuento de colonias siendo menor en todas la muestras enriquecidas a los días 7, 14 y 21, mientras que las hamburguesas sin modificar presentaron los mayores recuentos microbianos
Finalmente se realizó un análisis sensorial con panelistas entrenados con muestras cocinadas a los días 0, 7, 14 y 21, para determinar la variación de atributos sensoriales durante el almacenamiento. Las hamburguesas normales mostraron signos de deterioro al día 14 y las enriquecidas al 2% mostraron deterioro a los 21 días por lo que no pudieron ser analizadas sensorialmente mientras que las muestras enriquecidas al 4 y 6% no mostraron deterioro durante los 21 días de almacenamiento a 4ºC. Por lo tanto, sólo se realizaron catas de las hamburguesas al 0% de harina de semilla a los días 0 y 7, al 2% a los días 0, 7 y 14 y de las hamburguesas al 4 y 6% a los días 0, 7, 14 y 21. En esos casos no se observaron diferencias significativas en parámetros como apariencia, sabor, aroma, terneza y aceptabilidad general.
Por lo tanto, los autores concluyeron que la harina de semilla de moringa mejoró las propiedades de las hamburguesas de ternera a nivel fisicoquímico, de cocción, vida útil y preferencia del consumidor tras el almacenamiento en refrigeración mostrando una buena capacidad como aglomerante en la formulación de hamburguesas de ternera.
En un estudio realizado con salchichas de pollo (35), se sustituyeron los tradicionales antioxidantes químicos (BHT) por triturado de hoja de moringa. Los autores adicionaron hoja de moringa desecada a la mezcla de salchicha en concentraciones de 0.25, 0.50, 0.75 y 1%, además de una muestra control positivo (con BHT) y otra control negativo (sin antioxidante) y valoraron las muestras a la semanas 1, 2, 3, 4 y 5 de almacenamiento. El trabajo describe a las cinco semanas una actividad antioxidante significativamente mayor de la muestra con 0,25% de hoja de moringa respecto a la muestra sin antioxidantes, e incluso de las muestras con 0.50, 0,75 y 1% respecto a la muestra con BHT. El crecimiento microbiano de aerobios mesófilos a la semana cinco de almacenamiento fue significativamente menor en las salchichas con 0.25% de moringa respecto a los controles siendo las pruebas con 0.50, 0.75 y 1% las que menor crecimiento microbiano presentaron. En cuanto a las propiedades sensoriales las salchichas del grupo control positivo (con BHT) y las de hoja de moringa al 0.25 y 0.50% fueron las mejor valoradas sin diferencias entre ellas, mientras que las concentraciones de 0.75 y 1% afectaron notablemente a la apariencia, color, sabor, aroma y a la aceptabilidad global. Por lo tanto los autores concluyeron que un 0.5% de hoja de Moringa oleifera en las salchichas de pollo reduce significativamente la oxidación lipídica y el crecimiento microbiano sin alterar las características sensoriales.
La presencia de sustancias antioxidantes en la hoja de Moringa oleifera está ampliamente descrita (36), pero estas mismas sustancias pueden verse afectadas tras los tratamientos de desecación ya que son relativamente inestables al calor (7). Un estudio desarrollado por Saini et al. (37) determinó el efecto de cinco métodos de desecado (liofilización, cabina de secado de aire forzado, microondas, horno y secado al sol) para valorar posteriormente las propiedades antioxidantes. Para ello se cuantificaron carotenoides, clorofila, α-tocoferol, ácido ascórbico y compuestos fenólicos totales antes y después de la desecación. Los resultados mostraron que la cabina de aire forzado mantuvo los mayores niveles de carotenoides totales mientras que la liofilización fue el método que menor pérdida de ácido ascórbico mostró. La desecación mediante exposición solar fue la que mayores pérdidas causó. Los autores concluyen que a nivel industrial es recomendable la desecación en cámaras de secado con ventilación, y a nivel doméstico la desecación en microondas.
La Moringa oleifera ha sido utilizada de forma ancestral como curativo o paliativo de enfermedades de muy diversa índole. En los últimos años se han desarrollado gran variedad de investigaciones demostrando algunas de sus funciones en el organismo fundamentalmente como antioxidante, antiinflamatorio o antihiperglucemiante, entre otras, así como funciones bacteriostáticas y bactericidas. Esto le otorga una capacidad potencial para el tratamiento de diabetes, protector hepático o protector de los endotelios en determinadas enfermedades crónicas.
Sin embargo son todavía escasos los estudios acerca de los beneficios de la moringa utilizada como ingrediente alimentario. Los estudios en alimentos se centran valorar el incremento de las propiedades nutritivas y la aceptación por parte del consumidor. En otros casos se valora el efecto tecnológico, principalmente como antioxidante natural, comparado con aditivos químicos como el BHT, con marcado carácter tóxico.
Una vez descritas las propiedades potencialmente beneficiosas para la salud, el amplio margen de seguridad en humanos (2) y también la validez como antioxidante y conservante alimentario, es necesario incrementar las investigaciones relativas al efecto sobre el organismo derivado del consumo de estos alimentos enriquecidos, teniendo en cuenta diversas variables como las posibles pérdidas de actividad durante el tratamiento o la interacción con otros compuestos de los mismos, entre otras.
Recibido: 14-08-2016
Aceptado: 21-12-2016