El objetivo de este estudio fue determinar el impacto de la variación de distintas mediciones antropométricas en la evolución del síndrome metabólico (SM). El estudio fue prospectivo en 178 sujetos que asistieron a un programa de salud cardiovascular entre el año 2013 y 2016. Se recolectaron datos demográficos, historia médica, factores de riesgo cardiovascular, y se midió perfil lipídico, glicemia de ayuno, presión arterial y medidas antropométricas (IMC, perímetro de cintura y cadera y % de grasa corporal). Se consideró la agregación de 2 o más componentes de síndrome metabólico (SM), excluyendo cintura y se determinó la probabilidad de reversión del SM, considerándose como la reducción desde 2 o más componentes a 1 o ninguno. El tiempo de seguimiento promedio fue de 2 años. La edad promedio fue de 40 años y 37% eran mujeres. Según los modelos de odds proporcionales, ajustados por edad, sexo y tiempo de seguimiento, aquellos sujetos con 2 o más componentes de SM triplicaron su probabilidad de revertir el SM por cada reducción de 1 Kg/m2 de IMC por año (OR IMC = 3,03; 1,74-5,28; p<0,001). En el caso de cintura, esta probabilidad aumentó en 52% por la reducción de 1 cm por año (ORcintura =1,52; 1,28-1,81; p<0,001). Finalmente una reducción de 0,01 en el índice cintura/cadera aumentó en 26% la probabilidad de revertir el SM (ORcintura/cadera =1,26; 1,06-1,491; p<0,01); sin embargo, el % de grasa corporal no tuvo un efecto significativo Los cambios en IMC y circunferencia de cintura serían los parámetros antropométricos más confiables para monitorear la evolución del SM.
Palabras clave: Antropometría, síndrome metabólico, cintura, relación cintura-cadera.
The objective of this study was to determine the impact of variation of different anthropometric parameters at follow-up in the evolution of the metabolic syndrome (MetS). Prospective study in 178 subjects who attended a cardiovascular health program between 2013 and 2016. Demographical data, medical history and cardiovascular (CV) risk factors (RFs) were collected. In addition, fasting lipid profile, blood glucose, blood pressure and anthropometrical parameters (BMI, WC, hip, and fat percentage) were measured. To determine the evolution of MetS, the clustering of 2 or more of the MetS components were considered, excluding WC. Odds proportional models adjusted by age, sex and time of follow-up were built to determine the probability of reverting the MetS. MetS reversion was considered as the reduction to 1 or 0 components in subjects with 2 or more. Mean follow-up time was 2 years. Mean age was 40 years old and 37% were women. According to the odds proportional models, subjects tripled their chance of reverting MetS for each 1 kg/m2 of BMI reduction (ORBMI=3.03; 1.74-5.28; p<0.001). For WC, the chance of reverting MetS increased 52% for each reduction of 1 cm of waist (ORwaist =1.52; 1.28-1.81; p<0.001). A reduction of 0.01 in the waist to hip ratio increased in 26% the chance of reverting MetS (ORwaist/hip=1.26; 1.06-1.491; p<0.01); however, fat percentage did not have a significant effect on the evolution of the MetS. BMI and WC are the most reliable anthropometrical parameters for monitoring the evolution of MetS aggregation in the out-patient clinical setting.
Key words: Anthropometry, metabolic syndrome, waist, waist to hip ratio
Pontificia Universidad Católica de Chile, Santiago, Chile. Universidad San Sebastián. Chile.
Universidad de la Serena, La Serena, Chile.
El síndrome metabólico (SM) es definido como la agregación de factores de riesgo (FR) cardiometabólicos que aumentan el riesgo de enfermedad cardiovascular (CV) y diabetes. Según el criterio ATP III armonizado, el diagnóstico se realiza con la presencia de 3 o más de los siguientes componentes: obesidad abdominal, hipertrigliceridemia, HDL bajo, hiperglicemia de ayuno o diabetes y, presión arterial ≥130/85 o hipertensión en tratamiento (1). Así mismo, los sujetos con SM presentan niveles elevados de marcadores inflamatorios, lo cual acelera el proceso aterosclerótico (2, 3). Como resultado, estos pacientes presentan 2 veces más riesgo de eventos CV y un riesgo de mortalidad 50% mayor comparado con sujetos sanos (4). En Chile, las cifras son alarmantes. Según la última encuesta nacional de salud (ENS) 2009, la prevalencia de SM fue de 35% y la prevalencia de diabetes aumentó en un 50% (desde 6% a 9%) en 6 años en la población adulta (5,6).
La fisiopatología del síndrome metabólico es complejo con resistencia a la insulina y regulación anormal del metabolismo de lípidos, los cuales juegan un papel central en la patogénesis (7,8). La predisposición genética es un factor en el síndrome metabólico, y la prevalencia difiere entre los grupos étnicos (9,10). Sin embargo, la obesidad juega un papel central en la fisiopatología ya que el tejido adiposo visceral favorece la liberación de adipoquinas, la mayoría pro-inflamatorias, tales como interleucina-6, factor de necrosis tumoral alfa (TNF-a), angiotensinógeno y ácidos grasos no esterificados, entre otros (11). Estos factores son etiológicos en el desarrollo de hipertensión, dislipidemia aterogénica, resistencia a la insulina y posterior intolerancia a la glucosa en los pacientes obesos.
Por ello, tanto la obesidad junto a un estilo de vida sedentario son los principales responsables del SM en la población general, siendo la modificación de la dieta y el ejercicio, los pilares fundamentales del tratamiento. Sin embargo, en los últimos años ha existido un aumento alarmante en el consumo de bebidas azucaradas: Chile es el país con mayor consumo per cápita a nivel mundial (12). A esto se suman los resultados del último Sistema de Medición de la Calidad de la Educación (SIMCE) de actividad física en alumnos de 8vo básico, en el cual destacan el aumento de obesidad y el empeoramiento de la capacidad aeróbica en nuestros adolescentes (13), es decir, no hay indicios que la prevalencia de SM vaya a revertirse en el futuro.
Según la ENS 2009, 64% de la población adulta en Chile presenta malnutrición por exceso, en concordancia con la elevada prevalencia de SM y diabetes reportadas. Trabajos previos han demostrado que diversos indicadores de obesidad, como índice de masa corporal (IMC), cintura y porcentaje de grasa, se asocian en forma directa y significativa con triglicéridos, presión arterial y glicemia y, en forma inversa, con colesterol HDL (14-16). Sin embargo, la cintura o el índice cintura/talla han demostrado ser los indicadores más sensibles en el diagnóstico de SM, debido a su directa relación con adiposidad visceral (15). El último consenso presentado por el Ministerio de Salud de Chile sugiere la utilización de los puntos de corte propuestos por el ATP III armonizado para población asiática y Latinoamericana: 90 cm para el hombre y 80 cm para la mujer. Estudios previos realizados en nuestro país han reportado que valores por “sobre” estas cifras, ya muestran un aumento significativo de los componentes cardiometabólicos, respaldando la sugerencia del ATP III armonizado (15, 16).
Existe escasa evidencia sobre el efecto de la variación de estos parámetros antropométricos, específicamente cintura, relación cintura-cadera y porcentaje de grasa, en la regresión o progresión del SM. Esto tiene especial relevancia en el planteamiento de qué metas se propondrán en el tratamiento. Por ello, el principal objetivo de este estudio fue determinar los cambios en los diferentes parámetros antropométricos, después de al menos 1 año en un programa de salud CV, y medir su impacto en la reducción o progresión de la agregación de los componentes del SM.
Estudio longitudinal. 178 sujetos jóvenes, sin antecedentes de enfermedad aterosclerótica, asistieron en forma voluntaria a un programa de prevención primaria cardiovascular, entre los años 2013 y 2016. Todos firmaron un consentimiento informado que autorizaba a utilizar sus datos en forma anónima para fines académicos.
Todos los sujetos se entrevistaron con la enfermera del programa. Esta recolectó los datos demográficos, antecedentes médicos, medicamentos y antecedentes de factores de riesgo cardiovascular (FRCV) tradicionales: dislipidemiaDLP (colesterol total > 200 mg/dL y/o colesterol HDL < 40/50 mg/dL y/o triglicéridos > 150 mg/dL y/o colesterol LDL > 130 mg/dL y/o uso de hipolipemiantes), hipertensión-HTA (PAS y/o PAD > 140/90 mmHg y/o tratamiento antihipertensivo), diabetes (glicemia ≥ 126 mg/dl y/o tratamiento hipoglicemiante), tabaquismo activo, sedentarismo y obesidad.
En todos los sujetos, se tomó perfil lipídico, glicemia de ayuno, creatininemia y TSH. La presión arterial sistólica (PAS) y diastólica (PAD) se midieron en tres ocasiones distintas y se calculó el promedió según las guías de “Seventh Report of the Joint National Committee”(17). También se midió cintura e índice de masa corporal (IMC). La cintura se midió en el punto medio entre la cresta ilíaca y la última costilla y el IMC se clasificó según los estándares de la Organización Mundial de la Salud (OMS). Se midió cadera para calcular relación cintura/cadera (ICC) y 4 pliegues cutáneos (tríceps, bíceps, cresta iliaca y subescapular) para determinar el porcentaje de grasa (%Grasa) según ha sido descrito por Durnin & Womersley (18). El protocolo de medición para estas variables antropométricas se basó en los estándares propuestos por Sociedad Internacional para la Cine-antropometría (ISAK) (19). Todas las mediciones antropométricas fueron realizadas por la misma nutricionista certificada por ISAK.
El perfil lipídico y la glicemia de ayuno se determinaron en laboratorio con las siguientes técnicas:
Las muestras de sangre periférica se extrajeron entre las 08:00 y las 10:30 de la mañana: bioquímica: 5 ml de sangre en tubo BD Vacutainer® SST II advance. Se empleó el analizador automático de química clínica Roche/ Hitachi, y los reactivos correspondientes. Todas las determinaciones se realizaron en el laboratorio clínico central de la universidad ejecutora, acreditado por la CDC, Center for Diseases Control, de Estados Unidos.
Se consideró regresión del SM, cuando un sujeto con 2 o más componentes, reducía la agregación de ellos a 0 o 1 componente del SM, es decir se reducía al menos 1 FR cardiometabólico. Para ello, se consideraron los siguientes componentes del SM, excluyendo cintura ya que ésta se consideró como variable independiente y predictor de la evolución del SM:
El análisis estadístico se realizó en R v. 3.4.1. Los resultados se presentan en términos de promedio, desviación estándar o frecuencia, porcentaje. Se consideró significancia estadística con p<0.05. Las comparaciones pareadas para un mismo sujeto se realizaron mediante pruebas t pareadas para variables continuas y prueba de Mcnemar para prevalencias. Para la agregación de factores de riesgo cardiometabólicos se consideró como respuesta el número de componentes del síndrome metabólico en el segundo control, categorizado como 2+, 1 o 0, lo que significa que la distribución de probabilidad de esta respuesta para el total de sujetos sigue una distribución multinomial. La asociación entre la respuesta y las variables predictoras se modeló mediante un modelo de odds proporcionales. Esto significa que, en la escala logística (logit(p)=logp1−plogit(p)=logp1−p), es decir, las odds de tener o no un determinado número de componentes del síndrome metabólico en escala logarítmica, la asociación con los distintos niveles de cada factor de riesgo se supone en términos proporcionales, es decir, rectas paralelas. El odds ratio representa, entonces, el aumento o disminución relativa en términos de odds de la probabilidad de disminuir en una categoría la agregación de factores de riesgo cardiometabólico. Para cada modelo de odds proporcionales se ajustó por el número de factores de riesgo en el primer control, sexo y edad (20, 21).
En el control inicial, la edad promedio del grupo fue de 40 años; 37% eran mujeres, y 80% tenía >12 años de educación. La prevalencia de SM fue de 21% según criterio ATP III armonizado, siendo mayor en hombres que en mujeres (29 vs 8%, p<0.01). El tiempo de seguimiento promedio fue de 2 años. La Tabla 1 describe las variables demográficas, antropométricas y bioquímicas del grupo total y según sexo en el primer control. La tabla 2 compara las variables antropométricas y bioquímicas del grupo total en el primer y segundo control según sexo.
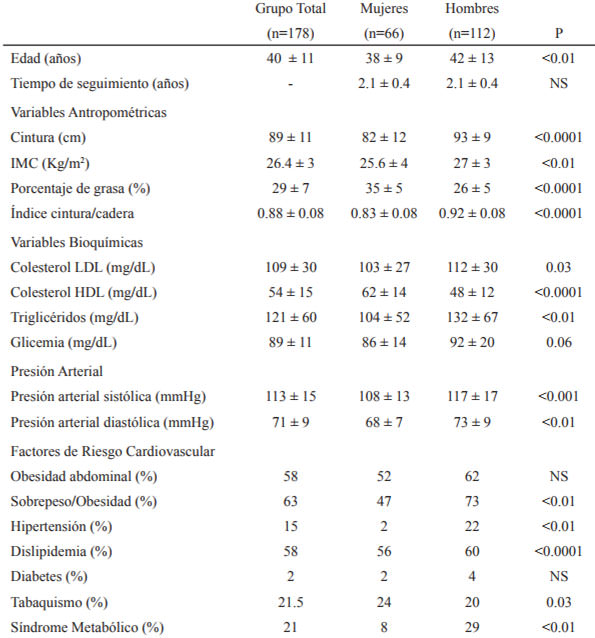
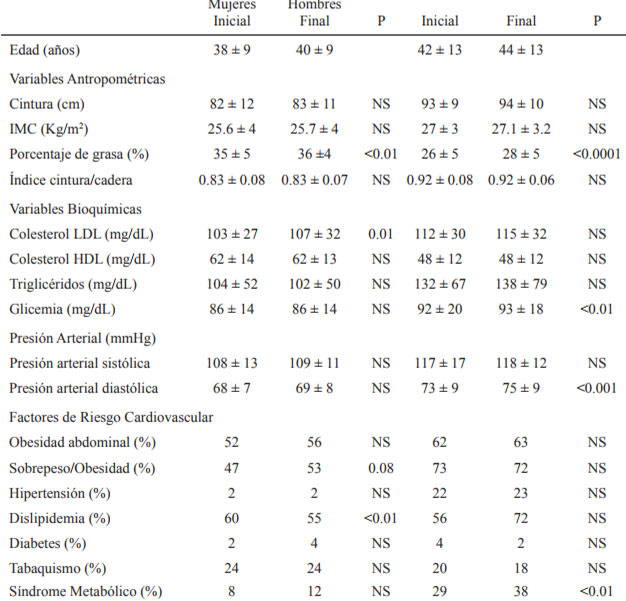
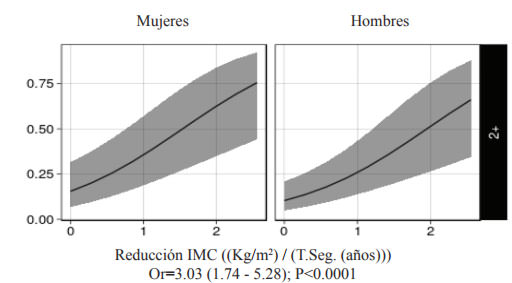
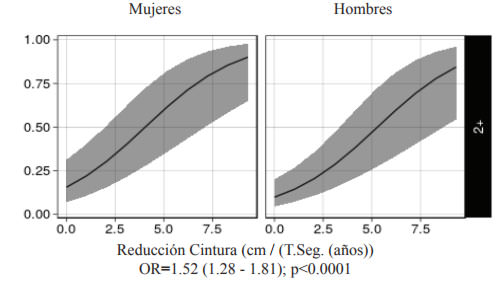
Los resultados de los modelos de odds proporcionales, ajustados por edad, sexo y tiempo de seguimiento (2 a) en los participantes con 2 o más componentes de SM se presentan en la tabla 3. Estos demuestran la probabilidad de reducir a 0 o a 1 componentes del SM, según los cambios en las variables antropométricas. Los cambios en el IMC, cintura o ICC demostraron ser predictores significativos de la evolución del SM. Aquellos sujetos con 2 o más componentes del SM aumentaron 3 veces su probabilidad de reducir a 0 ó 1 FR del SM por cada reducción de 1 kg/m2 de IMC por año (OR IMC = 3.03; 1.74-5.28; p<0.0001; Figura 1). En el caso de cintura, esta probabilidad aumentó en 52% por la reducción de 1 cm por año en la cintura (ORcintura =1.52; 1.28-1.81; p<0.0001; Figura 2). En el caso de ICC, se observó una probabilidad de reversión del 26% por cada reducción de 0.01 cm/cm por año de ICC (ORICC =1.26; 1.06-1.491; p<0.01)

El % de grasa no tuvo un efecto significativo en la probabilidad de reducción de componentes cardiometabólicos.
El principal resultado del estudio demuestra que los cambios en la circunferencia de cintura e IMC fueron los mejores predictores de la evolución en el tiempo del SM, es decir, en la regresión o progresión de los componentes cardio-metabólicos del SM. La modificación del % de grasa no demostró un efecto significativo en la evolución de los FR, y el ICC, no fue superior a la cintura. Los resultados obtenidos en este estudio confirmarían 2 hipótesis: la primera es que la variación de la adiposidad central determina con mayor precisión la evolución de los componentes del SM; la segunda es que el exceso de grasa subcutánea no predice la evolución del SM. Lo último, estaría fundamentado en que el % de grasa fue estimado a través de la medición de pliegues cutáneos, es decir, grasa subcutánea, y en la superioridad del parámetro cintura por sobre el ICC, este último que corrige el valor de cintura por grasa periférica, que también es subcutánea (cadera). Además, es importante destacar que el IMC, al menos en esta población no deportista, tendría relación directa con la masa adiposa total, lo cual incluiría la adiposidad visceral.
Estos resultados tienen mucha importancia en clínica y en el sistema de salud, ya que según ellos, no se justificaría en términos de costo-efectividad, la utilización de otras mediciones antropométricas más sofisticadas y caras, o de composición corporal (ej: grasa visceral por tomografía computada) para monitorizar la evolución del SM. Medidas tan simples como el IMC y la cintura, son muy buenos predictores. Esto también había sido confirmado por el estudio INTERHEART, que reportó que la obesidad central, determinada por la cintura, era uno de los FR que se asociaba con mayor fuerza a eventos coronarios. Este mismo grupo reportó que la cintura sería el parámetro más sensible para predecir la presencia de FR CV(16).
En la literatura no existe evidencia en cuanto al impacto de la variación de la cintura en el tiempo sobre la agregación de FR cardio-metabólicos: esto es lo que se trató de determinar en nuestro estudio.
Tal como ha sido publicado en las últimas guías del manejo de obesidad del Colegio y Asociación Americanas de Endocrinólogos, es sabido que una reducción de al menos un 5% del peso corporal tiene un impacto significativo en la reducción de lípidos y presión arterial, y por ello es una recomendación con un grado de evidencia IA (22). Lo mismo ha sido avalado por las guías de manejo de la obesidad de la Asociación Americana del Corazón (23). Incluso estos últimos refieren que pérdidas más modestas, pero sostenidas, del 3% al 5% del peso, ya tendrían un impacto en los niveles de lípidos y glicemia, pero no en la presión arterial. Sin embargo, para la prevención de diabetes en sujetos con SM, se recomienda una reducción de peso de al menos un 10% (Grado de evidencia II B)(22). Según nuestros resultados, un sujeto con presencia de 2 o más FR cardiometabólicos, que reduce en un 10% el peso (~3 kg/m2 en su IMC) tendría una probabilidad de 75% de reducir a 0 o 1 componente si es mujer, y 65% si es hombre. Esto equivaldría a reducir el IMC de este grupo de sujetos de 28 a 25, pasando del sobrepeso a la normalidad. El peso promedio de las mujeres con 2 o más FR en este estudio fue de 72 kg. En estas mujeres, el 10% del peso serían ~7 kg, o sea, debieran bajar a ≤ 65 kg. En el caso de los hombres, el peso promedio fue 81 kg y debieran bajar a 72 kg. El llegar a estos pesos los llevaría a dejar el grupo de pacientes con más riesgo cardio-metabólico.
Un meta-análisis reciente reportó que la rehabilitación cardiaca resultó en una reducción significativa en el promedio de circunferencia de cintura. Además, esta reducción de la circunferencia de cintura se asoció significativamente con la disminución en el colesterol LDL, PAS y PAD, glucosa en ayuna, y triglicéridos y un aumento significativo en el colesterol-HDL, en conjunto con una tendencia no significativa para la asociación con colesterol total (24). Es sabido que la medición más sensible para hacer el diagnóstico de SM es la cintura. Sin embargo, tanto para los pacientes como para los clínicos, no están claras las metas de reducción de cintura para lograr revertir el SM. Esto es importante, ya que al igual que para el peso, es necesario tener metas de reducción en distintas proporciones según el valor inicial, para así favorecer la auto-eficacia y adherencia de los pacientes (25). Esto, porque el alcance de los valores óptimos son muy difíciles de lograr en el corto plazo. Así, según nuestros datos, una reducción de ~7 cm de cintura en mujeres y ~8 cm en hombres tendría efectos similares a la reducción del 10% del peso descrita previamente. Con el gráfico de odds proporcionales (Figura 2) presentado en este estudio, el clínico podría establecer metas menos exigentes, mostrándole al paciente, según cintura e IMC, cuál sería el impacto en la agregación de factores de SM.
Así, los resultados de este estudio podrían ayudar a motivar a los pacientes que se encuentran en tratamiento, y podría ayudarlos a adherirse a la terapia, incluso, pidiéndoles a ellos mismo que monitoreen su progreso.
Este estudio presenta limitaciones. La principal limitación es el tiempo de seguimiento. Sabemos que los cambios antropométricos son muy difíciles de lograr, por lo cual, hubiéramos visto más impacto si hubiéramos tenido más tiempo de seguimiento, o a través de una intervención intensiva en sujetos con SM. Estos sujetos, sin embargo, continúan en nuestro programa CV. Por otro lado, la estimación del % de grasa se realizó a través de las ecuaciones de Durnin & Womersely (17), las cuales consideran la edad como parte del cálculo, por lo tanto, puede influir en el % de grasa. Sin embargo, al incluir la sumatoria de 4 pliegues en el análisis, no se observó un efecto significativo en la evolución de los componentes de SM (OR=1.00; 0.98-1.03), lo cual valida nuestros resultados.
Los cambios en IMC y circunferencia de cintura serían los parámetros antropométricos más confiables para monitorear la evolución del SM. Los cambios en indicadores antropométricos que incluyen adiposidad subcutánea, como el % de grasa o la sumatoria de pliegues, no se relacionaron con la evolución del SM, mientras que los cambios en el ICC presentaron una relación más débil que la cintura en forma aislada.
Recibido: 28-02-2017
Aceptado: 23-08-2017