Existe consenso científico acerca de la necesidad de cambiar hábitos de alimentación y aumentar la actividad física como estrategias para prevenir y paliar la epidemia de sobrepeso y obesidad. En este estudio se evaluaron los efectos de dietas isocalóricas e isolipídicas, con diferente calidad de lípidos, sobre algunos indicadores de síndrome metabólico en ratas de la línea IIMb/Beta de 70 días de edad. Este modelo murino manifiesta obesidad acompañada de hipertriacilglicerolemia y resistencia insulínica desde la pubertad y desarrolla diabetes tipo 2 en la adultez. Se suministraron durante 90 días tres dietas formuladas según AIN-93 (American Institute of Nutrition-93) ad libitum: Dieta AIN con aceite de girasol como fuente de lípidos; Dieta JB con grasa bovina (remplazando al aceite de girasol) y Dieta JBn-3 con grasa bovina más ácidos grasos poliinsaturados n-3 provenientes de aceite de pescado. Los animales que consumieron la dieta JBn-3 manifestaron disminución (p<0,05) en algunos indicadores de sindrome metabólico como la hiperinsulinemia, la hipertriacilglicerolemia y el depósito de lípidos totales, colesterol y triacilgliceroles hepáticos. Si bien se requieren más estudios, se confirma la validez de las intervenciones dietarias para el abordaje de la obesidad y sus comorbilidades recomendadas por los organismos internacionales.
Palabras clave: AGPI n-3, síndrome metabólico, ratas obesas.
There is scientific consensus about the importance of changing dietary habits and increasing physical activity for the prevention and treatment of obesity and its co-morbidities. The effects of isocaloric and isolipidic diets with different type of fat on symptoms of the metabolic syndrome in 70 days old IIMb/Beta rats were evaluated. This murine model develops obesity, hypetryacilglycerolemia and insulin resistance since puberty, progressing to type 2 diabetes in adulthood. Three diets formulated according to AIN-93 (American Institute of Nutrition-93) were offered ad libitum during 90 days: Diet AIN with sunflower oil; Diet JB with bovine fat (replacing sunflower oil) and Diet JBn-3 with bovine fat and PUFAn-3 from fish oil. The group fed JBn-3 diet showed diminution (p<0,05) on several of the clinical manifestations of the metabolic syndrome, such as: hyperinsulinemia, hypertriacylglycerolemia and hepatic total lipids, cholesterol and triacylglycerols. Although more research is required, the study supports the beneficial effects of dietary approaches on obesity and its comorbidities.
Key words: PUFA n-3, metabolic syndrome, obese rats.
1Cátedra de Biología. Facultad de Ciencias Médicas. Universidad Nacional de Rosario.
2 Área Bromatología y Nutrición. Facultad de Ciencias Bioquímicas y Farmacéuticas. Universidad Nacional de Rosario. Santa Fé - Argentina.
Actualmente el sobrepeso y la obesidad se encuentran entre los principales factores de riesgo de enfermedad y muerte a nivel mundial; cada año fallecen alrededor de 3,4 millones de personas adultas por esta causa. Además, gran parte de las enfermedades crónicas no transmisibles (ECNT), tanto en países de altos como en los de medianos y bajos ingresos, se asocian al exceso de peso, como el caso de la diabetes (44%), las cardiopatías isquémicas (23%) y ciertos tipos de cánceres (entre el 7% y el 41%) (1). En Argentina los resultados de la 3ra Encuesta Nacional de Factores de Riesgo (ENFR) del año 2013 son contundentes: se detectó una prevalencia de sobrepeso de 37,1%, valor que se mantuvo constante con respecto a la 2da ENFR, de 2009, pero mayor que en la 1ra ENFR de 2005 (34,4%). Con respecto a la obesidad: 20,8% en 2013, siendo este valor 15,6% mayor que el registrado en 2009 (2).
Los organismos internacionales involucrados en el estudio y la promoción de la salud han coincidido en recomendar cambios en los hábitos alimentarios como paso fundamental para prevenir y paliar esta pandemia (3). Las propuestas incluyen: disminución de la ingesta de azúcares, grasas saturadas y sal y aumento en el consumo de frutas, vegetales y grasas insaturadas; es destacable la recomendación de incorporar a la dieta alimentos naturales y productos alimenticios con compuestos bioactivos, los así llamados “alimentos funcionales”.
Entre los compuestos con actividad biológica cuyos efectos han demostrado ser beneficiosos para la salud se cuentan los ácidos grasos poliinsaturados omega-3 (AGPI n-3) cuyas formas más representativas en los alimentos son el eicosapentaenoico (20:5 n-3 o EPA), el docosahexaenoico (22:6 n-3 o DHA) y el alfa linolénico (18:3 n-3 o α–ALA). Los AGPI n-3 EPA y DHA se encuentran en pescados y algunos tipos de algas mientras que el α-ALA proviene de fuentes vegetales (4,5). Las primeras investigaciones acerca de la relación entre el consumo elevado de AGPI n-3 y la menor incidencia de enfermedades cardiovasculares (ECV) datan de los años 70 y fueron llevados a cabo en poblaciones esquimales del norte de Groenlandia (6). Desde esos primeros hallazgos, numerosos estudios han evaluado las respuestas provocadas por la incorporación a la dieta de AGPI n-3 en diferentes lapsos y dosis, concluyendo en la mayoría de ellos, que los efectos diferían según que los síndromes evaluados fueran de tipo agudo o crónico (7).
Algunos trabajos refieren a la eventual acción protectora de los AGPI n-3 frente a las agresiones que suponen las recientes modificaciones en los patrones alimentarios, tales como el consumo excesivo de bebidas azucaradas y de alimentos ultraprocesados.
La acción preventiva de los AGPI n-3 sobre las ECV y otras enfermedades crónicas como el síndrome metabólico (SM) y la diabetes tipo2 (DMT2) ha sido reportada en animales de experimentación en los que dichas alteraciones metabólicas fueron inducidas.
Los AGPI n-6 y n-3 son relevantes para la composición y la fluidez de las membranas de la célula y para una óptima función de ésta. Además actúan como precursores de los eicosanoides y docosanoides involucrados en la regulación de la inflamación, la inmunidad y la agregación plaquetaria (8). Mientras la familia n-6 promueve el aumento de productos pro inflamatorios derivados del ácido araquidónico, los AGPI n-3 EPA y DHA -ya sea sintetizados de modo endógeno o provenientes de la dieta- dan lugar a productos que ejercen efectos benéficos en los ya mencionados procesos inmunológicos, de agregación plaquetaria e inflamatorios. Otras acciones descriptas son las uniones de los AGPI n-3 a diversos receptores nucleares (PPARs, Factor nuclear hepático, Receptores x del hígado) que regulan la expresión génica, mecanismo por el cual ejercerían su efecto sobre, entre otros, el metabolismo lipídico (9).
La línea de ratas IIMb/Beta desarrolla una obesidad no hiperfágica, definida tanto por el sobrepeso como por el volumen de los panículos adiposos, de grado moderado -30% de masa grasa- si se compara con la de otras ratas como las fa/fa en las que el porcentaje de grasa corporal alcanza el 50% del peso total. La obesidad que se manifiesta tanto cuando se alimenta a los animales con la dieta formulada según el American Institute of Nutrition (AIN-93) como cuando se les suministra el alimento balanceado comercial para animales de experimentación- es de instalación peripuberal, alrededor de los 50 días de edad, y afecta a ambos sexos con mayor notoriedad en los machos (10). La manifestación corporal de la obesidad se acompaña con hipertriacilglicerolemia y resistencia insulínica (RI) que progresa hacia la DMT2 en la adultez (11). La colesterolemia total y sus fracciones se mantienen dentro de los límites normales. Otro indicador de SM que se presenta en esta línea de ratas es el depósito excesivo de trialcilgliceroles hepáticos o hígado graso. Este modelo murino de obesidad y dislipidemia ha demostrado en diversos trabajos experimentales marcada susceptibilidad a los cambios en la composición de la dieta, respaldando plenamente las recomendaciones de las organizaciones científicas internacionales en el sentido de intervenir en el ambiente nutricional con el fin de atenuar la manifestación de la obesidad y sus comorbilidades (12-14).
El objetivo de esta investigación fue evaluar los beneficios del consumo de aceite de pescado sobre algunas manifestaciones de SM en ratas obesas IIMb/Beta. Las variables evaluadas fueron la biomasa, el depósito adiposo abdominal, la glucemia, la insulinemia (e Índice HOMA–IR), las transaminasas hepáticas y el perfil lipídico en sangre e hígado.
Ratas macho de la línea obesa IIMb/Beta de 70 días de edad (criadas en la Cátedra de Biología de la Escuela de Medicina de la Universidad Nacional de Rosario) recibieron por un lapso de 90 días, dietas isocalóricas e isolipídicas formuladas con distinta calidad de lípidos, efectuándose los ajustes necesarios para que el aporte del resto de los nutrientes fuera adecuado y semejante en todos los casos, según AIN-93.
Durante el experimento los animales fueron alojados en jaulas individuales en condiciones habituales de criadero: acceso ad libitum al agua y a la comida, iluminación con fotoperiodicidad controlada (12hs), temperatura ambiental de 25º C ± 2º C (calefacción y/o ventilación) e higiene diaria.
La cría y la manipulación de las ratas se llevaron a cabo de acuerdo con el protocolo para el cuidado y uso de animales de experimentación del Instituto Nacional de Salud (NIH) de los Estados Unidos de Norteamérica y fue aprobado por el Comité de Bioética y el de Bioseguridad de la Universidad Nacional de Rosario.
Las dietas experimentales se prepararon según AIN-93. Estas fueron isocalóricas e isolipídicas difiriendo únicamente en su composición lipídica. (Tablas 1 y 2)
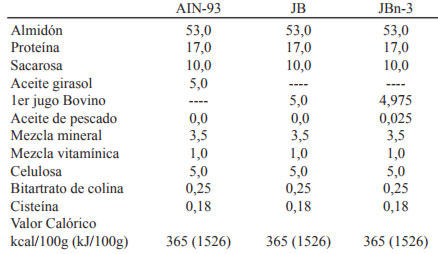
Dieta AIN (control): AIN-93 M, con aceite de girasol.
Dieta JB: AIN-93 M modificada reemplazando el aceite de girasol por primer jugo bovino (grasa bovina). Según el Código Alimentario Argentino el primer jugo bovino se define como el producto separado por fusión a temperatura no mayor de 80°C de los tejidos y partes adiposas limpias e inalteradas de animales bovinos (15). El reemplazo del aceite vegetal (rico en ácidos grasos insaturados) por el jugo bovino (rico en ácidos grasos saturados), tiene por objetivo maximizar la expresión del síndrome característico de esta línea de ratas ya descripto en la introducción.
Dieta JBn-3: Dieta JB + cápsulas de aceite de pescado (disponibles en el mercado para consumo humano). El aceite de pescado se adicionó a la dieta mezclado con la grasa bovina en una proporción de 25mg cada 100g de dieta. La concentración de AGPI n-3 /100g de alimento fue de 8,55mg y la de AGPI n-6 de 45,08 mg. La relación AGPI n-6/AGPIn-3 fue 5,3:1. Diseño experimental
Los animales (n: 21) de peso promedio 207,4g ± 15,5 g (media ± desviación estándar) se dividieron de forma aleatoria en tres grupos de siete ratas cada uno. Día por medio se les midió el peso corporal y con igual frecuencia se evaluó la ingesta de alimento. Con estos datos se calculó la eficiencia de conversión del alimento según la siguiente ecuación:
Eficiencia de conversión de alimento = Aumento de peso corporal (g)/alimento consumido (g).
Al final del experimento se recolectaron muestras de sangre post ayuno y tras sacrificar los animales se extrajeron los hígados y los panículos adiposos retroperitoneales y epididimales que se lavaron con buffer PBS, se secaron con papel de filtro y se pesaron.
Se calcularon los pesos relativos de hígados y panículos con la siguiente ecuación:
Peso relativo de órgano= peso absoluto de órgano (g)/ peso corporal total (g) x 100.
El método de eutanasia fue por sobredosis de pentobarbital sódico inyectado por vía intraperitoneal (American Veterinary Medical Association. Guidelines on Eutanasia. Formerly Report of the AVMA Panel on Eutanasia, 2007).
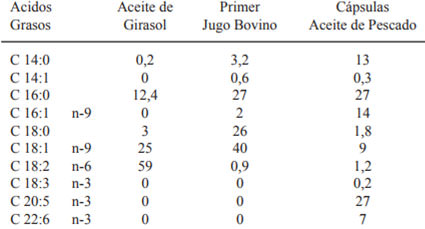
Se determinó el perfil de ácidos grasos de los lípidos empleados en la formulación de cada dieta mediante cromatografía gas/líquido con un equipo Shimadzu GCMS – QP modelo 2010, Japón (cromatógrafo gaseoso acoplado a espectrómetro de masa).
Se determinaron en plasma: glucosa, triacilgliceroles, colesterol total, alanino amino transferasa (ALAT) y aspartato amino transferasa (ASAT) con técnicas enzimáticas espectrofotométricas empleando equipos de diagnóstico Wiener (Wiener Laboratorios SAIC; Rosario, Argentina).
Se cuantificó la insulina utilizando un kit de radioinmunoensayo específico para insulina de rata (Rat insulin Millipore, USA) y un contador de centelleo sólido Alfanuclear modelo Cmos.
El indice HOMA-IR se calculó según la siguiente ecuación: Insulinemia en ayunas (mU/l) x Glucemia (mg/dl) /405 (16).
Las muestras de hígado se trataron en un homogeneizador Potter-Elvejahn, se extrajeron los lípidos con cloroformo/metanol y se cuantificaron gravimétricamente después de la evaporación de la mezcla de solventes (17).
Los triacilgliceroles y el colesterol hepáticos se determinaron con los mismos procedimientos analíticos empleados para los lípidos plasmáticos.
Los resultados, que se informan como media ± desviación estándar, se analizaron con el test de ANOVA. Se utilizó el paquete estadístico Prism 3.0 y se consideraron diferencias estadísticamente significativas a un nivel de p<0,05.
Biomasa, panículos adiposos, consumo de alimento y eficiencia.(Tabla 3)

La evolución del peso corporal de los animales fue semejante en los tres grupos. La diferente calidad de la grasa dietaria no afectó la ganancia de peso y al final del experimento la biomasa no difirió significativamente. Tampoco difirió el depósito de grasa abdominal: el peso de los panículos adiposos perigonadales y retroperitoneales no mostró diferencias (p>0,05).
Parámetros plasmáticos (Tabla 4)
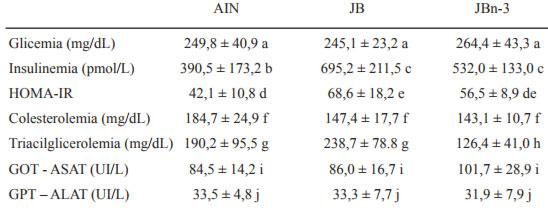
Los valores de glucosa basal en sangre fueron igualmente altos en los tres grupos, no así la insulina circulante. Tal como se ve reflejado en el índice HOMA-IR, la dieta JB provocó una RI significativamente mayor que la dieta AIN (p<0,05). Con la dieta JBn-3 se manifestó una disminución de la RI que no logró ser significativa ya que los animales de este grupo no alcanzaron los valores de HOMA-IR del grupo control.
Las concentraciones de colesterol plasmático no difirieron entre los grupos, pero sí lo hicieron los valores de triacilglicerolemia que fueron significativamente mayores para el grupo JB. Los animales con la dieta JBn-3, a diferencia del resto mostraron una concentración de triacilgliceroles en sangre significativamente inferior a las de los otros dos grupos (p<0,05).
Las concentraciones plasmáticas de las aminotransferasas ASAT y ALAT no difirieron estadísticamente entre los grupos.
Grasa total, colesterol y triacilgliceroles hepáticos (Tabla 5)

Los lípidos hepáticos analizados fueron todos más altos en el grupo JB, difiriendo estadísticamente de los del grupo JBn-3 (p<0,05).
La interacción compleja entre los factores genéticos y los ambientales como condicionante de patologías tales como la obesidad y sus comorbilidades, se vio una vez más reflejada en este trabajo: en las ratas de la línea IIMb/Beta, el desorden metabólico, puesto de manifiesto aún con el alimento AIN, se expresó en diferente grado dependiendo de la composición de la dieta
En discordancia con Priego et al (18), quienes proponen un sobreconsumo provocado por los ácidos grasos saturados de la dieta -atribuido a la inhibición que éstos producirían sobre los receptores largos de leptina a nivel hipotalámicoel consumo de alimento fue semejante en los tres grupos. El aumento de la biomasa fue igual en los tres grupos; por ello el cálculo de la eficiencia de conversión del alimento fue similar en todos los animales y evidenció igual palatabilidad y capacidad de saciación de las dietas.
Existe consenso en que la diferente sensibilidad de los tejidos a la acción de la insulina se vincula con la composición lipídica de la membrana de sus células, por lo que una baja concentración de AGPI n-3 de cadena larga en las mismas podría ser responsable de la sensibilidad disminuida (19). En concordancia con esto, la dieta rica en ácidos grasos saturados provocó -tal como lo revelan los valores de HOMA-IR- un aumento de la RI propia de la línea así como de la hiperinsulinemia compensadora (20). Este efecto, generado por el reemplazo de los lípidos de la Dieta AIN por ácidos grasos saturados (Dieta JB), fue atenuado cuando se incorporaron los AGPI n-3 (Dieta JBn-3)
Diversos autores han reportado que la incorporación de AGPI n-3 a la dieta logra reducir el nivel de triacilgliceroles plasmáticos, probablemente por incremento de la betaoxidación y disminución consecuente de la lipogénesis de novo (21-23). Coincidiendo con los estudios tanto sobre animales de experimentación como en humanos, en nuestra investigación el agregado de AGPI n-3 disminuyó la triacilglicerolemia -aún la potenciada por el agregado de ácidos grasos saturados- llevándola a un nivel normal e incluso inferior al alcanzado por el grupo alimentado con la Dieta AIN.
El desarrollo de esteatosis se considera el factor predisponente más reproducible para la enfermedad grasa no alcohólica del hígado (EHGNA) y el de primera aparición. Este signo, ya incluido en la definición del SM está estrechamente relacionado con la obesidad y la RI (24,25). Su manifestación en la línea de ratas Beta fue atenuada por la adición de los AGPI n-3 de aceite de pescado a la dieta que incluso ejercieron una acción preventiva al provocar un depósito de lípidos hepáticos menor que la dieta control.
La promoción del empleo de los AGPI n-3 en el tratamiento de la EHGNA tanto en animales de experimentación como en humanos no solo se ha fundamentado en la disminución del depósito hepático de grasa sino también en la atenuación de marcadores enzimáticos (26). En este experimento, sin embargo, no se encontraron alteraciones en los niveles de ASAT ni de ALAT indicando que no alcanzó a alterarse la función hepática en ninguno de los grupos.
La incorporación de AGPI n-3 de aceite de pescado a la dieta demostró efectos beneficiosos sobre algunas de las manifestaciones del síndrome metabólico, siendo particularmente destacable la acción sobre la esteatosis hepática, con posible prevención de su avance hacia estadíos de mayor gravedad.
La respuesta de este modelo murino de obesidad y diabetes espontáneas respalda las recomendaciones internacionales acerca de la importancia de las intervenciones dietarias como estrategia para la prevención de la obesidad y la terapéutica de enfermedades crónicas no transmisibles de alta prevalencia en la actualidad.
A Wiener Lab. SAIC por la provisión de los equipos de diagnóstico bioquímico.
A la Universidad Nacional de Rosario por el subsidio otorgado.
Recibido: 11-07-2017
Aceptado: 10-10-2017