El objetivo del presente trabajo fué conocer la relación y la fuerza de asociación que existe entre composición corporal y la concentración sérica de leptina en una población de mujeres. Se evaluaron 60 mujeres de entre 18 y 21 años de la Benemérita y Centenaria Escuela Normal del Estado de San Luis Potosí (BECENE). Se realizaron mediciones de: perímetro de cintura y cadera, talla, peso, porcentaje de masa grasa y niveles plasmáticos de: glucosa, colesterol total, triglicéridos, HDL, LDL, leptina e insulina. El procesamiento de datos se realizó en IBM SPSS Statistics 20.0 (IBM Corp.), se utilizó estadística descriptiva, regresión lineal y regresión logística binomial, así como diferencia de medianas con una confiabilidad al 95%. La población estudiada presentó valores normales de glucemia y presión arterial media, sin embargo también se observó un 3% con hipercolesterolemia total; un 29,9% con sobrepeso/ obesidad; y un 26% con resistencia a insulina (HOMA2 IR mayor a 1.4). La mediana de leptina sérica fue de 6,49 ng/ml, donde un 30% de las mujeres se encontraban en condiciones de hiperleptinemia. Se observó una correlación significativa entre los niveles séricos de leptina y porcentaje de masa grasa, IMC, insulina sérica e índice HOMA2-IR. Por regresión logística binomial se observó que el IMC elevado aumenta la probabilidad de padecer hiperleptinemia 7,5 veces, y los niveles altos de masa grasa aumentan el riesgo 6,2 veces. El mejor predictor de hiperleptinemia fue el IMC.
Palabras clave: Leptina, obesidad, masa grasa, índice de masa corporal.
Sixty women aged between 18 and 21 from the Benemérita y Centenaria Escuela Normal del Estado de San Luis Potosí (BECENE) were evaluated. Body mass index, fat mass percentage, waist-hip ratio and several plasma components were analyzed: glucose, total colesterol, free tryglycerides, HDL, LDL, insulin and leptin. Data was processed by SPSS Statistics 20,0 software using descriptive statistics, binomial logistic regression with a confidence value of 95%. The population showed normal glycemic and blood pressure values, whereas a 29,9% of women were overweight/obese, 3% showed hypercholesterolemia and 29,9% showed insulin resistance (HOMA2 IR over 1.4). The median for blood leptin was 6.49 ng/ml, and 30% of women were hyperleptinemic. A positive and significant correlation was observed between blood leptin values and BMI, % fat mass, blood insulin and HOMA2-IR index. The odds ratio analyzed for BMI, showed that overweight and obesity increase 7,5 times the risk of hyperleptinemia. On the other hand, high levels of fat mass, increase by 6,2 times the risk of hyperleptinemia. So far, the best predictor for hyperleptinema is BMI.
Key words: Leptin, obestiy, body fat mass, body mass index
https://doi.org/10.37527/2018.68.1.002
Las enfermedades crónicas no trasmisibles son un grupo heterogéneo de padecimientos de etiología y patogénesis multifactorial que se consideran uno de los mayores retos para el sistema de salud en México. Según datos de la Organización Mundial de la Salud (OMS), el sobrepeso y la obesidad son el quinto factor de riesgo de defunción en el mundo con, por lo menos, 2,8 millones de defunciones anuales. Además, el 44% de los casos de diabetes, el 23% de las cardiopatías isquémicas y hasta un 41% de algunos cánceres son atribuibles al sobrepeso y la obesidad (1).
En México, de acuerdo a la Encuesta Nacional de Salud y Nutrición 2016, la prevalencia de obesidad y sobrepeso (combinadas), en mujeres mayores de 20 años ha alcanzado una cifra de 75,6% (2). Además, es observable la aparición de condiciones de sobrepeso y obesidad a edades más tempranas, por lo que resulta imperante el establecer estrategias para la prevención, detección, monitoreo y apoyo a la población susceptible de presentar obesidad.
Hace aproximadamente 20 años, Friedman y colaboradores lograron identificar el gen que codificaba para la hormona de los conocidos ratones obesos (ob/ob) (3). Dicha hormona se identificó como leptina que es una adipocina producida principalmente en tejido adiposo blanco con actividad anorexogénica y termogénica. La leptina actúa principalmente en sistema nervioso central a nivel hipotalámico sobre receptores catalíticos que activan las vías clásicas de tirosina kinasa JACK/STAT. La señalización de los circuitos neuronales activan activa a su vez funciones sistémicas como aumento de la tasa metabólica en músculo e hígado, oxidación de lípidos, potenciación de la señal de insulina, maduración reproductiva, generación de hueso y regulación del sistema inmune (4).
Dado que esta hormona está involucrada en múltiples procesos fisiológicos relacionados a la homeostasis energética y el control del apetito, se consideró que se podría administrar exógenamente como terapia para tratar la obesidad. Sin embargo, la eficacia clínica de dicha terapia solo ha sido útil para sujetos que presentan obesidad por hipoleptinemia congénita (5).
Se ha reportado en diversas poblaciones que los niveles altos de masa grasa se relacionan con altos niveles plasmáticos de leptina, en donde dicha hormona no tiene el efecto anorexogénico y termogénico conocido. Esta condición se ha descrito como resistencia a la leptina y pudiera explicar una adaptación patológica al exceso de producción de tejido graso por mecanismos celulares desconocidos (6). En general, se desconoce aún el alcance de la sobreproducción de leptina, su relación con la generación y mantenimiento de obesidad y sus repercusiones patológicas entre otras cosas, por ello el objetivo principal de este trabajo fue conocer la relación entre los niveles séricos de leptina y la composición corporal en una población de mujeres jóvenes consideradas metabólicamente sanas.
Se trató de un estudio cuantitativo, correlacional y transversal, en el que se realizó invitación abierta a las estudiantes para participar. Se estudió una población de 60 mujeres de 18 a 21 años, estudiantes de 2º año de Licenciatura en Educación en la BECENE de San Luis Potosí, quienes mediante consentimiento informado aceptaron formar parte del estudio. Se excluyeron estudiantes embarazadas, lactando, en tratamiento con glucocorticoides, diabetes mellitus, dislipidemias, hipertensión arterial o con diagnóstico o tratamiento para disfunción tiroidea o hepática. Se eliminaron del estudio los registros de estudiantes cuyas muestras de sangre o datos antropométricos se encontraron incompletos.
Los datos se obtuvieron con la aplicación del método STEPwise de la OMS para identificar factores de riesgo para enfermedades crónicas, que consta de 3 pasos, el Step 1 es un cuestionario para identificar hábitos de vida, entre los cuales se evaluó el nivel de actividad física. El Step 2 incluye mediciones de talla (cm), masa grasa (%) y peso (Kg.), las cuales se realizaron con una báscula de impedancia bioeléctrica (SECA modelo 818). Se midieron también los pliegues bicipital, tricipital, suprailiaco y subescapular con la finalidad de corroborar las mediciones de porcentaje de masa grasa. Se obtuvo el perímetro de cintura considerando el punto medio de la distancia entre la cresta iliaca y el espacio intercostal y el perímetro de la cadera, tomado en la parte de mayor circunferencia en la zona de la cadera, ambos se midieron con una cinta ergonómica marca SECA modelo 201. El IMC se calculó como la razón entre el peso en kilogramos y la talla al cuadrado en centímetros, y se tomaron los valores de corte para las categorías de bajo peso, normopeso, sobrepeso y obesidad de acuerdo a los procedimientos recomendados por la OMS (1,7). Los valores de corte de porcentaje de masa grasa se tomaron considerando el origen mexicano y el rango de edad de los sujetos participantes (8).
En el Step 3 para determinar perfil bioquímico, se obtuvieron las muestras sanguíneas por punción venosa en tubos al vacío sin anticoagulante de 6 ml con previo ayuno de entre 10 y 12 horas. El suero se obtuvo mediante centrifugación a 1300 fcr por 10 minutos, fue separado y almacenado a -20°C hasta su análisis. Los análisis bioquímicos de suero se realizaron por espectrofotometría en un analizador automatizado A15 con reactivos dedicados marca BiosSystems, S.A. (Barcelona, ES). La determinación de insulina se realizó en el equipo Immulite 100 Casa comercial Siemens (Erlangen, Alemania) por quimioluminiscencia.
La determinación de leptina sérica se realizó por la técnica de ELISA con el kit Human ELISA kit, EZHL-80SK de acuerdo a las instrucciones del fabricante (EMD Millipore, Billerica, MA, USA.). El coeficiente de variación de los controles y ajustadores en todos los casos fue menor al indicado por el fabricante. Los materiales considerados Residuos Peligrosos Biológico Infecciosos (RPBI) fueron desechados conforme a la Norma Oficial Mexicana NOM- 087-SEMARNAT-SSA-2002 para la Protección ambiental. El índice HOMA2 se calculó con el software de la Universidad de Oxford, Diabetes Trials Unit.® considerando un valor de corte de 1.4 de acuerdo a Wallace, Levy and Matthews (9).
Para el análisis de concordancia entre las mediciones, se evaluó en todos los sujetos de estudio con tres indicadores: peso, perímetro de cintura, IMC, porcentaje de grasa total kg., masa grasa. En todos los casos la concordancia fue del 100 % (fórmula 3 de Fleiss).
Los datos fueron analizados con el programa Statistical Package for the Social Sciences (SPSS) versión 20 (IBM Corp.). Se realizó estadística descriptiva e inferencial utilizando intervalos de confianza del 95%, y nivel de significancia estadística del 0.05. Se reportan medidas de tendencia central y dispersión conforme a la naturaleza de los datos, análisis por Kruskal- Wallis para diferencia de medianas, así como pruebas de asociación por regresión lineal y por razón de momios (OR).
El presente trabajo se considera de riesgo mínimo de acuerdo a la reglamentación de la Ley General de salud en materia de investigación y a las normas de la Declaración de Helsinki. Se obtuvo consentimiento informado de los participantes y se aseguró la confidencialidad de los datos obtenidos. Los resultados individuales se comunicaron de manera individual a cada participante. El protocolo de investigación, así como la carta de consentimiento informado fueron evaluados en el Comité de Ética de la Facultad de Enfermería y Nutrición con número de registro: CEIFE-2014-90 y por el Comité de Ética en Investigación y Docencia de la Facultad de Ciencias Químicas dictamen número: CEID201402.
La población estudiada de mujeres de entre 18 y 21 años las mujeres estudiadas fueron normotensas. La mediana observada para el índice de masa corporal fue de 22,4 kg/m2 (16,9 a 40,5). 11,6% se ubicaron en la categoría de bajo IMC, 58,3 % en normopeso, 21,6% en sobrepeso y 8,3% presentaron algún grado de obesidad. La Tabla 1 muestra los valores antropométricos y bioquímicos.
Respecto a los valores de perfil lipídico, se encontraron 2 personas con hipercolesterolemia total (superior a 200 mg/dL) lo que representa el 3%, 4 personas con hipertrigliceridemia (superior a 150 mg/dL), representando el 6%; y ninguna persona con valores bajos de HDL en suero. Ninguna persona mostró altos niveles de colesterol total y de triglicéridos simultáneamente. En cuanto al metabolismo de glucosa no se encontró ninguna persona con hiperglucemia y solo una persona con hiperinsulinemia en valores de 33,7 μIU/mL, lo que representó el 1% de la muestra. Sin embargo, 14 personas presentaron valores de HOMA2-IR superiores al valor de corte de 1,4 (1,4 – 8,07) representando el 26 % de la muestra.
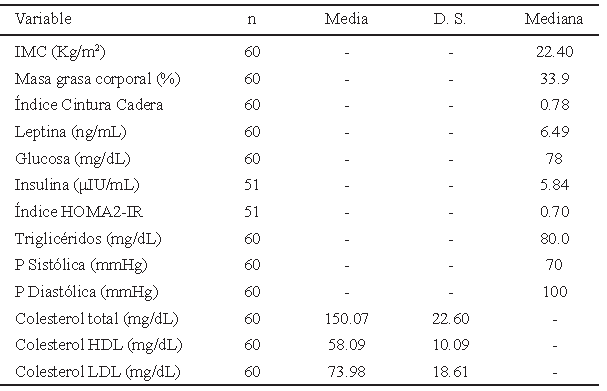
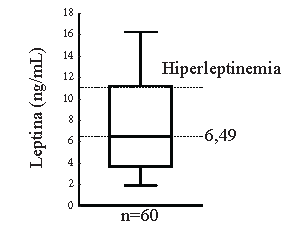
El valor de la mediana para leptina sérica fue de 6,49 ng/ml (1,91 a 16,25), mostrando valores de hiperleptinemia en 18 mujeres (30%) (Figura 1). Al evaluar los niveles séricos de leptina respecto al IMC descrito por categorías, se evidencía la relación directa que existe entre la obesidad y la hiperleptinemia. Para cada grupo de acuerdo al peso, los niveles medios de leptina sérica fueron: en los de bajo peso 2,36 ng/ml (1,9 a 3,6); en los normopeso 5,4 ng/ml (2,1 a 16,2); en los de sobrepeso 11,1 ng/ml (2,9 a 15,7) y en los de obesidad 13,7 ng/ml (8,7 a 15,3). Al realizar análisis por Kruskal-Wallis, se observó diferencia significativa entre los grupos contrastados contra el de normopeso (p<0,05). En el grupo de bajo peso ningún sujeto presentó valores de hiperleptinemia, en el grupo de normopeso el 14% lo presentó, en el grupo de sobrepeso el 54% y el grupo de obesidad, el 80% presentó hiperleptinemia (Figura 2). Al analizar los niveles séricos de leptina por grupos de porcentaje de masa grasa, se encontró que el grupo con porcentaje de masa grasa dentro de lo normal mostraba niveles mas bajos de leptina que el grupo con alto porcentaje de masa grasa (5,9 vs 11,29 ng/ml respectivamente; p = 0,023 analizado por Mann Whitney).
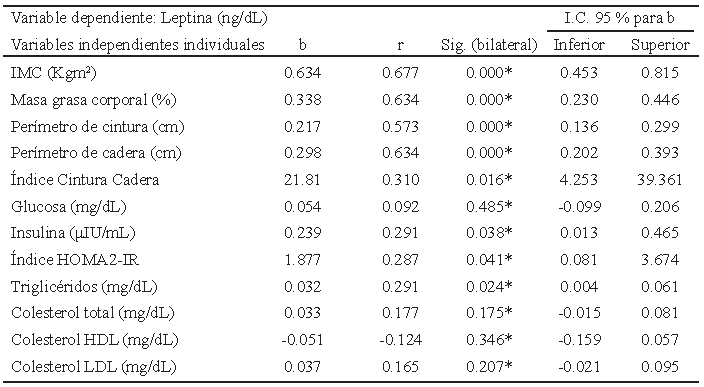
Se llevó a cabo un análisis de correlación entre las variables estudiadas y la concentración sérica de leptina (Tabla 2). Se observó una correlación mayor entre los niveles séricos de leptina y los indicadores de composición corporal: IMC, porcentaje de masa grasa, perímetros de cintura y cadera (p<0,000), y con el índice cintura/ cadera, (p = 0,016) al aumentar un centímetro en los perímetros de cintura y cadera se observaron incrementos en concentración de leptina de 0,22 y 0,30 ng/mL respectivamente. También se observó una correlación significativa entre la concentración sérica de insulina y el índice HOMA2-IR (Homeostasis Model Assessment 2 Insulin Resistance) (p = 0,038 y 0,041, respectivamente). Por cada incremento en una unidad de concentración de insulina, se observó un aumento en la concentración de leptina de 0,24 ng/mL. La concentración sérica de triglicéridos también mostró correlación con una p=0,024 y el incremento de cada 10 mg/ dl de concentración de triglicéridos explicó un aumento de 0,32 ng/dL en la concentración de leptina.
Se realizó también el análisis de regresión lineal de Spearman solo para IMC y porcentaje de masa grasa, ya que se considera que las mediciones de cintura y cadera son variables componentes de la composición corporal. Además de lo anterior, con propósitos de ajuste en los modelos de regresión se hizo corrección por concentración de triglicéridos ya que esta molécula se encuentra íntimamente relacionada con alteraciones metabólicas inducidas por desbalance energético cuando las dietas son de alto consumo de carbohidratos o por predisposición genética y este mecanismo impacta de manera directa en la composición corporal al presentar hiperplasia e hipertrofia del tejido adiposo, que se refleja sobretodo en depósitos centrales (Tabla 3).
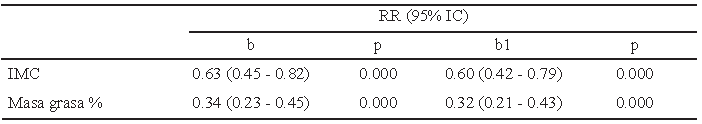
El análisis estadístico con intervalo de confianza al 95% arrojó un cambio predecible en la concentración de leptina relacionados al efecto crudo del IMC de 0,63 ng/mL, el aumento real se encontró entre 0,45 y 0,82 ng/mL, al hacer el ajuste por concentración de triglicéridos se predijeron incrementos de 0,6 ng/mL por cada unidad de IMC, el valor real se encontró en el rango de 0,42 a 0,79 ng/mL. Por cada unidad de porcentaje de masa grasa la predicción cruda apuntó a un incremento de 0,34 ng/mL, por lo tanto, el valor real osciló en el rango de 0,23 y 0,45 ng/mL; ajustando este modelo por la concentración de triglicéridos se observa que el incremeto estimado es de 0,32 con valor real que oscila entre 0,21 y 0,43 ng/mL de leptina.
Se realizó también el análisis de regresión lineal de Spearman solo para IMC y porcentaje de masa grasa, ya que se considera que las mediciones de cintura y cadera son variables componentes de la composición corporal. Además de lo anterior, con propósitos de ajuste en los modelos de regresión se hizo corrección por concentración de triglicéridos ya que esta molécula se encuentra íntimamente relacionada con alteraciones metabólicas inducidas por desbalance energético cuando las dietas son de alto consumo de carbohidratos o por predisposición genética y este mecanismo impacta de manera directa en la composición corporal al presentar hiperplasia e hipertrofia del tejido adiposo, que se refleja sobretodo en depósitos centrales (Tabla 3).
El análisis estadístico con intervalo de confianza al 95% arrojó un cambio predecible en la concentración de leptina relacionados al efecto crudo del IMC de 0,63 ng/mL, el aumento real se encontró entre 0,45 y 0,82 ng/mL, al hacer el ajuste por concentración de triglicéridos se predijeron incrementos de 0,6 ng/mL por cada unidad de IMC, el valor real se encontró en el rango de 0,42 a 0,79 ng/mL. Por cada unidad de porcentaje de masa grasa la predicción cruda apuntó a un incremento de 0,34 ng/mL, por lo tanto, el valor real osciló en el rango de 0,23 y 0,45 ng/mL; ajustando este modelo por la concentración de triglicéridos se observa que el incremeto estimado es de 0,32 con valor real que oscila entre 0,21 y 0,43 ng/mL de leptina.
Dada la fuerza de correlación de estas variables con la concentración sérica de leptina, se decidió realizar análisis de regresión logística binomial para evidenciar la asociación de las condiciones de riesgo de estos índices de composición corporal con los estados de hiperleptinemia contrastados contra condiciones normales para todas las variables. La Tabla 4 contiene los resultados del modelo de regresión logística binomial, resultantes al calcular la probabilidad de presentar hiperleptinemia comparando los grupos de clasificación dicotómica de IMC.
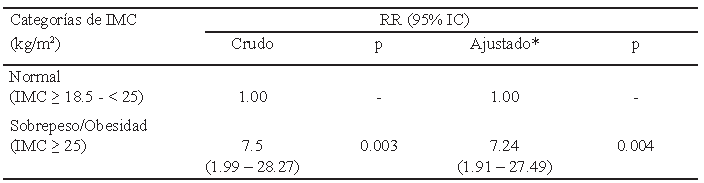
Se encontró que el tener sobrepeso/ obesidad incrementa la probabilidad de tener hiperleptinemia en 7,5 veces más que aquellos sujetos con IMC normal (p<0,003); el aumento real puede variar entre 1,99 y 28,27 veces mayor probabilidad de tener altos niveles de leptina. Ajustando el modelo por triglicéridos se estimó en 7,24 veces mayor probabilidad de tener ambas condiciones patológicas (p<0,004), el aumento real puede encontrarse en el rango de 1,9 a 27,5 % mayor probabilidad. Según este modelo, el 25% del incremento en la concentración en leptina sérica se explicó por un aumento en IMC. Este modelo de correlación se ajusta los datos en un 59,4%.
La tabla 5 muestra los resultados obtenidos tras ejecutar el modelo de regresión logística binomial para calcular la probabilidad de tener hiperleptinemia comparando sujetos de porcentaje de masa grasa normal contra aquellos que tienen valores altos estratificados conforme su IMC (8).
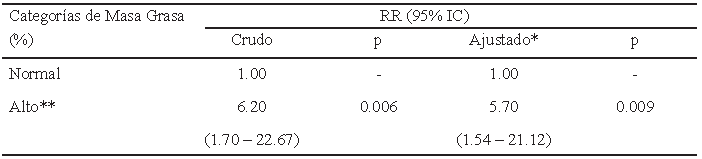
El tener valores de porcentaje de masa grasa alto incrementa la probabilidad de tener hiperleptinemia en 6,20 veces más que aquellos con porcentaje de masa grasa normal (p<0,006); el aumento real de la probabilidad pude variar entre 1,70 y 22,67 veces. La estimación de la probabilidad del modelo ajustado por concentración de triglicéridos es de 5,70 veces mayor de tener valores elevados de leptina (p=0,009); el valor real oscila entre 1,54 a 21,12 veces mayor probabilidad. Según este modelo, el 19,7% del incremento en la concentración en leptina sérica se explica por un aumento en porcentaje de masa grasa. Para este modelo de correlación, su ajuste a los datos es de un 67,3%.
Los datos del cuestionario de hábitos de riesgo STEPWISE de la OMS mostraron que el 56,6% de las jóvenes realizaban actividad física moderada diariamente, mientras que el 43% reportaron sedentarismo. Solo el 6% de la población reportó uso de tabaco. Por otro lado, en cuanto a consumo de bebidas azucaradas el 35% reportó un consumo diario nulo, el 43% consumo de una porción al día y el 22% un consumo mayor a 2 porciones diarias. Ninguna de estas variables mostró relación alguna con la concentración sérica de leptina.
La población estudiada fue de mujeres jóvenes con una edad promedio de 18 a 21 años, con valores de glucemia y presión arterial media normales. En cuanto a valores antropométricos, se observó una incidencia importante de sobrepeso y obesidad 21,6 y 8,3% respectivamente, sumando casi un 30%. El ENSANUT 2016 de Medio Camino, reportó un porcentaje semejante para el grupo de edad de 12 a 19 años, siendo de 26,4% con sobrepeso y 12,8% con obesidad (2). Para el grupo de adultos mayores de 20 años las cifras son mucho mas altas (75% sumando sobrepeso y todo tipo de obesidad). Sin embargo, el grupo referido en el presente estudio asemeja mas a una población de adolescentes tardíos. El perfil lipídico de las mujeres estudiadas en general se encuentra dentro de los rangos considerados normales, un bajo porcentaje muestra valores elevados de colesterol total y de triglicéridos séricos 3 y 6% respectivamente. Ninguna persona mostró dislipidemia mixta. Los hábitos de actividad física de las mujeres estudiadas muestran un alto índice de sedentarismo, probablemente asociado al estilo de vida como estudiantes de nivel superior. El ENSANUT mostró que un 51,2% de mujeres de entre 15 y 19 años realizan al menos 420 minutos por semana de actividad moderada-vigorosa, mientras que la media para nuestro grupo fue de 120 min por semana (mínimo: 15 minutos, máximo 240 min (2). Sería necesario aplicar un estudio mas detallado para poder valorar la razón del sedentarismo reportado.
A pesar de que ninguna mujer presentó hiperglucemia, y solo una de ellas mostró valores elevados de insulina sérica, al calcular el índice de homeostasis mejorado HOMA2-IR (9), se encontró que un 26% tiene valores superiores a 1,4. El índice HOMA2 IR tiene como objetivo estimar la sensibilidad sistémica a la insulina, así como la función de las células β del páncreas. Dicho índice mejorado ha sido probado en varias poblaciones y sugiere mayor sensibilidad para detectar tempranamente la resistencia a insulina en estudios amplios de seguimiento por varios años (10, 11). El porcentaje tan alto de mujeres con resistencia a insulina es notorio dado que se trata de mujeres adultas muy jóvenes. Martínez García y colaboradores reportaron en el 2010 un 49% de adolescentes con resistencia a insulina evaluada por índice HOMA1 IR (12), Existen pocos estudios que reporten las cifras de resistencia a insulina en este grupo de edad en población mexicana, y se evidencia en este trabajo la gran necesidad de detectarla tempranamente.
La concentración media de leptina para nuestra población en estudio fue de 6,5 ng/ mL (de 1,91 a 16,25 ng/ml). Estos valores se han encontrado en poblaciones semejantes de mujeres jóvenes latinas (13, 14). Según Heo, el valor de corte para hiperleptinemia es 11 ng/ ml, que es el valor considerado en este trabajo, donde encontramos 18 casos de mujeres en esta condición, representando el 30% de la población estudiada (8). Un estudio realizado en mujeres mexicanas de 30 a 45 años, mostró que los niveles mas bajos de leptina fueron del orden de 16,1 ± 9,6 ng/ml, mientras que en nuestro estudio encontramos un valor mínimo de 1,91. Así mismo, los niveles máximos en mujeres mayores de 30 años alcanzaban los 50 ng/ml (15), mientras que en este estudio el valor máximo fue de 16,25 ng/ml. En general, en grupos de mayor edad, se encuentran valores mas altos de leptina sérica (16-19).
El análisis de correlación mostró ser significativo entre leptina e insulina, índice HOMA 2-IR, triglicéridos, IMC, porcentaje de masa grasa, índice de cintura cadera, perímetro de cintura y perímetro de cadera. En cuanto a la relación con insulina e índice HOMA 2-IR, se encontró que por cada unidad de aumento en insulina sérica, hay un incremento de 0,24 ng/ml de leptina sérica. Esta relación ya ha sido descrita anteriormente en modelos animales, cultivos celulares y en estudios poblacionales (17, 20). La evidencia muestra que a nivel hipotalámico, tanto insulina como leptina comparten vías de señalización intracelular y por lo tanto se afectan mutuamente. La resistencia a leptina puede causar inhibición de la señalización de insulina, y la resistencia a insulina causa deficiente señalización a leptina por activación del sistema SOCS (21, 22). De igual forma, la adecuada señalización por insulina potencia la señalización por leptina. Además de afectarse mutuamente, ambos sistemas mantienen relacion estrecha con el eje hipotalámo-hipofisiarioadrenal, con mecanismos inflamatorios y con la respuesta adrenérgica. En un estudio realizado en 36 mujeres y 21 hombres se observó que la sensibilidad a insulina explica el 40% de la variación en leptina sérica en ayuno. Estableciendo un punto de corte de 15 ng/ml de leptina, aumenta la detección de resistencia a insulina en 72% y los sujetos con sobrepeso y obesidad, con niveles de leptina menores a 15ng/dl, son 100% mas sensibles a insulina (23). Apoyando a estos datos, un estudio reciente en adultos mayores, mostró que el nivel sérico de leptina en ayuno, es un indicador independiente para diagnosticar síndrome metabólico (24).
En los modelos de regresión lineal se encontró que el IMC es mejor predictor de la concentración de leptina circulante que el porcentaje de masa grasa, este dato concuerda con lo observado por Martins et al. quienes establecen que en población adulta con obesidad el IMC fue el mejor predictor de los niveles altos de leptina,con un punto de corte de 27.5 kg/m2 con especificidad y sensibilidad del 68,9% y 92,9% respectivamente (16).
Según los datos analizados, presentar sobrepeso u obesidad incrementa el riesgo de sufrir hiperleptinemia aproximadamente 7 veces, mientras que el alto índicede masa grasa aumenta el riesgo aproximadamente 6 veces. Este riesgo fue también descrito por Martins, et al. quienes obtienen OR de 6,00 (1,4- 24,5) para mujeres obesas, con valores de corte de leptina mucho mayores que los propuestos en nuestro estudio (Leptina ≥ 50 ng/ml) (18).
Uno de los espacios fundamentales para realizar cambios en los estilos de vida son los establecimientos educacionales. Los estudiantes universitarios constituyen un grupo de personas relativamente sanas, con un nivel educativo favorable para tomar decisiones informadas y que se encuentran aún en periodo de formación para el cuidado de su salud. La modificación en la distribución del tiempo de los estudiantes universitarios es un factor crítico en el cambio de hábitos, incluyendo sedentarismo y disminución en ingesta de frutas y vegetales. Siendo estas condiciones de riesgo tan prevalentes en entornos educativos para jóvenes adultos, resulta de gran interés su estudio en etapas tempranas.
Estos hallazgos ponen de manifiesto que la modificación hacia hábitos saludables en esta etapa de la vida es de lo más oportuno, cambios que pueden dar lugar a evitar la aparición, o retrasar la progresión, de condiciones metabólicas desfavorables. A la vez evidencian el gran valor de la información que se puede obtener al correlacionar individualmente los valores de IMC y porcentaje de masa grasa con condiciones particulares en cada sujeto, ya sea este sano o se encuentre en condición de riesgo; por esta razón se debe ser muy incisivo en la divulgación del poder que tienen estos parámetros cuando se obtienen de manera sistemática y usando la técnica correcta, ya que proveen al personal médico y paramédico de información valiosa para el cuidado y conservación de la salud de los usuarios de sus servicios.
Se encontró relación positiva significativa entre la concentración de leptina y la composición corporal determinada por IMC, porcentaje de masa grasa y concentración de triglicéridos.
La concentración media de leptina encontrada en este grupo de voluntarios se ubica dentro del rango de cifras normales para concentración de leptina. Las mujeres con obesidad, presentaron concentraciones mayores de leptina comparadas con aquellas dentro del rango de peso considerado normal. El análisis de regresión lineal no permite concluir que el IMC sea mejor predictor de concentración de leptina que el porcentaje de masa grasa en el grupo de estudio, ya que el coeficiente encontrado fue siempre mayor para IMC que para porcentaje de masa grasa, esto se observó tanto en los análisis crudos como en los ajustados para las variables seleccionadas.
El presente trabajo fue apoyado por PROMEP7103.5/12/3953 y FAI C14- FAI-03-34-34.
Recibido: 29-09-2017
Aceptado: 28-11-2017