Diversos compuestos bioactivos de los alimentos se han empleado en el tratamiento alterativo de la diabetes mellitus. El jugo de granada posee un alto contenido en compuestos fenólicos a los cuales se les atribuyen propiedades biológicas como hipolipemiante, hipoglucemiante y protector del tejido pancreático. El objetivo de este estudio fue evaluar el efecto del libre acceso de jugo de granada sobre los niveles de glucosa, colesterol, triglicéridos e integridad del tejido pancreático in vivo. Se emplearon 18 ratas macho Wistar inducidas a hiperglucemia con 60 mg estreptozotocina/kg de peso corporal intraperitoneal (IP). Se formaron tres grupos experimentales. El grupo HS expuesto a solución de sacarosa, el grupo HJG expuesto a jugo de granada y el grupo HSI expuesto a solución de sacarosa y tratamiento con insulina. Los resultados mostraron que, las ratas del grupo HJG consumieron jugo de granada durante 21 días, lo que resultó en la reducción de los niveles de glucosa con respecto a su valor inicial de 417 a 356 mg/dL, no de manera significativa (p>0.05). Los niveles de lípidos mostraron una reducción no significativa al finalizar la intervención (p>0.05). El estudio histológico del páncreas en el grupo HJG mostró conservación de la arquitectura pancreática y presencia de islotes de Langerhans; mientras que el grupo HS mostró extensa necrosis pancreática y el grupo HSI mostró daño intermedio con escasos islotes de Langerhans. Se sugiere que el jugo de granada posee efectos hipoglucemiantes y protege el tejido pancreático en ratas hiperglucémicas inducidas.
Palabras clave: Jugo de granada, diabetes, ratas hiperglucémicas.
Diverse bioactive compounds of foods have been used in the alternative treatment of diabetes mellitus. Pomegranate juice has a high content of phenolic compounds to which biological properties are attributed as lipid-lowering, hypoglycemic and protective of pancreatic tissue. The objective of this study was to evaluate the effect of free access of pomegranate juice on the levels of glucose, cholesterol, triglycerides and the integrity of pancreatic tissue in vivo. Eighteen male Wistar rats were induced to hyperglycemia with 60 mg streptozotocin/kg of body weight intraperitoneal (IP). Three experimental groups were formed. The HS group exposed to sucrose solution, the HJG group exposed to pomegranate juice and the HSI group exposed to sucrose solution and insulin treatment. The results showed that the rats of the HJG group consumed pomegranate juice for 21 days, which resulted in the reduction of glucose levels from its initial value of 417 to 356 mg/dL, not significantly (p>0.05). Lipid levels showed a non-significant reduction at the end of the intervention (p>0.05). The histological study of the pancreas in the HJG group showed conservation of the pancreatic architecture and the presence of islets of Langerhans; while the HS group showed extensive pancreatic necrosis and the HSI group showed intermediate damage with few islets of Langerhans. It is suggested that pomegranate juice has hypoglycaemic effects and protects pancreatic tissue in induced hyperglycemic rats.
Key words: Pomegranate juice, diabetes, hyperglycemic rats.
https://doi.org/10.37527/2018.68.1.003
La diabetes mellitus como parte de las enfermedades no transmisibles con mayor prevalencia a nivel mundial, se encuentra ante una tendencia al incremento sostenido en el número de personas afectadas. En el año 2017 la Federación Internacional de Diabetes indicó que 425 millones de personas en el mundo presentaron diabetes y estimó que esta cifra se incrementará en más de 628.6 millones para el año 2045 (1). La hiperglucemia característica de la diabetes tipo 2 es la responsable de la alta tasa de mortalidad, debido a su asociación con el desarrollo de complicaciones cardiovasculares e infarto (2). Si bien existen una gran variedad de fármacos disponibles para el control de la hiperglucemia; la alimentación continúa siendo un aspecto importante en el control y manejo de la enfermedad (3). Se ha determinado que ciertos compuestos bioactivos de origen vegetal pueden ser beneficiosos en pacientes diabéticos y además se ha sugerido su uso como coadyuvantes en el tratamiento de la diabetes mellitus (4). Entre estos se destacan los compuestos fenólicos, los cuales se encuentran presentes en alimentos de origen vegetal (5). Además de sus atributos sobre las características organolépticas de sabor y color que aportan a los alimentos (6), los polifenoles han sido relacionados con funciones hipoglucemiantes al intervenir sobre el metabolismo de carbohidratos, la función de las células β del páncreas y la disminución de la resistencia a la insulina (7–10). Así como funciones hipolipemiantes al reducir las LDL (lipoproteínas de baja densidad) y su susceptibilidad de agregación (11); y limitar la digestión de las grasas al inhibir las lipasas pancreáticas (12).
La granada (Punica granatum L.) es una fruta con alto contenido de compuesto bioactivos entre los que destacan los polifenoles, vitaminas del complejo B, ácidos orgánicos, ácido ascórbico y algunos minerales (13,14). Por su facilidad de obtención, accesibilidad y diversidad de usos, el jugo de granada resulta ser un derivado de gran importancia. Además, su contenido de compuestos fenólicos es mayor que el de otros jugos de frutas (5).
Diversos estudios científicos han sugerido las propiedades hipolipemiantes (15–17) e hipoglucemiantes (15,16,18,19) del jugo de granada. Sin embargo, los estudios científicos se han dirigido a evaluar el efecto fisiológico del jugo de granada empleando dosis específicas de jugo; que se suministran vía sonda intragástrica en el caso de los animales. Sin embargo, ninguno de ellos se ha interesado en evaluar los efectos fisiológicos a partir de la exposición libre al jugo de granada. Situación que resulta de interés debido a que el jugo de granada posee características de sabor particulares como acidez y astringencia (20) que pudieran determinar no solo su aceptación, sino también su consumo en las dosis y tiempo necesarios para obtener sus efectos funcionales.
Es por ello que el presente trabajo tuvo como objetivo evaluar el efecto del libre acceso a jugo de granada en ratas hiperglucémicas sobre los niveles de glucosa, colesterol y triglicéridos. Así como los cambios histológicos en el tejido pancreático.
Obtención del jugo de granada. El jugo de granada variedad Wonderful se obtuvo mediante la prensión del arilo y filtración de residuos en maquinaria industrial de acero inoxidable. Posteriormente el jugo obtenido fue homogeneizado y envasado en las mismas condiciones para su congelación (-20°C). Conforme fue requerido se descongeló bajo condiciones ambientales estables para su incorporación a los bebederos.
Determinación de los compuestos fenólicos totales. La cantidad de compuestos fenólicos totales en el jugo de granada fueron cuantificados con una técnica reportada previamente (21), a la cual se le aplicaron algunas modificaciones. Estas consistieron en colocar 25 μL de jugo o estándar, 75 μL de agua doble destilada, 25 μL de reactivo de Folin-Ciocalteu Sigma-Aldrich, Co. (1:1 en agua doble destilada), los cuales fueron agitados por 10 segundos a velocidad media, dejándose reposar 6 minutos a temperatura ambiente en la oscuridad; posteriormente se adicionó 100 μL de carbonato de sodio Na2CO3 al 7.5% Sigma-Aldrich, Co. (CAS: 497-19-8), se agitó por 10 segundos a velocidad media y se dejó reposar por 60 minutos a temperatura ambiente en la oscuridad. La absorbancia se registró en un espectrofotómetro UV-Visible Thermo Scientific Multiskan Go 1510 a una longitud de onda de 725 nm. Se utilizó como estándar ácido gálico Sigma-Aldrich, Co. (CAS: 149-91-7). Las concentraciones se expresaron en miligramos equivalentes de ácido gálico por litro (mg EAG/L).
Sujetos. Se emplearon 18 ratas macho de la cepa Wistar experimentalmente ingenuas obtenidas del bioterio del Centro de Investigación Biomédica de Occidente (CIBO) de la ciudad de Guadalajara, Jalisco, México; con edad de 13 semanas y peso corporal entre 250-350g al inicio del experimento. Se mantuvieron bajo control ambiental de 23±2°C y condiciones de 12:12 horas luz/oscuridad, con acceso libre a agua natural y alimento para roedores de laboratorio Rodent Laboratory Chow 5001 (dieta estándar), con un contenido de 23% de proteína, 4.5% de grasa, 6% de fibra, 46.5% de carbohidratos asimilables, 12% de humedad y 8% de minerales totales. El experimento se condujo acorde a la NOM-062-ZOO-1999 sobre las especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio y la guía del cuidado y uso de animales de laboratorio de la National Research Council. El protocolo fue aprobado por el comité de ética del Centro de Investigaciones en Comportamiento Alimentario y Nutrición de la Universidad de Guadalajara.
Diseño y fase experimental. Con el objetivo de obtener datos sobre los sujetos previo a la administración de estreptozotocina, entre la semana 12-13 de edad, se llevó a cabo el registro del consumo de agua y dieta estándar por día; así como determinación del peso corporal y glucosa sanguínea en la semana 13 de edad (preexperimento).
Para la inducción a hiperglucemia experimental se empleó el fármaco estreptozotocina (STZ) (Sigma-Aldrich, Co.) a dosis única de 60 mg de STZ/kg de peso corporal intraperitoneal, diluidos previamente en buffer citrato fresco de 0.1 M con pH 4.5, tras ayuno de 12 horas (22). El día posterior a la inducción se evaluó el estado de hiperglucemia en todos los sujetos mediante la medición de los niveles de glucosa. El quinto día posterior a la inducción se midieron los valores de glucosa, además de colesterol y triglicéridos. Esta determinación se consideró como la cifra inicial en las tres variables. Las muestras de sangre para la determinación de los parámetros bioquímicos pre y post-inducción se extrajeron de la cola empleando un dispositivo plástico de restricción. Para la medición de los niveles de glucosa, colesterol y triglicéridos, se empleó una técnica colorimétrica enzimática con kits de la marca Spinreact, mediante un espectrofotómetro semiautomatizado Merck microlab 200.
El quinto día post-inducción se formaron 3 grupos de 6 ratas hiperglucémicas elegidos de manera aleatoria. El grupo HS (control) estuvo expuesto a condiciones de libre acceso a agua purificada, solución de sacarosa al 16% (SS), es decir, a la misma concentración de grados brix (°Bx) que el jugo de granada y dieta estándar. El grupo HJG fue expuesto a condiciones de libre acceso a agua purificada, jugo de granada (JG) con una concentración de 16°Bx y dieta estándar. El grupo HSI (control positivo) fue expuesto a las mismas condiciones que el grupo HS, además de recibir 2 U de insulina/kg de peso corporal/ cada 12 horas (insulina glargina Lantus®, Sanofi Aventis) vía intradérmica.
El agua, la solución de sacarosa y el jugo de granada se suministraron en bebederos independientes, los cuales fueron sanitizados y rellenados cada 24 horas. Todos los grupos se mantuvieron bajo las condiciones antes mencionadas durante 26 días posteriores a la inducción. En cada uno de los grupos, se llevó a cabo un registro diario de la cantidad de consumo de líquidos y alimento, así como medición del peso corporal cada semana.
Al finalizar la fase experimental se realizó el sacrificio de los sujetos. Previo a ello fueron sedados con Xilacina y anestesiados con Zoletil ® 50. Posteriormente los sujetos fueron decapitados con guillotina. Se recolectaron muestras sanguíneas de cada sujeto que fueron depositadas en un tubo de ensayo y posteriormente se centrifugaron a 3500 rpm durante 3 minutos. Una vez separado el suero, éste fue extraído y almacenado en tubos Eppendorf de 500 μL para determinar nuevamente los niveles de glucosa, colesterol total y triglicéridos.
Estudio histológico. Tras la decapitación y exanguinación, los sujetos se colocaron en una mesa quirúrgica para la disección y extracción del páncreas. El páncreas fue extraído, lavado con solución salina y colocado en formol al 10% durante 8 horas para su fijación. Posterior a la fijación, los tejidos fueron deshidratados y embebidos en parafina. Una vez obtenido el bloque de parafina se cortaron secciones de 4 μm con apoyo del microtomo. Se capturó el corte en un portaobjetos y se pasó a secado, desparafinado e hidratación. En un siguiente paso se tiñó con hematoxilina y eosina. Posteriormente se llevaron a cabo las observaciones con el microscopio (Leica DME biocular).
Análisis estadístico. Para todos los análisis se empleó el paquete estadístico SPSS para Windows versión 15.0. Con un intervalo de confianza del 95%. Los resultados son presentados como promedio ± desviación estándar ( ± DE). Las diferencias se consideraron significativas con un valor p <0.05. Posterior a la obtención de los datos se determinó la normalidad de los parámetros cuantitativos mediante la prueba de Kolmogorov- Smirnov. Para el análisis de las diferencias entre las ratas en su estado de sanas vs hiperglucémicas (Tabla 1) se compararon los valores medios de las variables con la prueba de t de Student para muestras relacionadas. Para determinar las diferencias de consumos y peso corporal entre los grupos de ratas hiperglucémicas (Tabla 2) se aplicó un análisis de varianza (ANOVA) de un factor. Las comparaciones entre los grupos se llevaron a cabo mediante el test post-hoc de Tukey. Para analizar la diferencia entre los valores de glucosa, colesterol y triglicéridos iniciales y finales en los tres grupos se empleó la prueba de t de Student para muestras relacionadas. Además, para determinar las diferencias de las variables bioquímicas se aplicó un test de ANOVA de un factor (Tabla 3) entre los grupos y la prueba posthoc de Tukey. Para conocer la relación entre el consumo de jugo de granada y las variables bioquímicas se empleó el test de regresión de Pearson.

Determinación de compuestos fenólicos. Los promedios de la concentración de polifenoles totales representado como equivalentes de ácido gálico (EAG) entre las 5 repeticiones arrojó un promedio de 4976.46 ± 258.68 mg EAG/L en el jugo de granada utilizado en el experimento.
Diferencias antes y después de la administración de estreptozotocina. El consumo de líquidos en el estado de hiperglucemia incrementó significativamente (p<0.05) con respecto al estado previo, de 40.22±9.51 a 166.7±55.4 mL/día. El consumo de alimento no mostró diferencias significativas antes o después de la inducción a hiperglucemia, siendo de 19.99±5.53 y 21.98±6.44 g/día. Sin embargo, si consideramos que las ratas post-inducción consumieron en promedio 10.28g de azúcares a través de la solución de sacarosa y jugo, estos pudieran considerarse como parte de alimento consumido. Con ello el consumo de nutrientes post-inducción fue mayor con respecto al consumo de alimento pre-inducción. El peso corporal disminuyó aproximadamente en 25% (p<0.05), es decir, de 321.16±52.65 a 243.52±43.23 g cuando las ratas se encontraron hiperglucémicas. Los niveles de glucosa posterior a la inducción incrementaron significativamente (p<0.05) en todos los sujetos de 122±17 a 431±40 mg/dL (Tabla 1).
Consumos y peso corporal. De las intervenciones, el consumo de SS fue significativamente superior (p<0.05) al consumo de JG. Siendo el grupo HSI el que presentó el mayor consumo de SS, ingiriendo en promedio 45 mL más de la intervención que el grupo HJG. Entre los líquidos expuestos a libre acceso, el agua se consumió un 40% y 64% más entre los grupos HS y HJG respectivamente. No así en el grupo HSI, el cual presentó un consumo similar entre el agua y la SS, es decir, 78.18±49.63 y 79.83±22.93 mL/día respectivamente. De los tres grupos, el mayor consumo de agua lo presentó el grupo HS y el menor consumo el grupo HSI, siendo 132.96±56.98 y 78.18±49.63 mL/día. En relación al consumo de líquidos totales, el grupo HS consumió significativamente más líquido (p <0.05) que el grupo HJG, es decir, 211.6±67.3 y 130.5±5.7 mL/día. El consumo de alimento fue superior en el grupo HJG, mientras que en los grupos HS y HSI el consumo fue similar (20.69±8.97 vs. 20.21±6.33 g/día). El peso corporal promedio al final del experimento fue similar entre los grupos HS y HJG, siendo de 223.65±50.17 y 228.12±20.24 g respectivamente. A pesar de que el peso corporal a los 21 días fue mayor en el grupo HSI, no se encontró diferencia estadísticamente significativa con respecto a los grupos HS y HJG (p>0.05) (Tabla 2).
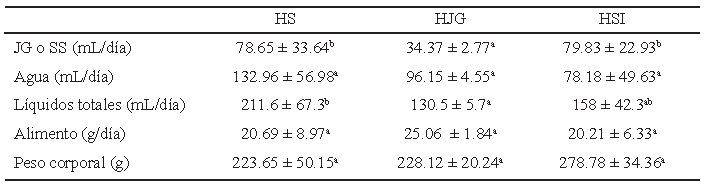
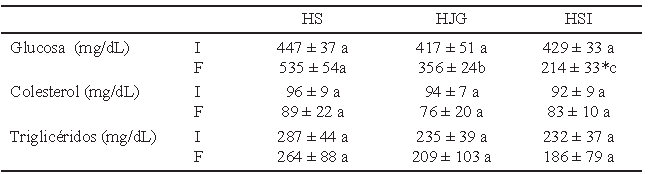
Parámetros bioquímicos. Posterior a la inducción de hiperglucemia, todas las ratas presentaron niveles superiores a los 400 mg/dL. Al iniciar la fase experimental (día 5 postinducción), los niveles de glucosa en los tres grupos no mostraron diferencia estadísticamente significativa. Después del tratamiento (día 26 post-inducción), los niveles de glucosa mostraron diferencias estadísticamente significativas entre los tres grupos (p<0.05); el grupo HSI fue el que presentó los niveles más bajos, mientras que el grupo HS mostró los niveles más altos, siendo de 214±33 y 535±54 mg/dL respectivamente.
Cuando se comparó entre cada grupo el nivel de glucosa al inicio y al final de la intervención, solamente el grupo HSI mostró una diferencia significativa (p<0.05) con respecto al inicio de la fase experimental, de 429±33 a 214±33 mg/dL. El grupo HJG redujo sus niveles de glucosa en promedio 61 mg/dL, de 417±51 a 356±24 mg/ dL, sin que esta diferencia fuese estadísticamente significativa (p>0.05). Mientras que el grupo HS incrementó sus niveles de glucosa en promedio 88 mg/dL al finalizar la fase experimental, de 447±37 a 535±54 mg/dL. Respecto a los niveles de colesterol y triglicéridos se determinó que, al finalizar la fase experimental todos los grupos mostraron una disminución con respecto al valor inicial; sin embargo, no se obtuvo diferencia significativa entre los valores iniciales y finales, ni entre los grupos (p>0.05). (Tabla 3)
Relación consumo-parámetros bioquímicos. Las ratas hiperglucémicas del grupo HJG presentaron consumos diarios de JG con rangos entre 135-163 mL/kg de peso corporal. Al aplicar el test de regresión de Pearson, esté mostró que no hubo una relación lineal entre el consumo de JG (mL/kg de peso corporal) y los niveles de glucosa (r2 = 0.01, p>0.05), colesterol (r2 = 0.1, p>0.05) y triglicéridos (r2 = 0.02, p>0.05).
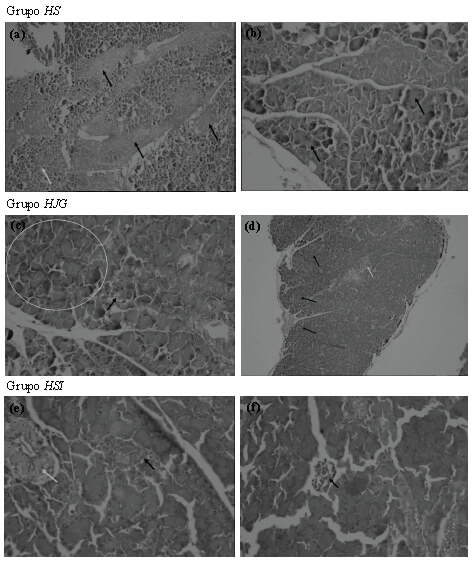
Estudio histológico. Tras la observación microscópica, los páncreas de las ratas del grupo HS mostraron alteración de la arquitectura pancreática con daño acinar severo, pérdida de los islotes de Langerhans y extensas zonas de necrosis; en las ratas del grupo HJG se mostró arquitectura pancreática conservada, escasas zonas de necrosis focal con disminución de los islotes de Langerhans; mientras que en los páncreas del grupo HSI se apreció alteración de la arquitectura pancreática con necrosis pancreática de predominio periférico y escasos islotes de Largerhans con cambios atróficos. La Figura 1 muestra las observaciones microscópicas representativas para cada grupo experimental.
La condición de libre acceso a jugos de frutas con propiedades funcionales ha sido poco estudiada. Reportes previos han demostrado que la exposición a jugo de granada a libre acceso representó un mecanismo de defensa antioxidante (23). Con el libre acceso a jugo de fruta de palma, se demostró su propiedad hipoglucemiante (24). Mientras que la exposición a jugo de uva (25) disminuyó el estrés oxidativo.
A pesar de las características organolépticas de acidez y astringencia del jugo de granada (20), tras 21 días de exposición a libre acceso, los sujetos experimentales mantuvieron el consumo del jugo de manera constante. Además, la reproducción del modelo animal de hiperglucemia inducida se conservó en concordancia con lo reportado por otros autores, al presentarse síntomas de polidipsia, hiperglucemia sostenida y pérdida de peso (26). Una explicación a la pérdida de peso puede deberse a la utilización de combustibles grasos y la incapacidad de metabolizar carbohidratos (27). Si bien, las ratas hiperglucémicas no presentaron un incremento estadísticamente significativo en el consumo de alimento (dieta estándar), si mostraron un incremento en el consumo de nutrientes considerando los azúcares de la solución de sacarosa y el jugo.
Por otro lado, los estudios que han evaluado las propiedades hipoglucemiantes e hipolipemiantes del jugo de granada en modelos animales son limitados (15,16,18,19). La presente investigación se planteó determinar la existencia de estas propiedades cuando el jugo de granada es expuesto para su consumo a libre acceso a ratas hiperglucémicas inducidas. Tras la exposición a libre acceso del grupo HJG al jugo de granada durante 21 días, se redujeron los niveles de glucosa en 61 mg/dL con respecto al valor inicial, reduciendo de 417 a 356 mg/dL. Esta reducción concuerda con investigaciones previas que han suministrado 5 mL/kg de peso corporal de jugo de granada vía sonda orogástrica diariamente durante 4 semanas a ratas hiperglucémicas, encontrando una reducción significativa en promedio de 63 mg/dL de glucosa, con respecto a los niveles de glucosa del grupo control, de 227 a 164 mg/dL (16). Otros reportes han suministrado durante 4 semanas diferentes dosis de jugo de granada a ratas hiperglucémicas inducidas; con ello lograron una reducción significativa de los niveles de glucosa con respecto al valor inicial. Al suministrar 1 mL/200 g de peso corporal disminuyeron de 479 a 130 mg/dL; con 2 mL/200 g de peso corporal, de 415 a 82 mg/dL y con 4 mL/200 g de peso corporal, de 397 a 144 mg/dL (18). Por otro lado, la administración de 1 mL de jugo de granada diario por 21 días a ratas hiperglucémicas inducidas se obtuvo una reducción promedio de 21 mg/dL de glucosa en comparación con el grupo control, disminuyendo de 321 a 300 mg/dL (15). Mientras que, la administración forzada de 1, 2 y 4 centímetros cúbicos de jugo de granada a ratas inducidas a hiperglucemia durante 21 días representó la disminución significativa de los niveles de glucosa en todas las dosis (19).
Es evidente que, a pesar de la reducción de los niveles de glucosa en todos los experimentos anteriores, no existe homogeneidad en los resultados obtenidos. Un estudio previo obtuvo una reducción similar a nuestro experimento en relación a la cantidad de mg/dL de glucosa; sin embargo, en este estudio compararon los valores con su grupo control hiperglucémico sin ninguna intervención (16). En nuestro caso, la diferencia en los niveles de glucosa fue comparado con los niveles iniciales (previo a la exposición de jugo) del mismo grupo. Si los valores finales de glucosa del grupo HJG se hubiesen comparado con el grupo control HS, como lo hacen otros experimentos, la diferencia sería aún mayor. Siendo así, los valores de glucosa hubieran disminuido en promedio 179 mg/dL, es decir, la diferencia entre 535 y 356 mg/dL del grupo control y el grupo expuesto a jugo. Adicional a ello, otras evidencias reportadas distan de lo obtenido en este experimento; pues la exposición a diferentes dosis de jugo de granada logró que las ratas hiperglucémicas obtuvieran cifras de glucosa prácticamente dentro de parámetros normales. Con descensos entre los 253-349 mg/dL (18). Bastante superior a lo obtenido en nuestro experimento.
Respecto a los niveles de lípidos, se ha reportado reducciones significativas en los niveles de colesterol de 162 a 138 mg/dL y de triglicéridos de 141 a 112 mg/dL con respecto al grupo control, tras suministrar durante 4 semanas 5 mL/kg de peso corporal de jugo de granada a ratas hiperglucémicas (16). Igualmente, se ha obtenido reducción significativa de los niveles de colesterol y triglicéridos tras la administración de 1 mL de jugo de granada por 21 días a ratas hiperglucémicas, en comparación con el grupo control (15). Mientras que otro reporte indicó la reducción en los niveles de colesterol y triglicéridos tras suministrar diferentes dosis de jugo de granada a ratas hiperglucémicas durante 4 semanas, sin embargo, esta reducción no fue estadísticamente significativa (18).
En el presente experimento se obtuvo uno reducción no significativa de los niveles de colesterol y triglicéridos posterior a la exposición al jugo de granada del grupo HJG, con respecto al valor inicial y con respecto al grupo control HS. Sin embargo, dado que en todos los grupos fue determinado el valor inicial y final de lípidos, es de mencionarse que todos los grupos presentaron valores inferiores a la cifra inicial. Con respecto a ello, otros estudios no reportan los valores iniciales de los grupos, por lo que sus resultados se han comparado únicamente con respecto al grupo control (15,16). Solo un estudio previo presenta resultados similares a los nuestros, al reportar las cifras iniciales de lípidos y encontrar disminución con respecto al valor inicial (18).
A partir de la disparidad entre las evidencias, cabe ahondar en los diversos factores que podrían relacionarse o afectar la respuesta hipoglucemiante. Por ejemplo, los valores iniciales de glucosa son un factor determinante para la evaluación del potencial hipoglucemiante del jugo de granada. En un experimento se determinó que la respuesta al efecto hipoglucemiante del jugo de granada fue mayor en aquellos pacientes que inicialmente tenían niveles de glucosa menores, en promedio 221 contra 142 mg/dL (28). Es por ello que se enfatiza en la necesidad de comparar los efectos de las intervenciones no solo con el grupo control, si no con los niveles iniciales del mismo grupo expuesto al alimento. En el caso de los modelos animales inducidos a hiperglucemia a partir de estreptozotocina, diversos factores como la especie animal, cepa, edad, género; así como la dosis y la ruta de administración, influyen en el efecto generado por la STZ (29). Es de considerarse la respuesta inicial al fármaco, es decir, los niveles de glucosa post-inyección, tanto de los grupos experimentales como del control.
Adicionalmente, los factores atribuidos al alimento que se evalúa deben ser considerados. Tanto la cantidad de polifenoles consumidos, la matriz del alimento que lo contiene, así como la biodisponibilidad en el organismo son determinantes que se relacionan con su efecto funcional (6). En este caso, la cuantificación de los compuestos fenólicos totales del jugo de granada, se reportó en 4976 ± 258 mg EAG/L (equivalentes de ácido gálico/L). Lo que concuerda con lo reportado previamente en el jugo de granadas variedad Wonderful (30).
En cuanto a la biodisponibilidad de los polifenoles en el organismo, es decir, la proporción que es digerida, absorbida y metabolizada; es posible encontrar variaciones entre los diferentes compuestos debido a sus diferencias en la estructura química, las cuales pueden afectar su absorción en las diferentes áreas del intestino, su metabolización hepática, su transporte y concentración plasmática, o su eliminación vía renal o biliar. Es decir, que una gran cantidad de polifenoles no significa que todos serán biodisponibles para el órgano de interés. Por otra parte, la matriz del alimento puede afectar la disponibilidad de estos compuestos, ante la posibilidad de que el alimento pueda contener otros elementos como proteínas, que afecten su primer paso hacia la absorción. De tal manera que la concentración de polifenoles en plasma dependerá tanto de la naturaleza del compuesto fenólico como del alimento del que proviene (6).
Por otra parte, el abordaje de las propiedades hipoglucemiantes de los polifenoles sugiere que estos metabolitos además de ser capaces de inhibir la actividad de las enzimas α-amilasa y α-glucosidasa; pueden estimular la secreción de insulina (9). En particular, los estudios sobre los mecanismos de acción hipoglucemiante de la granada sugieren el incremento en la secreción de insulina tras la protección y regeneración del tejido pancreático, que condiciona un incremento en la función de las células β (28,31,32). Parte de este efecto se ha corroborado a través de la observación microscópica del tejido pancreático. En el presente experimento, tras 21 días de intervención, las ratas del grupo HS mostraron daño severo al páncreas al presentar extensa necrosis, el grupo HSI mostró un daño intermedio tras presentar necrosis pancreática periférica y presencia de escasos islotes de Largerhans; mientras que las ratas del grupo HJG expuesto a jugo de granada mostraron protección contra el daño al tejido pancreático manifestado por conservación de la arquitectura pancreática y presencia de islotes de Langerhans. Por su parte, un estudio reportó que la exposición a 1 mL de jugo de granada durante 21 días a ratas hiperglucémicas representó un incremento en el número y tamaño de los islotes de Langerhans en comparación con el grupo control (15). Efectos similares se han reportado con otros derivados de la granada. Con dosis de 400 mg/kg de extracto metanólico de granada y dosis de 25 y 50 mg/kg de ácido valoneico aislado del extracto metanólico de granada se observó daño acinar intermedio con presencia de suficientes islotes de Langerhans, lo que significó protección contra el daño pancreático tras la inducción de hiperglucemia con alloxan (31). Mientras que, la dosis de 0.43 g/ kg de peso corporal de extracto acuoso de corteza de granada administrado diariamente durante 4 semanas a ratas hiperglucémicas inducidas, generó el incremento en el número de células β pancreáticas (32).
A partir de las evidencias cabe resaltar el hecho de las discordancias entre los escasos estudios que han evaluado el efecto hipoglucemiante del jugo de granada. A pesar de que se han encontrado efectos positivos de las intervenciones con jugo de granada, se precisa la necesidad de realizar experimentos que integren evaluaciones tanto en humanos como in vitro, con los cuales se pueda dar respuesta más precisa sobre el potencial efecto hipoglucemiante del jugo de granada y la cantidad necesaria para ejercer un efecto sobre la salud. Así como los mecanismos de acción necesarios y los factores relacionados tanto al alimento como al organismo que interfieren en su efecto bioactivo.
Posterior a la exposición al jugo de granada a libre acceso, las ratas hiperglucémicas mantuvieron su consumo durante los 21 días, con lo cual se observó una tendencia a la reducción de los niveles de glucosa, en relación tanto a sus niveles iniciales como a los niveles de glucosa del grupo control. Histológicamente se observó arquitectura pancreática conservada y presencia de islotes de Langerhans con la ingesta de jugo de granada. Escasas evidencias previas con el jugo de granada muestran algunas discordancias entre sí. Con los resultados obtenidos en este experimento, se sugiere que el jugo de granada posee efectos hipoglucemiantes y protege el tejido pancreático en ratas hiperglucémicas inducidas. Sin embargo, se precisa la necesidad de más experimentos que evalúen el efecto hipoglucemiante del jugo de granada y su mecanismo de acción tanto in vivo como in vitro.
Proyecto financiado por la Universidad de Guadalajara (SAC/CI/004/16).
Recibido: 07-02-2018
Aceptado: 14-03-2018