Se han encontrado compuestos bioactivos en frutas y vegetales con efecto favorable en la prevención de enfermedades crónicas como cáncer y Alzheimer, que también están presentes en la quinua. Son necesarios realizar estudios para evaluar el potencial benéfico in vivo. El objetivo fue determinar la influencia del consumo de tres variedades de quinua (Chenopodium quinoa Willd.) sobre la acumulación de tejido adiposo y actividad antioxidante en tejidos de ratas obesas. 42 ratas obesas Holtzman fueron divididas en siete grupos. Con excepción del control, los otros grupos fueron alimentadas, durante 23 días, con dietas obesogénicas conteniendo 20% quinua variedad Altiplano, Pasankalla o Negra Collana, procesadas por cocción o tostado. Al finalizar el período de alimentación, la grasa visceral (GV) y abdominal (GA) fueron pesadas y se extrajo muestras de hígado e intestino delgado (ID) siendo almacenadas (–20°C) para posteriores análisis de actividad antioxidante. Se midieron capacidad antioxidante y contenido de polifenoles totales en quinuas procesadas. Se aplicó ANOVA utilizando el modelo lineal generalizado para diseño completamente randomizado con arreglo factorial 3x2+Control; y test de Fisher mediante el programa Minitabv.17.1.0. La GV, GA y peroxidación lipídica del ID no fueron afectadas significativamente (P>0.05) por las dietas experimentales; sin embargo, la peroxidación lipídica en el hígado de ratas que consumieron dietas con quinua fue significativamente menor (P<0.05) que el control. En conclusión, la alimentación de ratas obesas con dietas que contienen variedades de quinua procesada no afecta la acumulación de GV y GA; sin embargo, reduce la peroxidación lipídica en el hígado.
Palabras clave: Quinua, tejido adiposo, peroxidación lipídica.
Bioactive compounds with favorable effect in the prevention of chronic diseases such as cancer and Alzheimer are found in fruits and vegetables and are also present in quinoa. Studies are needed to evaluate the potential benefits in vivo. The objective was to determine the influence of the consumption of three varieties of quinoa (Chenopodium quinoa Willd.) on the accumulation of adipose tissue and antioxidant activity in tissues of obese rats. Forty two obese Holtzman rats were divided into seven groups. With exception of the control, the other groups were fed, during 23 days, with obesogenic diets containing 20% quinoa Altiplano, Pasankalla or Negra Collana, processed by cooking or roasting. At the end of the feeding period, visceral (VF) and abdominal fat (AF) were weighed and samples of liver and small intestine (SI) were extracted and stored (-20°C) for further analysis of antioxidant activity. Antioxidant capacity and total polyphenol content were measured in the processed quinoa. Applied ANOVA using the generalized linear model for a completely randomized design with a factorial arrangement 3x2+Control; and Fisher’s test through the statistical program Minitab v.17.1.0. VF, AF and lipid peroxidation of SI were not significantly influenced (P>0.05) by the experimental diets; however, lipid peroxidation in the liver of rats consuming quinoa containing-diets was significantly lower (P <0.05) than control group. In conclusion, feeding obese rats with quinoa containing-diets do not affect the accumulation of VF and AF; however, it reduce lipid peroxidation in the liver.
Key words: Quinoa, adipose tissue, lipid peroxidation.
https://doi.org/10.37527/2018.68.2.003
La obesidad resulta del desequilibrio entre la ingesta de alimento y el gasto calórico, y es considerada un problema de salud pública que es generada por múltiples factores entre ellas, la globalización que mejora la disponibilidad de alimentos con alto contenido calórico, la tecnología que genera actividades sedentarias que reducen el gasto calórico del individuo, y la industrialización de alimentos que evoluciona para aumentar el consumo de productos haciéndolos más apetecibles al aumentar su contenido en grasa y carbohidratos (1).
Una forma de enfrentar esta problemática es mediante el consumo de una dieta balanceada que incluya todos los grupos de alimentos especialmente aquellos considerados alimentos funcionales que contienen compuestos bioactivos, los cuales actúan sobre las vías de señalización implicadas en la respuesta inflamatoria (2) y son utilizados en el tratamiento y prevención de enfermedades no transmisibles como cáncer, enfermedad coronaria, accidente cerebrovascular y enfermedades degenerativas como Alzheimer (3–4).
En nuestro país existe una gran biodiversidad de alimentos, que pueden ser incluidos en la dieta para mejorar los hábitos alimenticios, como la quinua por sus características nutricionales y su contenido de compuestos bioactivos, como flavonoides y ácidos fenólicos (5); cuyo consumo tradicional es mediante cocción y tostado, que se realizan con la finalidad de mejorar la textura y palatabilidad, sin embargo, afectan la composición y concentración de los compuestos bioactivos (6). Además, se ha demostrado que las variedades de color poseen mayor concentración de compuestos bioactivos en comparación a las de color blanca, atribuibles a γ-tocoferol y luteína (7), que ejercen efecto al ser ingeridos como parte del alimento y que aún no han sido estudiadas in vivo.
Por ello, el objetivo es determinar la influencia del consumo de tres variedades de quinua (Chenopodium quinoa Willd.) sobre la acumulación del tejido adiposo y actividad antioxidante en tejidos de ratas obesas.
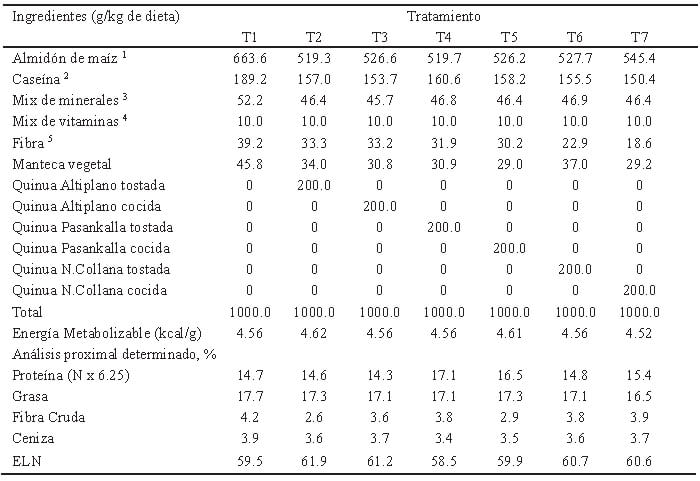
Las variedades peruanas de quinua Altiplano, Pasankalla y Negra Collana adquiridas del mercado local, fueron lavadas de forma manual para su respectivo procesamiento. Para el proceso de cocción se agregaron los granos en agua destilada hirviendo 1:10, siendo drenados después de 20 minutos (6); mientras que el tostado se realizó a fuego directo a 120°C/20 minutos hasta obtener una coloración oscura. Las quinuas procesadas por cocción fueron secadas a 60°C/3 horas (Memmert, Modelo UF55) hasta una humedad de 7% para ser molidas.
La composición proximal de las muestras de quinua procesada incluyó la determinación del contenido de proteína total, grasa, fibra cruda y cenizas, los cuales se realizaron empleando los métodos oficiales de la AOAC. (8)
Se extrajo 5 g de muestra tamizada (Haver&Boecker, ModeloASTM–E11 250 μm) para someterlas a extracción con etanol al 40% durante 24 horas, posteriormente se centrifugó (Kert Lab, Modelo 0412-1) a 2500 rpm/5min y se extrajo el sobrenadante para los análisis correspondientes (9).
La cuantificación de polifenoles totales se hizo según Singleton et al. (10), a 100 μL de extracto de quinua procesada se le adicionaron 150 μL de Folin Ciocalteu, después de cinco minutos se añadieron 150 μL de Na2CO3 (20%) y se completó a 1 mL con agua bidestilada, después de 30 minutos a temperatura ambiente se realizó la lectura a 760 nm (Spectro PC Doble UV–Vis, Modelo UVD–2950). Se utilizó como patrón el ácido gálico (AG) y los resultados se expresaron como mg AG/g muestra.
La capacidad antioxidante equivalente al Trolox se midió mediante el método de DPPH (TEAC-DPPH), un radical libre estable 2,2–difenilpicrilhidrazilo de coloración púrpura, según Joyeux et al. (11). Para ello se extrajo 0.4 ml de extracto de la quinua procesada y 0.8 ml de DPPH, y se llevó a oscuridad durante 30 minutos. Finalmente, se realizó la lectura a 517 nm (Spectro PC Doble UV–Vis, Modelo UVD–2950) y los resultados fueron expresados en mg Trolox/g muestra.
Se emplearon 42 ratas machos de la cepa Holtzman de 60 días de edad, provenientes del Bioterio de la Facultad de Zootecnia, Universidad Nacional Agraria La Molina, fueron colocados al azar en jaulas individuales y alimentadas con dieta obesogénica durante 30 días hasta cumplir los lineamientos somáticos de obesidad (12). Posteriormente, fueron divididas en siete grupos que recibieron, durante 23 días, dietas obesogénicas sin o con inclusión de quinua procesada (20%): dieta control sin quinua (T1), Altiplano tostada (T2), Altiplano cocida (T3), Pasankalla tostada (T4), Pasankalla cocida (T5), Negra Collana tostada (T6) y Negra Collana cocida (T7).Todos los procedimientos siguen los lineamientos del Centro Interdisciplinario de Estudios en Bioética de la Universidad de Chile para el cuidado y uso de animales de laboratorio (13).
Las dietas experimentales (Tabla 1) se elaboraron según el Requerimiento de Nutrientes de Animales de Laboratorio basados en una dieta de mantenimiento (14), siendo las dietas y el agua administradas ad libitum.
Al finalizar el periodo experimental y luego del ayuno pertinente, los animales fueron anestesiados (empleando Ketamina y Xilacina) para realizar las mediciones de circunferencia torácica, circunferencia abdominal, longitud naso–anal, índice de Lee (IL) e índice de Masa Corporal (IMC) (12).
Se removió y registró el peso del tejido adiposo considerando grasa subcutánea abdominal y grasa visceral como la suma de grasa gonadal, mesentérica y retroperitoneal (15).
Se extirpó un 1 g de hígado, se lavó con suero fisiológico y se realizó el homogeneizado (Tissue Tearor, Modelo 98530) con buffer fosfato salino. Se centrifugó (Kert Lab, Modelo 0412-1) a 2500 rpm/15 min y se extrajo el sobrenadante para su análisis, todo el procedimiento se trabajó en baño de hielo (16). Del mismo modo se procedió con las muestras de yeyuno del intestino delgado.
La actividad antioxidante de hígado e intestino delgado se determinó mediante análisis de especies reactivas al ácido tiobarbitúrico (TBARS), según Buege y Aust. (17) con ligeras modificaciones. Se empleó ácido tricloroacético para la precipitación de proteínas y el ácido tiobarbitúrico para la formación del complejo de color. La absorbancia se midió a 535 nm (Spectro PC Doble UV—Vis, Modelo UVD-2950). Los resultados fueron calculados utilizando el coeficiente de extinción molar 1.56 x 105 M-1cm-1, siendo expresados como nmol MDA/g tejido.
Se determinó empleando el compuesto ácido 2,2’-azino-bis-3-etillbenzotiazolin-6-sulfonico (ABTS), para la formación del radical libre catiónico ABTS*+ generado en reacción con el persulfato de potasio. Según Re et al. (18), este radical en presencia de antioxidantes es reducido en función de la concentración del antioxidante y de la duración de la reacción. El tubo de reacción contenía 980 μl de solución ABTS*+ y 20 μl de tejido homogenizado. La lectura se realizó después de 7 minutos de reposo en oscuridad a 734 nm (Spectro PC Doble UV–Vis, Modelo UVD–2950). La magnitud de la decoloración es expresada como porcentaje de inhibición del radical ABTS*+.
Los datos de actividad y capacidad antioxidante de granos y tejidos, somatometría e histomorfometría fueron analizados mediante Diseño Completamente Randomizado con análisis factorial 3x2+1, y se realizó la prueba de Fisher para determinar si existieron diferencias significativas entre los tratamientos, valores de P≤0.05 fueron considerados estadísticamente significativos, mediante el paquete estadístico Minitab v.17.1.0.
Se determinó la correlación de Pearson para establecer si existió una relación lineal entre los tratamientos a evaluar para actividad y capacidad antioxidante de granos y en tejidos.
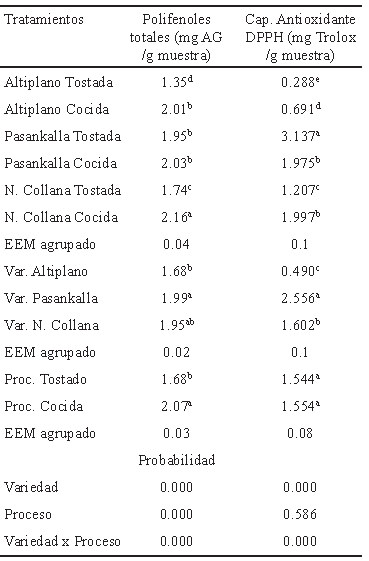
El contenido de polifenoles de las variedades coloreadas de quinua Pasankalla y Negra Collana fueron significativamente mayores (P<0.01) en comparación a Altiplano (Tabla 2). Asimismo, la capacidad antioxidante de la variedad Pasankalla exhibió el mayor valor con alta significanci a (P<0.01), esto se correlaciona con su mayor contenido de compuestos fenólicos en relación a las otras variedades; además, se determinó que existe interacción entre variedad y proceso a favor de Pasankalla tostada (P<0.01).También se determinó que existe una correlación positiva moderada entre PT y TEAC para las variedades de quinua cocida (Pearson=0.5982, r2=0.3578) y una correlación positiva directa para las quinuas tostadas (Pearson=0.9140, r2=0.8353).
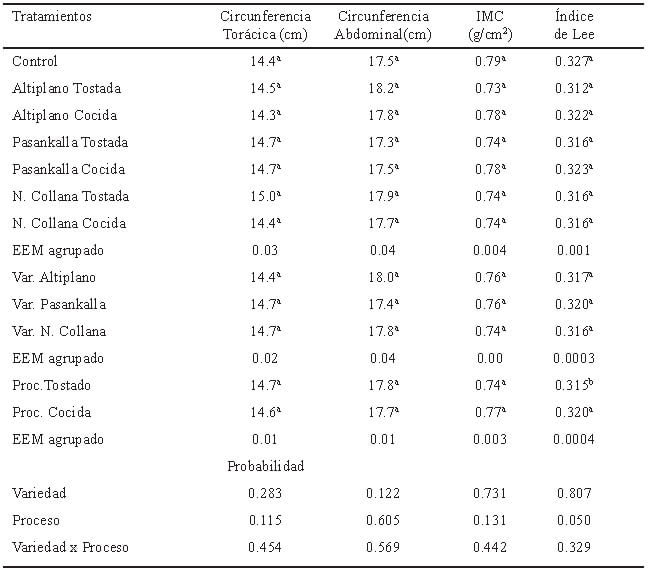
Las ratas fueron recibidas con un peso corporal de 127.0 ±21.3 g y un estado de nutrición “normal o sano” (Índice de Lee=0.28, IMC=0.47 g/cm2), a las que se indujo obesidad mediante el consumo de dieta obesogénica logrando un peso corporal de 352.7±19.7 g (Índice de Lee=0.32, IMC=0.74 g/cm2). Asimismo, se evidenció que los grupos evaluados incluido el grupo control se encontraban dentro de la clasificación de obesidad (Tabla 3), lo que indicó que el consumo de quinua no ejerció efecto sobre la ganancia de peso en animales obesos. Similar resultado se obtuvo en ratas no obesas alimentadas con quinua cruda y tostada en comparación a una dieta con caseína (19). Sin embargo, con referencia al IL, se obtuvieron diferencias significativas (P=0.050) para el factor proceso con un menor valor en el grupo de quinua cocida. Malafaia et al.(15) determinaron valores inferiores a los obtenidos para el IMC (0.70 ±0.01g/cm2) en un experimento en ratas con obesidad inducida por dieta alta en grasa al 30% y suplementadas con solución de sacarosa al 30%.
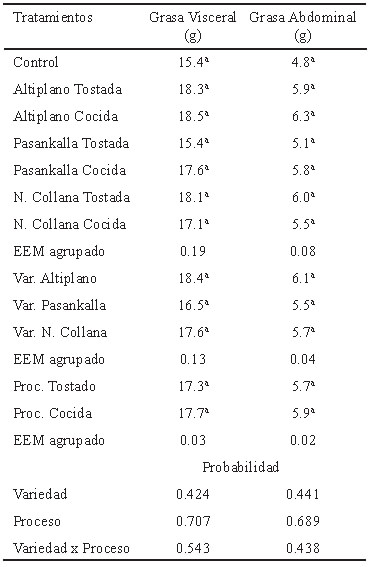
Las mediciones de acumulación de tejido adiposo no presentaron diferencias entre los grupos; sin embargo, el grupo tratado con la variedad Pasankalla presentó menor acumulación a nivel visceral y abdominal (Tabla 4).
No se obtuvieron diferencias (P>0.05) para actividad antioxidante en el intestino delgado. Sin embargo, si se determinaron diferencias para la peroxidación lipídica del hígado (Tabla 5) siendo significativamente menores (P<0.01) en los grupos que consumieron quinua procesada en comparación al control. Asimismo, la capacidad antioxidante en el hígado también presentó diferencias altamente significativas a favor de las variedades Altiplano y Pasankalla (P<0.01); además, se encontraron diferencias (P<0.05) a favor del proceso de tostado, lo que indica que dichas variedades tendrían mayor contenido de compuestos fenólicos.
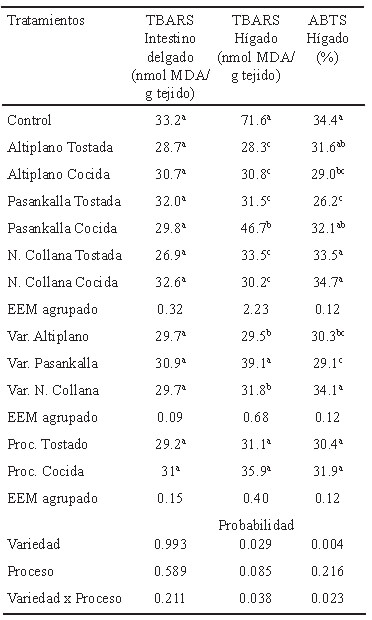
El alto contenido de polifenoles de las variedades coloreadas está relacionado con altos niveles de compuestos bioactivos (6), que en su mayoría corresponden a la presencia de luteína y γ–tocoferol (7); determinándose que a mayor contenido de polifenoles mayor capacidad antioxidante. Por otro lado, el contenido de polifenoles totales de quinua cruda es de 0.60 mg Eq-AG/g según lo reportado por Gorinstein et al. (20) es menor a los valores obtenidos en la investigación (1.68 y 2.07 mg Eq-AG/g para quinuas tostadas y cocidas, respectivamente) para las quinuas procesadas, lo que significa que el procesamiento modifica el contenido produciéndose un incremento, siendo significativo a favor del proceso de cocción en comparación al tostado. La correlación positiva moderada entre PT y TEAC de granos de variedades de quinua procesadas está relacionada con la alta presencia de compuestos fenólicos. Otros estudios sugieren diferentes niveles de correlación entre estos; por ejemplo, en eco tipos de quinua procedente del Japón y Bolivia esta correlación fue débil, r2=0.2049 (21), mientras que en muestras de quinua procedente de Perú se determinó que a mayor contenido de polifenoles totales se incrementa la actividad antioxidante, r2=0.8723 (22), esta diferencia puede ser por el tipo de suelo, cultivo, etc. El conocer la capacidad y actividad antioxidante de los alimentos es muy importante, ya que pueden ser incluidos en la dieta para la prevención de factores de riesgo de enfermedades crónicas en humanos, tal como sostienen Valtueña et al. (22) quienes determinaron que dietas equilibradas de alimentos con alta capacidad antioxidante reducen la inflamación sistémica y hepática sin afectar los biomarcadores antioxidantes, reduciendo potencialmente los factores de riesgo de enfermedades crónicas.
El uso de roedores como animales de experimentación permite simular enfermedades humanas, para comprender sus causas y síntomas e incluso establecer posibles intervenciones terapéuticas (23). La ganancia de peso fue mayor en los grupos con quinua procesada en comparación al control, similar resultado se obtuvo en ratas alimentadas con harinas de quinua germinada y fermentada tostada, evidenciando así que la inclusión de éstas no ejerce influencia negativa sobre las características sensoriales de las dietas (24).
A pesar de que no se obtuvieron diferencias entre lineamientos somáticos, los valores del IMC superan lo establecido en las curvas de referencias para el crecimiento físico de ratas machos (IMC=0.56 g/cm2) en función a edad cronológica y maduración somática (25).
La acumulación de grasa visceral obtenida fue mayor a lo reportado por Mashmoul et al. (26), quienes obtuvieron 9.53 g en ratas con obesidad inducida con dietas altas en grasa. Esta respuesta correspondería al prolongado consumo de dieta alta en grasa, que originaría un cambio en la flora intestinal, asociado con un incremento de la permeabilidad intestinal, esto a su vez incrementa la absorción de lipopolisacáridos, consecuentemente incrementa la endotoxemia desencadenando la inflamación y desórdenes metabólicos (27).
Los valores obtenidos de TBARS en el intestino no presentan diferencias entre los grupos evaluados. Ciertamente, se hubiera esperado una significativa protección de las variedades coloreadas; sin embargo, los resultados de los análisis químicos de las capacidades antioxidantes de las variedades de quinua no guarda relación con la protección. Es sabido que los compuestos polifenólicos siguen un proceso de absorción complejo y variado, razón por la que la biodisponibilidad no ha sido la esperada o probablemente el contenido de los polifenoles de la variedadAltiplano ha sido suficiente para estimular los sistemas de defensa antioxidante en el animal. En el hígado se determinó un efecto positivo de una mayor protección en la peroxidación lipídica, con diferencias significativas marcadas entre las variedades de quinua en comparación al grupo control.
Otro estudio (28) reportó resultados similares (27.3 ±2.9 nmol/g tejido) cuando las ratas fueron alimentadas con dietas altas en grasa conteniendo manteca y siendo suplementada con bajo contenido de vitamina E (≤5 mg/kg de peso).
La alimentación de ratas obesas con dietas que contienen diferentes variedades de quinua procesada reduce la peroxidación lipídica en el hígado comparado al grupo control; sin embargo, el consumo de quinua procesada no redujo los lineamientos somatométricos la acumulación de grasa visceral y abdominal, es decir, no disminuyó la condición de obesidad en los animales.
A la Dra. Mary E. Penny, Investigadora Titular del Instituto de Investigación Nutricional, por su apoyo en la revisión del artículo de investigación.
Al Fondo Nacional de Desarrollo Científico y Tecnológico del Consejo Nacional de Ciencia, Tecnología e Innovación Tecnológica (FONDECyT–CONCyTEC) por su financiamiento al presente estudio bajo el Convenio de Subvención Nº 275–2015– FONDECyT–PERÚ.
Recibido: 24-04-2018
Aceptado: 26-08-2018