Dentro de los patotipos de Escherichia coli, el grupo STEC puede producir en el ser humano desde diarrea hemorrágica hasta insuficiencia renal aguda e incluso la muerte; el ganado bovino es el principal reservorio de este agente patógeno y por ende la ingestión de alimentos derivados de estos animales de abasto son una fuente muy importante de infección para el hombre. El objetivo principal de este estudio fue determinar la prevalencia de STEC en muestras de carne cruda comercializada en Pamplona-Colombia y en cepas obtenidas a partir de las muestras. Se analizaron cien muestras de carne cruda aplicando la técnica de Reacción en Cadena de la Polimerasa para la detección de los siguientes genes en muestras y en cepas STEC: stx1, stx2, eae y hlyA. Adicionalmente, se estableció el patrón de resistencia-susceptibilidad antibiótica de cepas STEC aisladas empleando métodos regulados. En el 39% de las muestras fue posible detectar el gen stx2; en el 38%, de ellas, se detectaron los genes stx1 y stx2. Además, se aislaron cepas STEC en el 13% de las muestras analizadas, 85% de ellas portaban el gen hlyA. No se detectó la presencia del gen eae o del serogrupo O157. Las cepas aisladas demostraron resistencia frente a algunos antibióticos de primera y segunda generación. En conclusión, se detectó la presencia de genes que codifican factores de virulencia en las muestras de carne analizadas que representan un riesgo potencial para la salud de los consumidores. Este es el primer reporte de STEC no O157 que codifica el gen de la enterohemolisina en alimentos en Colombia. ALAN, 2019; 69(1): 59-67.
Palabras clave: Enterohemolisina, Escherichia coli, carne, STEC no-O157, Toxina Shiga.
Within the Escherichia coli patotypes, the STEC group can produce in humans from hemorrhagic diarrhea to acute renal failure and even death; cattle are the main reservoir of this pathogen and therefore the ingestion of food derived from these stock animals are a very important source of infection for man. The main objective of this study was to determine the prevalence of STEC in raw meat samples marketed in Pamplona-Colombia and in strains obtained from those samples. One hundred raw meat samples were analyzed using the Polymerase Chain Reaction technique for the detection of the following genes in samples and in STEC strains: stx1, stx2, eae and hlyA. In addition, STEC strains were isolated in 13% of the analyzed samples, 85% of them carried the hlyA gene. The presence of the eae gene or serogroup O157 was not detected. The isolated strains demonstrated resistance against some first and second generation antibiotics. In conclusion, the presence of genes encoding virulence factors in the meat samples analyzed, that represent a potential health risk factor to consumers, was confirmed. This is the first report of STEC non-O157 that encodes the enterohemolysin gene in foods in Colombia. ALAN, 2019; 69(1): 59-67.
Key words: Enterohemolysin, Escherichia coli, Beef, STEC, no-O157, Shiga Toxin.
https://doi.org/10.37527/2019.69.1.008
Autor para la correspondencia: Fanny Herrera Arias. Email: [email protected]
La carne es un sustrato nutritivo con una actividad de agua de aw (0.99) adecuada para el crecimiento de la mayoría de los microorganismos. El crecimiento microbiano ocurre principalmente a expensas de moléculas de bajo peso molecular (carbohidratos, lactato y aminoácidos). Bajo este contexto, la carne de origen bovino es reconocida como una fuente importante de infección por patotipos de Escherichia coli; estos se caracterizan por los antígenos O (somáticos) y H (flagelares) que definen serogrupos (sólo el antígeno O) o serotipos (antígeno O y antígeno H) (1).
Los patotipos existentes de Escherichia coli son: E. coli Enteropatógena, E. coli Enteroinvasiva, E. coli Enterotoxigénica, E. coli Enterohemorrágica, E. coli Enteroagregativa y E. coli Enterohemorrágica (ECEH). Escherichia coli Enterohemorrágica puede producir lesiones de adhesión-borrado en las microvellosidades del epitelio intestinal debido a la presencia de la isla de patogenicidad LEE, pero su característica principal es la capacidad de producir toxinas. La molécula stx1 es una estructura altamente conservada que es idéntica a la de la toxina Shiga de Shigella dysenteriae tipo 1; en contraste, hay varias variantes antigénicas de stx2 que difieren en su actividad biológica y asociación con la enfermedad. Aunque existen más de 200 serotipos de cepas de E. coli capaces de producir toxinas Shiga, la mayor parte no poseen la isla de patogenicidad LEE. Esto ha llevado al uso del término de E. coli productoras de toxinas Shiga (STEC) para designar a cualquier cepa de E. coli que produce toxinas Stxs y el término EHEC para las cepas que, además de producir Stx, contienen la isla de patogenicidad LEE (1). En esta isla de patogenicidad se hallan los genes que codifican para la proteína externa de membrana (intimina), los genes esp (E. coli secreted proteins a, b y d), el gen que codifica para el receptor traslocado de intimina Tir (translocated intimin receptor) y los genes para la síntesis del sistema de secreción tipo III (1). Otros factores de virulencia incluyen fimbrias, OMPs, el lipopolisacárido (LPS O157) o el plásmido pO157 y la enterohemolisina, presente en la mayor parte de cepas STEC, que contribuye al desarrollo de enfermedad a través de la lisis de eritrocitos y la liberación de hemoglobina como fuente de hierro para la bacteria (2).
La infección por STEC se produce por ingestión de alimentos contaminados, siendo su principal reservorio el tracto gastrointestinal de los bovinos. Las cepas STEC, además de tener una dosis infecciosa muy baja (10-100 células), sobreviven en su paso a través del tracto gastrointestinal porque suelen ser resistentes a la acidez; una vez en el intestino, se presenta enfermedad de diferente gravedad dependiendo de los factores de virulencia que presente la cepa en cuestión.
El factor de virulencia más importante de las cepas STEC son las toxinas Shiga; estas son producidas en el intestino grueso y ejercen una acción local al inducir apoptosis en las células epiteliales del intestino, dando lugar a diarrea hemorrágica, colitis hemorrágica (CH), necrosis y formación de úlceras. Además, estas toxinas pueden viajar a través del torrente sanguíneo hasta los riñones, dando lugar a inflamación renal. El daño renal puede evolucionar al Síndrome Urémico Hemolítico (SUH), caracterizado por anemia hemolítica, trombocitopenia e insuficiencia renal aguda (2).
De acuerdo con el Centro de Control y Prevención de Enfermedades de los EEUU (CDC) entre el 2009-2015 el patotipo STEC fue la segunda causa bacteriana de brotes de Enfermedades Transmitidas por los Alimentos (ETAs) en ese país, estando entre los agentes que ocasionan mayor porcentaje de hospitalizaciones y muertes, 13 y 9%, respectivamente; siendo los serogrupos principalmente identificados O157, O26, O111, O121, O145, O45, O103 y O186 (3).
En Colombia, el primer reporte de E. coli O157 en alimentos se presentó en carne de res y cerdo (4). A partir de aquí, se ha reportado la presencia de STEC en diferentes alimentos de origen animal (5, 6,7).
El tratamiento de las infecciones en humanos por STEC con antibióticos es controversial debido al incremento de cepas multirresistentes; de hecho, se han detectado cepas ambientales aisladas de animales y/o alimentos resistentes a la ampicilina, estreptomicina, trimetoprim/sulfonamida, eritromicina, cefalotina, amikacina, kanamicina y gentamicina, entre otros (8,9).
Los objetivos de este estudio fueron, determinar la prevalencia de STEC en muestras de cárnicos crudos de origen bovino expendidos en la Ciudad de Pamplona, Colombia, estableciendo, la presencia de genes que codifican factores de virulencia en cepas aisladas a partir de las muestras y el patrón de resistencia-susceptibilidad antibiótica de estas cepas.
Se realizó un muestreo no probabilístico intencional, conformado por 100 muestras de carne cruda de bovino expendidos formalmente en la ciudad de Pamplona (Colombia) que incluían carne molida (80 muestras) y porcionada (20 muestras). Se tomaron, aproximadamente, 200 g de cada muestra y se transportaron en condiciones de refrigeración, realizando los análisis microbiológicos en un periodo no mayor a 2 horas.
De cada una de las muestras se tomaron 10 g y se dispensaron en 90 ml de Caldo Tripticasa de Soja (TSB) e incubadas a 37ºC durante 24 horas; posteriormente se transfirieron 700 μL y se resuspendieron en 700 μL de glicerol, conservando a temperatura de congelación. A partir de la muestra congelada, se tomaron 100 μL, se inocularon en TSB, e incubados a 37ºC durante 24 horas. 1 mL del caldo fue centrifugado a 12,000 rpm/3 min; Posteriormente, se adicionaron 200 μL de Chelex, resuspendiendo el pellet completamente, se agitó cada tubo empleando un vortex durante 10 segundos; luego se transfirió cada tubo a un bloque de calentamiento a 100ºC durante 10 minutos. Finalmente, cada tubo fue centrifugado a 12,000 rpm /3 min.
Se realizó una PCR múltiple para detectar los genes stx1 y stx2. Se emplearon los pares de cebadores correspondientes a una concentración de 25 mM y un cóctel comercial 5 PRIME MasterMix (Taq polimerasa, buffer, dNTPs y Mg+2). (Tabla 1). Fueron amplificados los diferentes genes en un equipo Mastercycler Personal. El ciclo de amplificación fue el siguiente: se realizó una desnaturalización inicial a 95ºC durante 5 minutos, seguida de 25 ciclos, cada uno de ellos compuesto por tres pasos; un primer paso de desnaturalización a 95ºC durante 30 segundos, un segundo de hibridación a 56ºC durante 40 segundos y una elongación a 72ºC durante 1 minuto. Finalmente, se realizó un último paso de elongación final a 72ºC durante 7 minutos. Se sometieron los productos de la amplificación (5 μl) a electroforesis en gel de agarosa (Bio-Rad) al 1,5 % p/v a 100 V durante 1 h. Se realizó la visualización mediante tinción con RedSafeTM, empleando un transiluminador de luz ultravioleta, documentando con la aplicación del Digimage System acoplado a una cámara digital Canon Power Shot G11.
A partir del caldo TSB correspondiente a cada una de las 100 muestras, se realizaron siembras en SMAC (Agar Sorbitol MacConkey, Oxoid). E.coli O157 normalmente no fermenta el sorbitol, por lo que produce colonias incoloras, mientras que otras E. coli no-O157:H7 generalmente si fermentan el sorbitol, por lo que darán lugar a colonias de color rosa. Se observaron estas placas tras su incubación a 37ºC durante 24 horas. Se confirmaron las colonias rosas e incoloras por PCR para la detección de stxs, 176 cepas en total. Las muestras que fueron negativas por PCR a partir del SMAC fueron inoculadas en el CHROMagarTM STEC; el aspecto de las colonias STEC en este medio de cultivo es violeta, las cepas STEC O157 son no fluorescentes y las STEC no-O157 evidencian fluorescencia variable.
Las colonias típicas obtenidas en SMAC y CHROMagar STEC se sometieron a pruebas de PCR buscando de forma separada los genes que codifican para las toxinas Shiga (stx1 y stx2), el gen que codifica para la intimina (eae) y el gen que codifica para la enterohemolisina (hlyA) (Tabla 1). Se trabajó con las concentraciones de reactivos, equipos para la amplificación, ciclo de amplificación y visualización descritos en las muestras.

Las cepas STEC se sometieron a dos pruebas de aglutinación con partículas de látex:
En ambos casos se utilizaron partículas azules de látex sensibilizadas con anticuerpos específicos de conejo reactivos frente al antígeno somático correspondiente, siguiendo las indicaciones del fabricante en cada caso.
A partir de las cepas STEC aisladas, se tomaron al azar cinco de ellas con el fin de realizar la prueba de antibiograma aplicando el método de difusión en agar de acuerdo con los lineamientos del EUCAST (14).
Los antibióticos ensayados fueron: Ampicilina 10 μg (AMP); Estreptomicina 10 μg (S); Cefalotina 30 μg (KF); Ácido Nalidíxico 30 μg (NA); Cefotaxima 5 μg (CTX); Tetraciclina 30 μg (TE); Amoxicilina – Ácido Clavulánico 30 μg (AMC); Trimetoprim - Sulfametoxazol 25 μg (SXT); Gentamicina 10 μg (CN); Ciprofloxacina 5 μg (CIP); Cloranfenicol 30 μg (C); Cefoxitina 30 μg (FOX); Cefepima 30 μg (FEP); Cefaclor 30 μg (CEC); Ticarcilina 75 μg (TIC); Ceftazidima 30 μg (CAZ); Aztreonam 30 μg (ATM); Piperaciclina 30 μg (PRL); Cefuroxima 30 μg (CXM); Imipenem 10 μg (IPM).
En la tabla 2, se describen los perfiles de virulencia detectados en las muestras y en las cepas aisladas de las mismas. En el 22% de las muestras no se observaron amplificados para las toxinas buscadas. Se encontró una importante prevalencia del gen stx2 en las muestras, a pesar de esto, sólo a partir del 13% de las mismas fue posible detectar cepas stxs positivas (Tabla 3). Adicionalmente, en el 84.6% de estas cepas se detectó el gen que codifica para la enterohemolisina (hlyA). No se reveló la presencia del eae en las cepas aisladas a partir de las muestras.
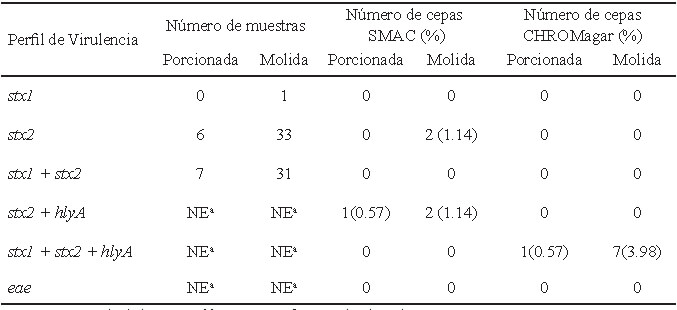
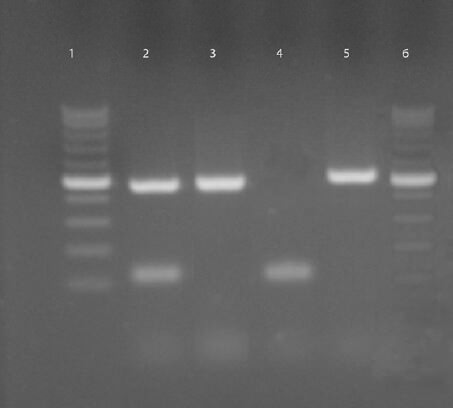
En la figura 1 se muestran los amplificados obtenidos de las muestras y las cepas aisladas en este estudio. La detección de los genes stx1 y stx2 se realizó mediante PCR múltiple. Partiendo de 176 cepas sospechosas, se encontró una prevalencia de STEC del 7.4%; 4.55 % de ellas fueron obtenidas mediante la utilización del CHROMagar STEC, las cuales revelaron el genotipo stx1 +, stx2 +, hlyA +; en el medio de cultivo Sorbitol MacConkey se aislaron 2.85% de las cepas, que evidenciaron la presencia del stx2 o del genotipo stx2 +, hlyA +; El gen stx1 de forma única fue el menos prevalente tanto en muestras como en cepas.
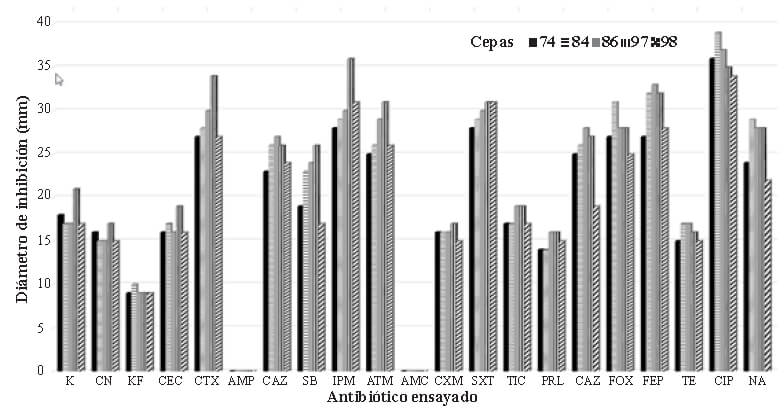
La figura 2 describe los resultados obtenidos para la prueba de resistencia-susceptibilidad antibiótica. Se evidencia que, de acuerdo con los criterios de interpretación estipulados por el EUCAST (15) y CLSI (16), las cinco cepas ensayadas tuvieron el mismo patrón de resistencia-susceptibilidad antibiótica, siendo resistentes frente a Cefalotina, Ampicilina, Amoxicilina – Ácido Clavulánico, Cefuroxima, Ticarcilina y Piperaciclina.
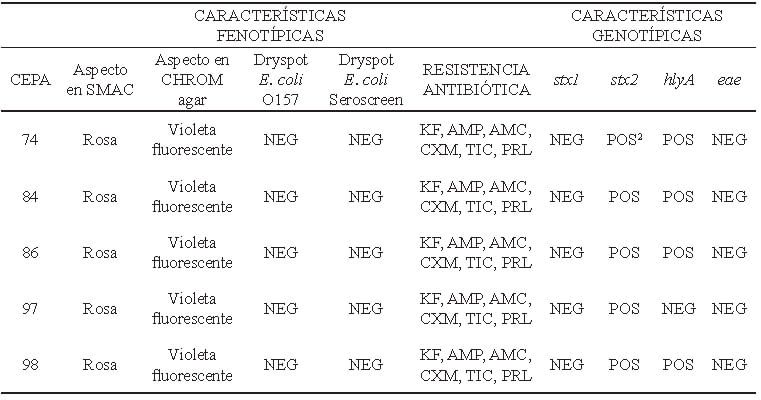
En la tabla 3 se puede apreciar la comparación entre las características fenotípicas y genotípicas de las cinco cepas STEC seleccionadas al azar; se evidencia su uniformidad fenotípica incluso en el patrón de resistencia antibiótica, todas fueron stx2 positivas, eae negativas y sólo una fue hlyA negativa.
La alta prevalencia del gen stx2 detectada en este estudio se relaciona con los resultados obtenidos en estudios similares realizados en Sur América (6, 17, 18). La importancia clínica de las cepas stx2+ es superior tanto a la de las cepas stx1+ y a la de las cepas stx1+/stx2+, ya que la probabilidad de que las primeras puedan inducir la aparición del síndrome SUH es más alta (19). Se detectó alta frecuencia del genotipo stx1+stx2 en las muestras y en las cepas, lo que puede tener una implicación sanitaria adicional debido a que los genes que codifican las toxinas Shiga se encuentran localizados en el genoma de bacteriófagos lamboides denominados fagos-Stx, elementos genéticos altamente móviles que pueden infectar bacterias comensales del intestino, haciendo que puedan producir Stxs y por tanto agravando la enfermedad. Otra característica importante de los fagos-Stx es su estabilidad en el ambiente durante largos periodos de tiempo y pueden como ya se ha dicho, insertarse en bacterias convirtiéndolas en productoras de toxinas Stxs (20).
La reducida recuperación de cepas STEC a partir de las muestras analizadas puede atribuirse a varias razones como son: la presencia de un número muy pequeño de células STEC en las mismas que no lograron detectarse en ninguno de los medios de cultivo ensayados; la mayoritaria presencia de fagos portando stxs en las muestras de carne y/o a la existencia de una elevada microbiota acompañante que pudo haber inhibido su crecimiento (21).
Se encontró, en un importante porcentaje de cepas STEC, el gen que codifica para la enterohemolisina (hlyA), lo cual, concuerda con los resultados de otros autores (17, 18, 22). La enterohemolisina es una α-hemolisina que contribuye al desarrollo de la enfermedad, favoreciendo la liberación de hierro para la realización de las reacciones metabólicas bacterianas; además, puede alterar la membrana de diferentes células del huésped e inducir la producción de citoquinas pro-inflamatorias (2).
El gen codifica para la intimina, una proteína de membrana externa que contribuye en el borrado de los enterocitos y a la formación de un pedestal en la membrana de los mismos, permitiendo la adhesión íntima de la bacteria a la célula (1). La no detección de este gen en las cepas concuerda con otros estudios realizados en Latinoamérica en cepas STEC no-O157 obtenidas de muestras de diferentes alimentos y ambientes (6, 17, 18). El hecho de no detectar la presencia del gen eae en las cepas no las hace inofensivas para el ser humano, ya que se han encontrado serotipos productores de stxs que son eae negativos y han sido implicados en diarrea, SUH y en brotes de ETAs (21, 23); de hecho, el brote de ETAs más importante ocurrido en Alemania en el 2011 fue por una cepa STEC eae negativa que ocasionó 4,321 casos confirmados, 852 casos de SUH y 54 muertes (23).
Se pudo evidenciar la alta especificidad y selectividad del medio de cultivo cromogénico para la detección de las cepas STEC. Está demostrado que el telurito de potasio presente en el suplemento del Sorbitol MacConkey puede inhibir el crecimiento de STEC no-O157, razón por la cual resulta más conveniente el empleo del CHROMagar, que tiene la ventaja adicional de permitir diferenciar la presencia de E. coli O157 de las no-O157 por la no fluorescencia que no emiten las primeras (24), lo que se comprobó en este trabajo.
Al realizar la prueba de aglutinación a cada una de las cepas STEC empleando el Dryspot E. coli O157 y el Dryspot Seroscreen (Oxoid), ninguna arrojó resultados positivos, lo que puso en evidencia que no se correspondían a los serogrupos O157, O26, O91, O103, O111, O128 ni O145; resultados similares fueron obtenidos en cepas STEC aisladas a partir de muestras de carne molida en Chile (18).
El serogrupo STEC O157 tradicionalmente se ha vinculado con enfermedades en el ser humano, sin embargo se han reportado más de 400 serogrupos STEC que igualmente producen enfermedad, entre ellos los serogrupos pertenecientes al grupo referido como “el gran 6” (O111, O26, O121, O103, O145 y O45) que son los principales serogrupos no-O157 aislados de infecciones clínicas humanas en los EEUU (21). La nula o baja detección del serogrupo O157 se relaciona con otros estudios en diferentes muestras de alimentos en Colombia y Chile (5, 6, 7, 18). En Argentina y Brasil, se ha reportado mayor frecuencia de STEC no-O157 en diferentes muestras de origen bovino (22, 25). Adicionalmente, Islam et al 2014, analizando datos del 1980-2012, reportan una prevalencia en Latinoamérica de E. coli O157 en ganado bovino del 1.65% (26). Estos resultados sugieren la reducida incidencia de cepas STEC O157 en alimentos de origen animal en la región. A pesar de esto, Franco et al 2013, detectaron el serotipo O157:H7 en el 28% en muestras de carne de cerdo provenientes de Cartagena-Colombia (27).
Las cepas aisladas en este trabajo, revelaron ser homogéneas fenotípicamente, razón por la cual se seleccionaron al azar cinco de ellas para la prueba de antibiograma. La resistencia a la ampicilina detectada se relaciona con la obtenida en cepas no-O157 aisladas de humanos (9). De otra parte, cepas ECTS no O157 aisladas a partir de heces animales evidenciaron similar resistencia a la cefalotina (8).
Se encontró una alta prevalencia de STEC no-O157 en muestras de carne cruda de origen bovino comercializadas en Pamplona-Colombia; las cepas aisladas presentaron, además, el gen que codifica para la enterohemolisina; sin embargo, no pertenecían a serogrupos identificables. Esto sugiere que en el medio ambiente de explotaciones ganaderas podrían estar circulando STEC no conocidos y de los cuales se ignora su efecto para la salud del ser humano.
La ausencia del serogrupo O157 en las cepas aisladas a partir de las muestras no asegura la inocuidad de las mismas, ya que se detectaron STEC portadores de factores de virulencia implicadas en enfermedad en el hombre, aunque demostraron resistencia únicamente frente a algunos antibióticos de primera y segunda generación.
La gran mayoría de las cepas STEC aisladas en América del Sur a partir de ganado bovino y sus derivados son no O157 con un perfil de virulencia stx2 + hlyA y son eae negativas.
Este es el primer reporte de STEC no-O157 que codifican el gen para la enterohemolisina en alimentos en Colombia.
Fanny Herrera Arias agradece la estancia concedida por el Departamento de Microbiología de la Facultad de Ciencias Básicas de la Universidad de Pamplona, Colombia, para llevar a cabo los ensayos de PCR en el Departamento de Higiene y Tecnología de los Alimentos de la Facultad de Veterinaria- Universidad de León, España.