La obesidad infantil representa un factor importante en el desarrollo del síndrome metabólico (SM). En este sentido el factor neurotrófico derivado del cerebro (BDNF: Brain Derived Neurotrophic Factor) interviene en el metabolismo energético así como en vías que controlan el peso corporal y desórdenes metabólicos. El objetivo de este estudio fue determinar si hay una correlación entre el BDNF con los marcadores que definen al síndrome metabólico en una población infantil de México. Se integraron al estudio 100 niños con un rango de edad de 5-13 años, se estratificaron en tres grupos, normo peso, sobrepeso y obesidad, a los cuales se les determinaron las variables antropométricas, percentil de la tensión arterial sistólica y diastólica, concentraciones séricas de glucosa, triglicéridos, colesterol de alta densidad (HDL) y BDNF. Se aplicó ANOVA y una correlación de Pearson. Los resultados muestran que la prevalencia de SM utilizando los criterios de Cook y Weiss fue del 14%, mientras que por la Federación Internacional de Diabetes (IDF) es del 11%. La circunferencia de cintura, triglicéridos, colesterol HDL, presión arterial sistólica/diastólica y glucosa, mostraron diferencias significativas entre los grupos estudiados (*p<0,001). El BDNF se correlacionó positivamente con la desviación estándar del índice de masa corporal de acuerdo con la edad (DE-IMCE) (p=0,01), el percentil del perímetro de la cintura (p=0,00), la presión arterial sistólica (p=0,01) y las concentraciones plasmáticas de glucosa (p=0,02). Estos datos muestran que existe una correlación entre el BDNF con la DE-IMCE, la circunferencia de la cintura, la presión arterial sistólica y glucosa. ALAN, 2019; 69(2): 99-106.
Palabras clave: Síndrome metabólico, BDNF, obesidad, niños, adolescentes.
Childhood obesity represents an important factor in the development of metabolic syndrome (MS). In this sense, the brain derived neurotrophic factor (BDNF) is involved in energy metabolism as well as in pathways that control body weight and metabolic disorders. The objective of this study was to determine if there is a correlation between BDNF with the markers that define the metabolic syndrome in a child population in Mexico. The study included 100 children with an age range of 5-13 years, stratified into three groups, normal weight, overweight and obesity, which were determined anthropometric variables, percentile of systolic and diastolic blood pressure, concentrations serum glucose, triglycerides, high density cholesterol (HDL) and BDNF. ANOVA and Pearson correlation were applied. The results show that the prevalence of MS using the Cook and Weiss criteria was 14%, while for the International Diabetes Federation (IDF) it is 11%. Waist circumference, triglycerides, HDL cholesterol, systolic/diastolic blood pressure and glucose showed significant differences between the groups studied (*p<0.001). The BDNF was positively correlated with the standard deviation of the body mass index according to age (DE-IMCE) (p=0.01), the percentile of the waist circumference (p=0.00), systolic blood pressure (p=0.01) and plasma glucose concentrations (p=0.02). These data show that there is a correlation between BDNF with DE-IMCE, waist circumference, systolic blood pressure and glucose. ALAN, 2019; 69(2): 99-106.
Key words: Metabolic syndrome, BDNF, obesity, children, adolescents.
https://doi.org/10.37527/2019.69.2.004
Autor para la correspondencia: Oscar Gutiérrez Coronado, email: [email protected]
La obesidad gestada en la infancia representa un factor condicionante para la obesidad en etapas tardías y para el aumento en la morbilidad y mortalidad del adulto (1); además, constituye un factor de riesgo independiente para el desarrollo de implicaciones crónicas conceptualizadas bajo el término de síndrome metabólico (SM), en pediatría, se denomina SM al conjunto de alteraciones antropométricas, clínicas y bioquímicas que predisponen el desarrollo de enfermedades cardiovasculares y la diabetes mellitus tipo 2 (DM2) (2). El tejido adiposo visceral, además de considerarse un reservorio de energía, representa un órgano endocrino secretor de adipocinas (3); recientemente, se ha considerado a las neurotrofinas como potenciales adipocinas que intervienen en el control del apetito, regulación de la presión arterial, metabolismo lipídico, metabolismo de la glucosa, resistencia a la insulina, inflamación y ateroesclerosis (4).
El factor neurotrófico derivado del cerebro (BDNF: Brain Derived Neurotrophic Factor) representa la neurotrofina de mayor expresión en el sistema nervioso central de los mamíferos, desempeña un papel importante en la proliferación, diferenciación y supervivencia de las neuronas (5). Su localización en varios centros hipotalámicos (núcleo ventromedial, hipotálamo dorsomedial, hipotálamo lateral, núcleo paraventricular y núcleo arcuato) proporcionó los primeros indicios de su asociación con una amplia variedad de funciones metabólicas incluidas el control del peso corporal, la ingesta de alimentos, los niveles de insulina y por lo tanto, la glucemia, así como el metabolismo lipídico (4,6).
Hristova y Aloe (2006) reportaron que el BDNF podría estar implicado en la cascada de transtornos metabólicos manifestados en el SM (7); Bullo, Peerually, Trayhurn, Folch y Salas (2007) reportaron que los niveles circulantes del BDNF eran significativamente más bajos en mujeres con obesidad mórbida, y que estos se correlacionaban al colesterol HDL (8). Bus, et al. (2011) identificaron una correlación positiva entre las concentraciones séricas del BDNF, el SM y la enfermedad coronaria en adultos (9). En adolescentes, Levinger, et al. (2008) identificaron una correlación positiva entre los niveles plasmáticos del BDNF y la concentración de triglicéridos, glucosa, insulina y obesidad visceral en individuos sanos (10). En niños se reportó una correlación negativa entre las concentraciones periféricas del BDNF y el IMC (11); El-Gharbawy, et al. (12), concluyeron que las concentraciones séricas del BDNF se encontraban significativamente reducidas en niños y adolescentes con obesidad extrema en comparación con sus pares de peso normal; por su parte Araki, et al. (4) demostraron que los niveles plasmáticos del BDNF eran significativamente inferiores en niños con obesidad mórbida y SM.
En relación con lo anterior, la presente investigación tuvo como objetivos identificar la prevalencia de SM en escolares de una población urbana del estado de Jalisco y correlacionar las concentraciones plasmáticas del BDNF con los componentes que integran el SM en la población infantil.
Se realizó un estudio correlacional y transversal con estudiantes matriculados durante el calendario escolar 2017-2018 de la Escuela Primaria Ignacio Manuel Altamirano en Barra de Navidad Jalisco, México, previa aprobación de las autoridades directivas del plantel escolar, del Comité de Padres de Familia y consentimiento informado por escrito de los padres y/o tutores.
De un total de 158 estudiantes interesados en participar, se seleccionó aleatoriamente una muestra representativa (n = 100) con un intervalo de confianza del 95% y un error muestral del 5%, excluyendo a niños con diagnóstico de enfermedades endocrinas y metabólicas, se estratificó la muestra en tres grupos:
Grupo 1: normopeso.
Grupo 2: sobrepeso.
Grupo 3: obesidad.
Se incluyeron estudiantes matriculados durante el calendario escolar 2017–2018. Se excluyeron a niños con diagnóstico de enfermedades endócrinas y metabólicas, que no presentaran la carta de consentimiento informado firmada por su padre y/o tutor y que no estuvieran en ayuno de 12 horas para la toma de la muestra sanguínea.
Se identificó el SM con los criterios propuestos para niños y adolescentes por: Cook, et al. (2003) (13), Weiss, et al. (2004) (14) y la Federación Internacional de Diabetes (IDF 2007) (15).
Las mediciones antropométricas (peso, talla y circunferencia de la cintura) se realizaron de acuerdo con los lineamientos de la Sociedad Internacional para el Avance de la Kinantropometría. Cada medición se registró tres veces, se calculó el promedio y se utilizó este valor como medida final.
Se calculó el índice de masa corporal de acuerdo a la edad (IMCE), a través del programa WHO AnthroPlus (OMS; 2015), se identificó el estado nutricio con los puntos de corte establecidos por la OMS 2007 en términos de desviación estándar del IMCE (DE-IMCE).
Se estableció el valor percentilar de la circunferencia de cintura (CC) con base a la edad-sexo, de acuerdo con lo descrito por Fernández, et al. (2004) (16).
La tensión arterial se evaluó con un esfigmomanómetro de mercurio (Tycos CE0050) de acuerdo a la técnica propuesta por Pickering, et al. (2005) (17), los valores percentilares para diagnosticar hipertensión se obtuvieron de las tablas del National High Blood Pressure Education Program Working Group on Children and Adolescents (18).
Se realizó una extracción sanguínea basal por punción venosa (5 mL) tras 12 horas de ayuno y se cuantificó la concentración plasmática de glucosa (método Oxidasa/Peroxidasa), Triglicéridos (método Glicerol Fosfato Oxidasa/Peroxidasa) y colesterol HDL (método Directo Detergente) utilizando un espectrofotómetro automático (A15 BioSystems®) para lecturas a 500 ± 20 nm de longitud de onda (λ). El BDNF se cuantificó con la técnica ELISA a través del kit comercial Human BDNF-Catálogo número: EK0307 Boster®, con estricto apego a las instrucciones del fabricante.
Con base a lo anterior y de acuerdo con la reglamentación de la Ley General de Salud en materia de investigación y a las normas de la Declaración de Helsinki, el presente trabajo fue considerado de riesgo mínimo. Se obtuvo consentimiento informado firmado por el padre y/o tutor del alumno, se aseguró la confidencialidad de los datos obtenidos y se informó de manera personal al padre y/o tutor los resultados individuales de cada participante.
La información fue procesada con el programa SigmaPlot Statistics versión 11.0; los datos fueron expresados como la media ± desviación estándar para variables cuantitativas y como porcentaje para variables categóricas. Se aplicó estadística descriptiva y la comparación de las variables entre los grupos del estudio se realizó por un análisis de varianza unidireccional (ANOVA). Para evaluar correlación entre variables cuantitativas se utilizó el coeficiente de correlación de Pearson; un valor de *p<0,05 fue considerado como estadísticamente significativo y altamente significativo en *p<0,01.
Se evaluaron 100 estudiantes de educación primaria: 42 varones y 58 mujeres, ambos con un promedio de edad de 9.6 ± 1.6 años y 8.9 ± 1.6 años respectivamente. Con relación al estado nutricio presentado en la población atendida, el 37 % presentó obesidad, 32 % sobrepeso y 31 % fueron identificados con normopeso.
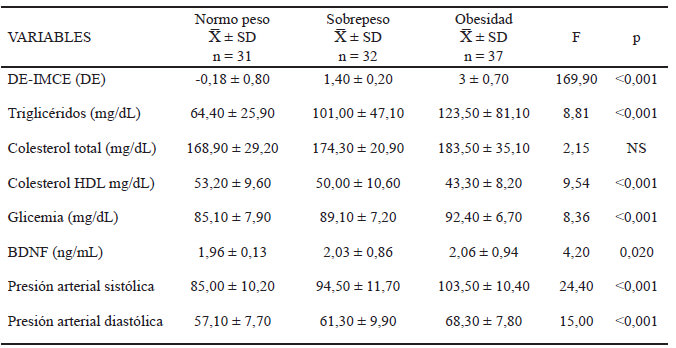
Utilizando los puntos de corte propuestos por Cook y Weiss para el diagnóstico de SM en pediatría, se identificó una prevalencia de 14 %, mientras que para los dictados por la IDF representó el 11 %. Todos los componentes del SM: circunferencia de cintura, triglicéridos, colesterol HDL, presión arterial sistólica/diastólica y glucosa sanguínea presentaron diferencias estadísticamente significativas (*p<0,001) entre los grupos de estudio; sin embargo, no se identificaron diferencias en las concentraciones plasmáticas del colesterol total (p=0,121). Con relación a las concentraciones plasmáticas del BDNF, el grupo de sobrepeso y obesidad mostró un incremento significativo (*p<0,05) en los niveles de este factor comparado con el grupo normopeso (Tabla 1).
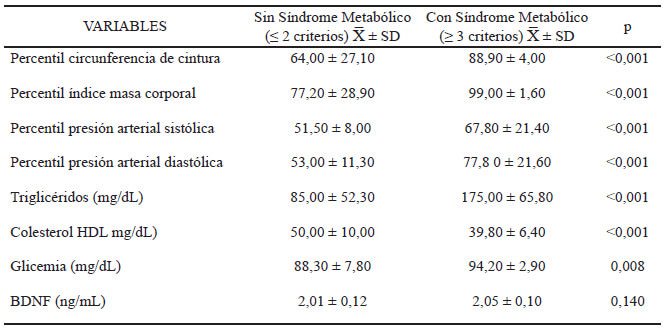
Para evaluar la relación del BDNF con los componentes que integran el SM, se categorizó la muestra en dos grupos: grupo 1 escolares sin manifestación de SM (≤2 criterios para diagnóstico de SM) y grupo 2 escolares con SM (≥ 3 criterios diagnósticos de SM). Se observaron diferencias significativas en los componentes que integran el SM, excepto por la concentración plasmática del BDNF (p=0,140) (Tabla 2).
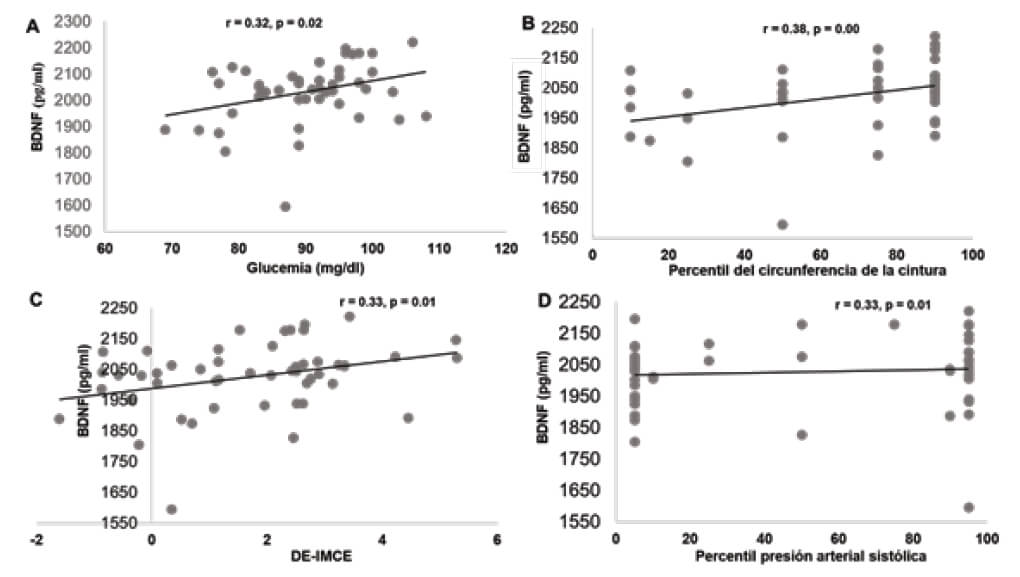
Con respecto a las concentraciones plasmáticas del BDNF, se observó una correlación moderada con la DE-IMCE (*p=0,01), el percentil del perímetro de la cintura (*p=0,00), la presión arterial sistólica (*p=0,01) y las concentraciones plasmáticas de glucosa (*p=0,02); sin embargo, no se correlacionaron con la presión arterial diastólica (p=0,42), triglicéridos (p=0,18) y el colesterol HDL (p=0,20) (Figura 1).
Con los resultados obtenidos en el presente trabajo, donde a través de la DE-IMCE se identificó una prevalencia elevada de sobrepeso y obesidad; lo que representa el 39,7 % de la población total adscrita a la Escuela Primaria Ignacio Manuel Altamirano en Barra de Navidad Jalisco, México; estos hallazgos concuerdan con los resultados presentados por la ENSANUT de Medio Camino 2016 que reporta una prevalencia combinada de sobrepeso y obesidad en localidades urbanas de 18,5 % y 16,4 % respectivamente (19). En este sentido las poblaciones urbanas se ven influenciadas por el mundo actual, que propone actividades que implican cada vez menos gasto energético y mayor consumo de alimentos hipercalóricos (20), lo que facilita el desarrollo de sobrepeso y obesidad en las generaciones pediátricas (21).
Reportes científicos concluyen que el sobrepeso u obesidad gestados en la infancia o adolescencia tiende a persistir en la adultez, lo que incrementa la probabilidad de padecer enfermedades crónicas no transmisibles de manera prematura (1,2); la tendencia epidemiológica identifica que la prevalencia y las alteraciones incluidas en el SM se presentan en la medida que aumentan el nivel de adiposidad; estos resultados evidencian una problemática cuya frecuencia se exacerba a medida que aumenta el nivel de adiposidad, aunque los resultados fueron inferiores a lo reportado por Cornejo y Llanas (2013) (22); estas diferencias en la prevalencia se pueden atribuir a varios factores, entre los que podemos destacar; la muestra poblacional, el lugar de residencia, los hábitos dietéticos y los puntos de corte que se utilizaron para el diagnóstico de SM.
Es de resaltar que aunque los criterios de evaluación empleados difieren en sus puntos de corte para el diagnóstico de SM, cuando se aplican los criterios de Cook y Weiss la prevalencia de SM es del 14 %, mientras que al aplicar los criterios de la IDF la prevalencia fue de 11 %, esta disminución en el porcentaje también se ha reportado previamente en una población mexicana (23), así como en otras poblaciones de América Latina, entre ellas Argentina, Colombia, Guatemala y Paraguay donde la prevalencia en niños es del 6,0 % (24), la diferencia en la prevalencia reportada por los criterios de Cook y Weiss y los aplicados por la IDF se puede atribuir al punto de corte más estricto para el diagnóstico de hipertrigliceridemia por la IDF que considera valores ≥150 mg/dL.
Los resultados evidenciaron que en la medida que aumenta la adiposidad abdominal aumenta la expresión de las alteraciones metabólicas asociadas al SM (hipertrigliceridemia, hipertensión arterial, dislipidemia) en comparación con los escolares que presentaron un percentil del perímetro de cintura ≤ 90 o DE-IMCE normal.
La obesidad puede ser el resultado de un desequilibrio entre el consumo calórico y el gasto energético, pero también hay moléculas que están asociadas en la regulación del peso corporal, entre ellas está el BDNF, una neurotrofina que juega un papel importante en el desarrollo y función del sistema nervioso y ejerce una función anorexigénica en el cerebro (25), por lo que defectos en su señalización y niveles bajos de esta molécula se asocian con la obesidad en humanos (26,27). También BDNF está implicado en la cascada de alteraciones metabólicos manifestados en la obesidad infantil y el SM, (4, 11, 12). Los resultados refieren que las concentraciones plasmáticas del BDNF se correlacionan positivamente con la DE-IMCE, similar a lo reportado por Araki, et al. (2014) (4), al igual que con el peso corporal, el percentil del perímetro de la cintura, el percentil del IMCE, la glucemia en ayunas y el percentil de la presión arterial sistólica, estos datos están acorde con los reportado previamente en la literatura (28).
Por otro lado, los niveles plasmáticos de BDNF en obesidad son controversiales, debido a que se han reportado concentraciones plasmáticas elevadas de BDNF en pacientes con obesidad y diabetes (10, 29), en contraste, niños y adolescentes con obesidad (4, 12) y mujeres con obesidad mórbida (8) los niveles de BDNF se encuentran significativamente reducidos. Los resultados de este trabajo se suman a la evidencia científica, donde se observa que la concentración del BDNF tiende a incrementarse con relación a la DE-IMCE, lo que se sugiere que el incremento de los niveles plasmáticos de BDNF pueda tener un efecto neuroprotector en el estadio inflamatorio (30), así como un importante regulador de la homeostasis energética en la obesidad.
La prevalencia de SM en escolares de una población infantil mexicana es elevada, esta condición se acentúa en la medida que se agrava el peso corporal, las concentraciones plasmáticas del BDNF se correlacionan positivamente con la DE-IMCE, la circunferencia de la cintura, la presión arterial sistólica y las concentraciones plasmáticas de glucosa en ayunas. Estos resultados sugieren que el BDNF juega un papel importante como un mecanismo compensatorio ante una condición de obesidad.
Al Consejo Nacional de Ciencia y Tecnología (CONACYT), con número de becario 326210.
Al Centro Universitario de los Lagos (Universidad de Guadalajara) por permitirnos el uso del laboratorio de Inmunología.
A la Escuela Primaria Federal Miguel López de Legazpi de Barra de Navidad, Municipio de Cihuatlán, Jalisco y al director de la misma Mtro. José Manuel Vargas Gallegos por su entera confianza, su disposición y por abrirnos las puertas de la institución que preside, lo que nos llevó a la realización de este proyecto de investigación.
Recibido: 03/05/2019
Aceptado: 09/09/2019