La menarca constituye un hito madurativo importante. A escala mundial ocurre, en promedio, a los 12,5 años y está sujeta a factores genéticos y/o ambientales. El objetivo fue analizar, en niñas residentes en la periferia urbana de La Plata: a) la edad mediana de menarca y b) si el estado nutricional y la distribución adiposa influyen en la edad de ocurrencia de menarca. Se evaluaron, durante los ciclos 2014-2017, en 657 niñas de 10-14 años: presencia(P)/ausencia(A) de menarca, peso, talla y pliegues subcutáneos tricipital y subescapular. Se determinaron: edad mediana de menarca (EM) según método status quo y regresión logística; estado nutricional -desnutrición, exceso ponderal y normonutrición- empleando como referencia y puntos de corte a la OMS; y distribución de adiposidad según índice subescapular/tricipital, considerando valores >1 indicativos de adiposidad centralizada. Se calcularon en general y por estado nutricional la EM y las prevalencias de ocurrencia comparándose mediante Chi2. La menarca estuvo presente en el 44,10% de las niñas con EM de 12,13 años. Alrededor del 54% de las niñas se mantuvo dentro de los límites normales (P: 41,20%; EM: 12,28 años) y el 45,70% estaban desnutridas; de estas 4,90% mostraron desnutrición debido a la baja estatura (P: 25,00%; MS: 13,40 años) y 40,80% tenían exceso de peso (P: 50,40%; MS: 11,78 años). El 32,72% de las niñas tenían adiposidad centralizada (P: 59,10%; EM: 11,79 años). Los resultados permiten concluir que el estado nutricional influye en la edad mediana de ocurrencia de la menarca, la cual es mayor en las niñas desnutridas y menor en las niñas con exceso ponderal. La disposición centralizada de la adiposidad favorece la presencia de menarca. ALAN, 2019; 69(3): 149-156.
Palabras clave: Maduración sexual, menarca, desnutrición, exceso ponderal, distribución adiposa, Argentina.
Menarche is an important maturation milestone. It normally occurs at an average age of 12.5 years and is influenced by genetic and/or environmental factors. The aim of this study was to analyze in girls residing at suburbs of La Plata city a) the median age of menarche; b) if nutritional status and fat distribution have any influence in the age of menarche. During years 2014 to 2017, 657 girls aged between 10 and 14 years(y) were surveyed, determining: presence(P)/absence(A) of menarche, weight, height, and tricipital and subscapular skinfolds. It was measured: median age of menarche (MA) according to the status quo method and logistic regression; nutritional status -undernutrition, excess weight, and normonutrition- using WHO as a reference and their cut-off points; and the distribution of adiposity through the use of subscapular/tricipital index, considering values >1 an indicative of centralized adiposity. The median age of menarche was calculated both in the general sample and by nutritional status; general and age-prevalence of menarche were compared by Chi2. Menarche was present in 44.10% of the girls with MS of 12.13 years. About 54% of the population stayed within normal limits (P: 41.20%; MS: 12.28 years) and 45.70% were malnourished; of these 4.90% showed malnutrition due to short stature (P: 25.00 %; MS: 13.40 years) and 40.80% had weight excess (P: 50.40%; MS: 11.78 years). 32.72% of the girls had centralized adiposity (P: 59.10%; MS: 11.79 years). These results allow us to conclude that nutritional status influences the median age of menarche: it is higher in undernourished girls and lower in those with weight excess. Centralized disposition of adiposity promotes the presence of menarche. ALAN, 2019; 69(3): 149-156.
Key words: Sexual maturation, menarche, malnutrition, overweight, fat distribution, Argentina.
https://doi.org/10.37527/2019.69.3.003
Autor para la correspondencia: Evelia Edith Oyhenart, email: [email protected]
En la especie humana hay variación fisiológica de 4 a 5 años en la edad de inicio de la pubertad aun cuando las condiciones de vida son similares. El primer período menstrual o menarca, constituye el hito madurativo más importante en la historia de vida postnatal femenina y es indicador esencial del ritmo de crecimiento y desarrollo individual, así como de las condiciones de salud pública poblacional (1). Numerosos estudios dan cuenta de que la edad media está sujeta a factores tanto de origen genético como ambiental (2, 3, 4, 5). Con respecto a estos últimos, la temperatura ambiental, los ciclos de luz-oscuridad, los disruptores endócrinos, la nutrición y la actividad física, son algunos de los factores a los que están expuestas las mujeres durante su vida prenatal y/o postnatal y que pueden promover cambios epigenéticos (6). Así, según lo expresado por García Cuartero el exposoma puede explicar la presencia en Europa, de un gradiente norte-sur en el inicio de la pubertad; siendo más temprano en la región mediterránea (7). A su vez, Lehmann y Scheffler sostuvieron que el retraso en la edad de la menarca, en niñas sanas y normalmente desarrolladas, puede deberse a factores psicosociales (1).
Los datos disponibles referidos a la edad de la menarca a escala mundial indican que ocurre, en promedio, a la edad de 12,50 años; no obstante, existe variabilidad, entre y dentro de las poblaciones. En América Latina se ha informado en México 12,05 años para población Maya (8); 11,40 años y 11,34 años en niñas del Distrito Federal y Xalapa, respectivamente (9); en Venezuela se comunicó 12,66 años, según un estudio longitudinal, para maduradoras promedio de Caracas (10) 12,70 años para una muestra de alcance nacional (11) y 11,97 años para niñas de Mérida (12); en Colombia, a partir de un estudio a escala nacional fue informado 12,60 años (13); en Brasil, considerando niñas de distintas regiones, 12,15 años; 11,52 años y 11,71 años (14, 15, 16) y en Chile, 12,60 años y 12,20 años para niñas mapuche y no mapuche, respectivamente (17). En Argentina, se informó a partir de un estudio realizado en muestras representativas de cinco regiones del país 12,45 años (18) y para la ciudad de La Plata, provincia de Buenos Aires en particular 12,39 años; 12,71 años y 11,60 años (19, 20, 21).
En diversos trabajos, se ha manifestado que las niñas que habían tenido rápido aumento de peso corporal, mayor adiposidad y/o un patrón de distribución centrípeto de la misma, presentaban la menarca a edades más tempranas (16, 19, 22, 23). Así, la edad de la menarca ha sido vinculada con la creciente epidemia de obesidad, tal como lo demuestra el estudio realizado en Italia por Lazzeri et al. (5). En relación con ello, y dadas las elevadas prevalencias de exceso ponderal encontradas en escolares del partido de La Plata (24) se consideró de interés realizar el presente estudio cuyos objetivos fueron analizar, en niñas residentes en diferentes localidades de la periferia de la ciudad de La Plata: a) la edad mediana de menarca y b) si el estado nutricional y la distribución adiposa influyen en la edad de ocurrencia de menarca.
La ciudad de La Plata, capital de la provincia de Buenos Aires, posee una zona hortícola ubicada en la periferia que constituye un importante cinturón verde provincial (25). Este espacio fue estrictamente planificado, en el momento de la fundación de la ciudad, como centro de abastecimiento de alimentos frescos para la misma. El sector adquirió pronto un desarrollo mayor al planeado, en función de la comercialización de los excedentes. En las últimas décadas, fue incorporada la tecnología del invernáculo que generó mayor producción asociada a la atenuación de las inclemencias climáticas e incrementó la productividad, independientemente de los ciclos naturales de cada cultivo (26).
La muestra fue obtenida, durante los años lectivos 2014-2017, en 13 escuelas públicas de nivel primario y nivel secundario básico, ubicadas en la periferia de la ciudad de La Plata pertenecientes a las localidades de Arana, Abasto, Ángel Etcheverry, City Bell (Barrio Los Porteños), Los Hornos (Paraje Las Chacras), Melchor Romero (Barrio Colonia Urquiza) y El Peligro. De acuerdo con el documento de trabajo, producido en 2017 por el Laboratorio de Desarrollo Sectorial y Territorial de la Facultad de Ciencias Económicas de la Universidad Nacional de La Plata (27) estas localidades, que integran la zona oeste del partido de La Plata, presentan altos índices de Necesidades Básicas Insatisfechas (NBI) y deficiencia de servicios públicos, tales como agua para consumo, gas y cloacas por red. Asimismo, este documento informó que entre sus habitantes, se registran el menor nivel educativo y las tasas más altas de analfabetismo del partido (27).
El estudio fue de tipo transversal e incluyó a 657 niñas. La edad de estudio estuvo comprendida entre los 10,00 (rango inferior) y 14,99 años (rango superior) y la selección se efectuó tomando como base anteriores trabajos realizados en la población de La Plata (19, 20). De este modo, la muestra por edad quedó representada por: 10 años: 184 niñas; 11 años: 195 niñas; 12 años: 120 niñas; 13 años: 90 niñas y 14 años: 68 niñas. La edad promedio correspondió a 11,69 ±1,31 años.
Se incluyeron aquellas niñas que estuvieron presentes el día que se realizó el relevamiento en cada establecimiento educativo y que cuyos padres, madres o tutores aceptaron su participación en el estudio mediante la firma del correspondiente consentimiento. Se excluyeron aquellas que, según los registros escolares, presentaban patologías o enfermedades manifiestas (endócrinas de base, síndromes genéticos, o crónicas), estaban recibiendo algún tratamiento medicamentoso que pudiera modificar las variables en estudio, así como aquellas que aun contando con el consentimiento firmado por sus progenitores manifestaron su negativa a participar.
En función de la fecha de nacimiento y la fecha de medición se calculó la edad decimal exacta. A partir de entrevistas individuales se registró la presencia (P) o ausencia (A) de menarca y se estimó la edad de ocurrencia para el conjunto poblacional y para cada categoría nutricional. Para ello, se tomó como parámetro descriptivo la mediana y se utilizaron los métodos de status quo y análisis de regresión logística, tal como fuera aplicado con anterioridad (20). Se estimaron además las prevalencias generales y por edad.
Mediante protocolos estandarizados se relevaron las variables: peso corporal (kg) con balanza TANITA UM-061, Arlington Heights IL; United States, talla (cm) con antropómetro SECA 213, Hamburg, Germany, pliegue subcutáneo tricipital (mm) y pliegue subcutáneo subescapular (mm) con calibre Lange, Cambridge Scientific Industries, Cambridge, MD, United States y se calcularon los índices de Masa Corporal [IMC= peso(kg)/talla(m)2] y subescapular tricipital (IST= pliegue subescapular/pliegue tricipital). Los datos de peso, talla e IMC fueron estandarizados a puntajes Z mediante la referencia OMS (28). Se determinaron los casos de Desnutrición (D): Baja Talla/Edad (BT= talla<-2Z); Bajo IMC/Edad (BIMC= IMC<-2Z) y Exceso ponderal (EP):
Sobrepeso (S= IMC>1Z; IMC≤2Z) y Obesidad (O= IMC>2Z). Las niñas que no clasificaron en las categorías nutricionales precedentes se incluyeron en la categoría normonutridas (N). Los valores de IST>1 fueron considerados indicativos de adiposidad centralizada (AC). Se calcularon prevalencias generales, por categoría nutricional, por edad y por estado madurativo (presencia o ausencia de menarca) y se compararon mediante pruebas de Chi2. El cálculo del error intra e inter observador de medición fue menor al 5%, lo que aseguró la estandarización de las medidas.
El proyecto fue aprobado por el Comité de Bioética de la Escuela Latinoamericana de Bioética (CELABE). El permiso para ingresar a los establecimientos escolares fue tramitado ante las autoridades de la Dirección de Inspección Escolar Distrital La Plata. La participación en el estudio requirió la autorización expresa y firmada de los padres, madres o tutores. La investigación se ajustó a lo establecido por las normas éticas instituidas por el Código de Nüremberg de 1947, por la Declaración Universal de los Derechos Humanos de 1948 y la Declaración de Helsinki de 1964 y sucesivas enmiendas, atendiéndose especialmente a lo normado por la Ley Nacional 25.326 de protección de datos personales.
El 44,10% (n=290) de las niñas analizadas presentó menarca. Las prevalencias de presencia/ausencia, según edad en años, mostraron diferencias significativas. El menor porcentaje de presencia correspondió a los 10 años (10,32%) y aumentó con el avance de la edad, superando al 90% a los 13 y 14 años (Tabla 1).
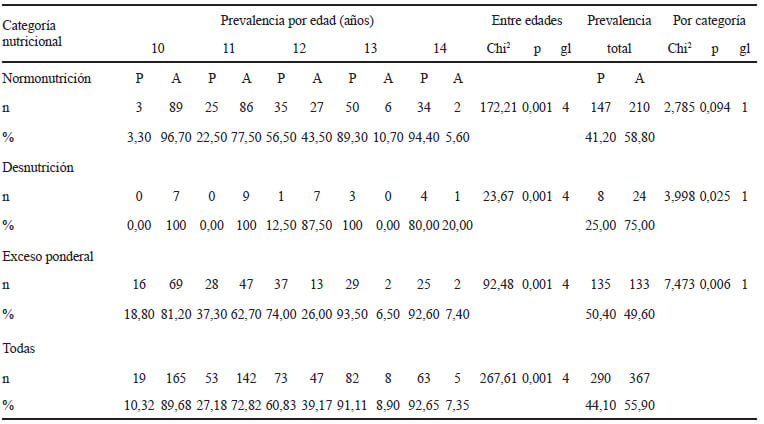
El análisis del estado nutricional indicó las siguientes prevalencias generales por categoría: 54,30% de N, 4,90% de D y 40,80% de EP. No hubo desnutrición por IMC, ni niñas que presentaran doble carga de malnutrición (EP y BTE). En la Tabla 1 se presentan las prevalencias de menarca por edad para las condiciones de desnutrición, exceso de peso y normonutrición con diferencias significativas, en todas las categorías nutricionales. El análisis de las prevalencias generales en cada categoría nutricional indicó que la presencia de menarca fue significativamente menor en las niñas con D (P: 25,00% vs A: 75,00%) y significativamente mayor en las niñas con EP (P: 50,40% vs A: 49,60%). En tanto que, en las niñas con N (P: 41,20 % vs A: 58,80%) las diferencias fueron no significativas.
En la comparación por categorías nutricionales, el EP presentó prevalencias de menarca superiores en la mayoría de las edades en tanto que a la D le correspondieron las prevalencias más bajas y a edades más tardías, resultando también menor el rango de ocurrencia (12-14 años) (Tabla 1). La comparación de las prevalencias generales de menarca entre las categorías D, N y EP indicó diferencias estadísticamente significativas (Chi2 10,249; p< 0,006; 2gl).
El análisis de regresión logística para el IST y la menarca como variable dependiente presentó signo positivo (B: 1,949; p<0,0001; Exp B: 7,023). El 32,72% de las niñas presentó adiposidad centralizada y la prevalencia de menarca fue significativamente superior en ellas (P: 59,10 vs A: 40,90; Chi2 28,890; p< 0,0001; 1gl).
La edad mediana, calculada a partir de la regresión logística, correspondió a 12,13 años en la muestra total y se observaron variaciones según la categoría de estado nutricional: N: 12,28 años; D: 13,40 años y EP: 11,78 años (Tabla 2). Asimismo, la edad de menarca difirió conforme a la distribución adiposa, 11,79 años en las niñas con AC y 12,26 años en aquellas que no presentaron esa condición (Tabla 3).
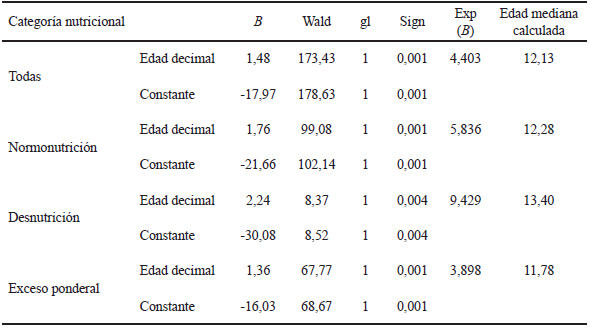
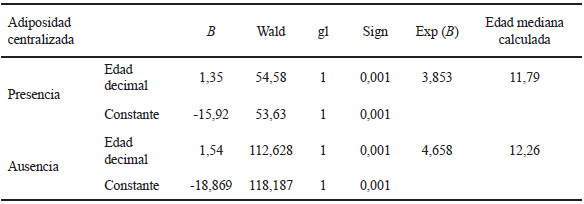
La edad mediana de menarca para la población analizada resultó adelantada respecto de los datos disponibles para Argentina en general (18) y para la población urbana de la ciudad de La Plata en particular, obtenidos hace casi una década (19, 20). En la interpretación de este adelanto no pueden descartarse factores ambientales que hayan promovido su descenso, o tendencia secular positiva, como lo informado por ejemplo para las poblaciones coreana (4) y venezolana (11, 12).
En lo referente a la calificación de la edad de menarca como “temprana”, según lo plantean Martin y Valeggia no existe consenso para definir un punto de corte a partir del cual categorizarla (29), siendo la edad “menor a 12 años” la que en su mayoría se suele considerar como criterio para establecer tal condición (30). Conforme a ello, aproximadamente un cuarto de la población con menarca del presente estudio se ubicó en el rango 10-11 años. Si se considera que la menarca es un rasgo tardío dentro de la secuencia de hitos de la maduración sexual, puesto que acontece aproximadamente dos años después de la aparición del botón mamario o telarca (31), nuestros resultados evidenciarían para esta población un inicio puberal anticipado.
El estado nutricional se vinculó con la presencia de menarca. En las niñas normonutridas la edad de menarca mediana fue 12,28 años, en tanto que, en las niñas desnutridas se registraron no sólo las menores prevalencias, sino que además la edad de menarca obtenida respecto de ellas fue 1,12 años más tardía. Estos resultados son coincidentes con los informados por Chun y Shin (4) en un estudio de tendencia secular realizado en población coreana; Martin y Valeggia (29) para aborígenes con baja talla, de la etnia Qom, residentes en Formosa (Argentina), Barros et al. (16) y Meza et al. (12) para niñas, también con baja talla, pertenecientes a población brasileña y venezolana, respectivamente. Por último, las niñas, del presente estudio, con exceso ponderal resultaron tener la edad de ocurrencia de menarca menor (0,50 años menos que las normonutridas) y la mayor representatividad en las edades consideradas como de menarca “temprana”. Resultados similares habían sido observados por Castilho y Nucci en la población escolar de Campinas (São Paulo, Brasil) correspondiendo la edad de 11,60 años a las niñas con peso alto y de 12,30 años para las que no presentaban esta condición (14). Asimismo, Barcellos Gemelli et al., para la población de la región amazónica de Brasilia, informaron asociación positiva entre exceso ponderal, aumento de la grasa corporal y adelanto de la edad de menarca, de aproximadamente 2 años, respecto a las maduradoras promedio (15). En el mismo sentido resultaron los datos obtenidos a escala nacional en Italia, por Lazzeri et al. (5), los cuales mostraron variación regional norte-sur, con menores tasas de sobrepeso y edad más tardía de menarca en las regiones del norte e, inversamente, mayores tasas de sobrepeso y edad de menarca más temprana en las del sur. En relación con ello, Addo et al, a partir del análisis de datos de niñas estadounidenses procedentes de la Tercera Encuesta Nacional de Salud y Nutrición (NHANES III) (32) y Rubinstein et al, a partir de historias clínicas de niñas asistentes a consulta ginecológica hospitalaria en La Plata (Buenos Aires) (21) coincidieron en informar que el aumento de peso, durante la preadolescencia, promueve el adelanto de la maduración sexual. La presencia de menarca a edad más temprana, registrada en el presente estudio se asoció positivamente con el mayor índice de masa corporal y la disposición centralizada de adiposidad. En tal sentido, según lo comunicado en una revisión publicada recientemente (33) se informó que en las niñas prepúberes, la cantidad de grasa corporal acumulada influye directamente en la cantidad de leptina plasmática, la cual estimula la liberación de hormonas del eje hipotalámico-hipofisario-gonadal, induciendo así a que se produzca el primer flujo menstrual.
Sin embargo, entre otra de las razones del descenso de la edad de menarca, se alude también a factores adversos tales como la mayor exposición a productos químicos que actúan como disruptores endócrinos. Entre ellos, se pueden mencionar productos de aseo personal o cosmética, los aditivos incorporados a los alimentos o los pesticidas, i.e. agrotóxicos organoclorados con acción estrogénica (34). Al respecto, cabe mencionar que gran parte de las familias de las niñas analizadas practicaban horticultura en invernáculos, que requiere el empleo de agroquímicos para fertilización de suelos y control de plagas tal como fuera mencionado previamente (26). Este tipo de prácticas no solo provoca daños al ambiente, sino que además resulta un potencial riesgo para la salud de la población estudiada, cuyas viviendas se ubican próximas a los invernáculos, según pudo observarse durante el trabajo de campo.
Los presentes resultados plantean la necesidad de implementar estrategias que permitan adecuar el desarrollo físico y psicológico de las niñas a fin de evitar el mayor riesgo de embarazo adolescente, un fenómeno que se presenta en Argentina con prevalencias cercanas al 15% desde hace más de una década (35). Asimismo, la de prevenir la aparición de consecuencias adversas en la edad adulta ya que la menarca temprana ha sido asociada con la presencia de obesidad abdominal, resistencia a la insulina, intolerancia a la glucosa, enfermedad cardíaca, síndrome metabólico y mayor tasa de mortalidad por cáncer de mama o útero (22, 30).
La edad mediana de la menarca de la población estudiada es menor a la informada para otras poblaciones de Argentina y se relaciona con el estado nutricional y la distribución adiposa. En las niñas con desnutrición es más tardía que en aquellas con normonutrición o exceso ponderal, siendo estas últimas las que presentan la edad de menarca más temprana. La ocurrencia de este evento madurativo se asocia positivamente con la disposición centralizada de la adiposidad.
Todos los autores manifestaron que no hubo conflicto de intereses.
A las niñas y sus padres, madres o tutores que permitieron la participación de sus hijas en esta investigación. A las autoridades escolares, personal docente y no docente por facilitar nuestra tarea en los establecimientos educativos. A las instituciones que financiaron este trabajo (UNLP: Proyecto 11/N808; ANCyPT: PICT-2016-0610; CONICET: PIP 0106. A la Sra. María Cristina Muñe por la revisión general del manuscrito y a la Trad. L. Adriana Di Maggio por la revisión idiomática del inglés.
María Fernanda Torres: https://orcid.org/0000-0002-6578-2192
María Eugenia Luna: https://orcid.org/0000-0002-8052-284X
Mariela Garraza: https://orcid.org/0000-0002-1974-6844
María Florencia Cesani: https://orcid.org/0000-0003-1372-9231
María Antonia Luis: https://orcid.org/0000-0001-9601-5490
Fabián Anibal Quintero: https://orcid.org/0000-0001-5605-759X
Bárbara Navazo: https://orcid.org/0000-0001-8120-0597
Evelia Edith Oyhenart: https://orcid.org/0000-0003-1331-7368
Recepción: 05/09/2019
Aceptación: 17/01/2020