La alimentación influye en la mejora de la sintomatología de cualquier enfermedad, incluida la esclerosis múltiple (EM),la cual, se caracteriza por un proceso inflamatorio crónico, autoinmune del sistema nervioso central generando situaciones como inflamación, alteraciones; digestivas y mentales, discapacidad, y fatiga. El propósito de la presente revisión fue identificar la evidencia científica sobre los aspectos nutricionales que mejoran la progresión de EM. La metodología consistió en la búsqueda de literatura, en bases de datos electrónicas, referente a nutrición y esclerosis múltiple, principalmente entre los años 2015-2020. Entre los resultados de los aspectos nutricionales que mostraron eficacia en mejorar la progresión de EM, se encuentran el zinc, vitamina D, fibra, probióticos, aceite de pescado y de oliva, cacao, cúrcuma, y salmón. Existen evidencias del papel inmunomodulador del Zn y de la vitamina D en la inhibición de la producción de citocinas proinflamatorias. Niveles bajos de ambos componentes se asocian con mayor riesgo de padecer EM. Otros componentes de interés nutricional son la fibra y probióticos; producen ácidos grasos de cadena corta, con propiedades antiinflamatorias. La primera se conoce por su papel en la motilidad gastrointestinal y los segundos por su acción celular y molecular en procesos inflamatorios, y modulación del microbioma, por mencionar algunos. Los aspectos nutricionales antes mencionados pueden contribuir a modular la inflamación y mejorar la fatiga. Finalmente, este documento genera un panorama importante para continuar con la investigación referente a la influencia de la alimentación en pacientes con EM. Arch Latinoam Nutr 2020; 70(1): 60-74.
Palabras clave: Componentes nutricionales, esclerosis múltiple, proceso inflamatorio, alimentos.
Diet influences the improvement of the symptoms of any disease, including multiple sclerosis (MS), which is characterized by a chronic, autoimmune inflammatory process of the central nervous system generating situations such as inflammation, mental and digestive alterations, disability and fatigue. The aim of this review was to identify the scientific evidence on the nutritional aspects that improve the progression of MS. The methodology consisted of searching literature, in electronic databases, referring to nutrition and multiple sclerosis, mainly between the years 2015-2020. The results of the nutritional aspects that showed effectiveness in improving the progression of MS, are zinc, vitamin D, fiber, probiotics, fish oil and olive oil, cocoa, turmeric and salmon. There is evidence of the immunomodulatory role of Zn and vitamin D in inhibiting the production of proinflammatory citokines. Low levels of both components are associated with an increased risk of MS. Other components of nutritional interest are fiber and probiotics; they produce short chain fatty acids, with anti-inflammatory properties. The first is known for its role in gastrointestinal motility and the second one for its cellular and molecular actions in inflammatory processes and the microbiome modulation, to name a few. The nutrition aspects mentioned above, can contribute to modulate inflammation and improve fatigue. Finally, this paper creates an important perspective to continue the investigation concerning the influence of diet in MS patients. Arch Latinoam Nutr 2020; 70(1): 60-74.
Key words: Nutritional components, multiple sclerosis, inflammatory process, foods.
https://doi.org/10.37527/2020.70.1.007
Autor para la correspondencia: María de Lourdes Meza Jiménez., email: [email protected]
La EM es una enfermedad desmielinizante crónica-inflamatoria que afecta al sistema nervioso central (SNC). El proceso de desmielinización ocurre por mecanismos inmunitarios anormales (1), si la pérdida de mielina es total, la transmisión del impulso nervioso se bloquea completamente, si es parcial los impulsos se transmiten de forma lenta e irregular dando lugar a los síntomas de la enfermedad (2). Los cuales son: deterioro (motor, visual, y cognitivo), problemas sensoriales, dolor, y fatiga (3). Estos se caracterizan por pérdida de las funciones sensoriales y motoras (4, 5), constituyendo la principal causa de discapacidad neurológica, de características no traumáticas en hombres y mujeres, de entre 20 - 40 años (6).
La prevalencia de la EM ha aumentado en la última década, afectando a 2,1 millones de personas en el mundo (7). En países de América Latina, la prevalencia se estima entre 5,05 y 7,7, (Ecuador, Panamá, Perú) (8-11) aunque en una región de Argentina se reportaron hasta 88 casos por 100,000 habitantes (hab) (12).
En México la prevalencia para la enfermedad, varía entre 1,5 y 13 casos por 100 000 hab (13). Se han descrito cuatro formas de evolución de la EM (14). Remitente recurrente (RR) es la forma más común, Secundaria progresiva (SP), Primaria progresiva (PP) y Progresiva recurrente (PR): Diversos factores, entre ellos ambientales (menor exposición a la luz solar, latitud) y genéticos, aumentan el riesgo a padecer EM, la presencia del polimorfismo en el gen HLA.DRB*1501 se ha relacionado con la misma (15). Otros factores pueden jugar un papel importante en el desarrollo de la enfermedad como, daño al cerebro, infecciones virales previas, inactivación física, obesidad en la niñez y adolescencia, hábitos tabáquicos, bajos niveles de vitamina D y características de la dieta (16).
Se ha demostrado que una alimentación adecuada o dieta saludable, tiene efecto antiinflamatorio y puede mejorar el curso de enfermedades crónicas, como EM, contribuyendo a la mejora de los síntomas. Además, existen reportes que consideran a la dieta un factor importante para determinar el riesgo y la progresión de la enfermedad (17).
Algunos elementos como el zinc participan en la conductividad sináptica, en la corteza cerebral e hipocampo (18). Así mismo, una dieta alta en grasas induce la liberación de marcadores de inflamación cerebral con acciones proinflamatorias en los mismos tejidos. Comorbilidades vasculares y metabólicas como hipertensión y obesidad incluida la hipercolesterolemia están asociadas con un riesgo incrementado de desarrollar EM y su rápida progresión (19).
En la EM, el factor nuclear de transcripción-kB (NF-kB) y la proteína activadora (AP-1) se encuentran activados e inducen la expresión de varios genes y moléculas proinflamatorias, la ingesta de algunos ácidos grasos saturados y trans saturados, considerados como agentes proinflamatorios, favorecen esta situación; por lo que una dieta hipocalórica puede ser benéfica para quienes padecen esta patología (20).
Considerando la implicación de la alimentación en los procesos inflamatorios, es importante indagar sobre la contribución de los componentes nutricionales en el manejo de la enfermedad. La presente revisión tiene como propósito identificar la evidencia científica sobre los aspectos nutricionales que mejoran la progresión de la EM.
El presente artículo es una investigación de tipo documental, para la cual se consultaron artículos originales publicados en revistas científicas provenientes de bases de datos electrónicas nacionales e internacionales como PubMed, Scielo, y Science Direct, del 2015 al 2020. Las palabras clave utilizadas, en español e inglés, fueron “esclerosis múltiple”, “nutrición”, “componentes nutricionales”, “alimentos” y “síntomas de esclerosis múltiple”.
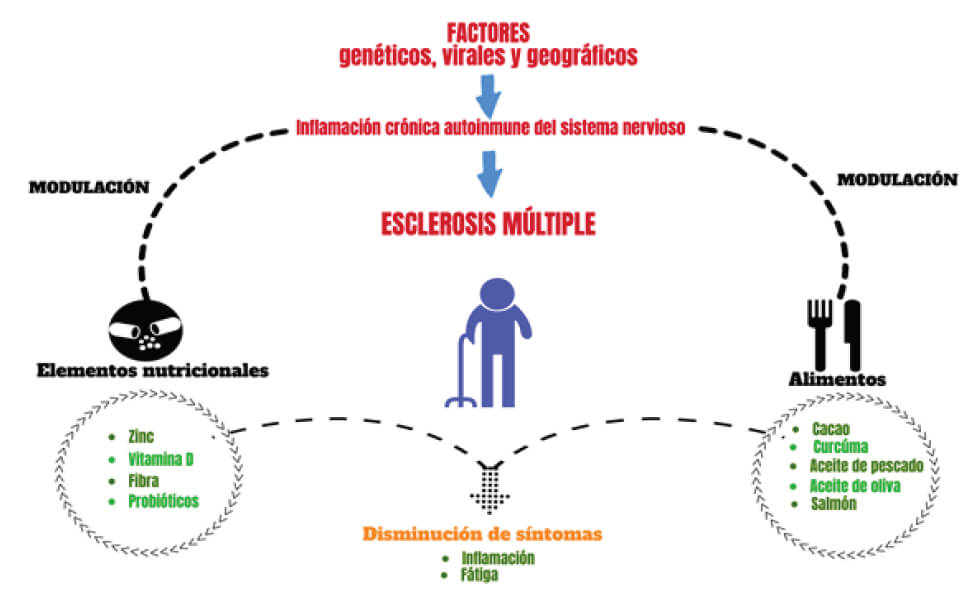
Se seleccionaron artículos sobre los componentes nutricionales que mostraron algún efecto sobre las bases que subyacen la enfermedad. Se clasificaron de acuerdo al autor, componente nutricional (zinc, cobre, vitamina D, fibra y probióticos) y alimentos (aceite de pescado y de oliva, cacao, cúrcuma y salmón) de acuerdo con la evidencia encontrada.
Las evidencias relacionadas con diversas intervenciones en dónde se han utilizado minerales y vitaminas, así como su nivel de significancia en la EM se describen en la Tabla 1.
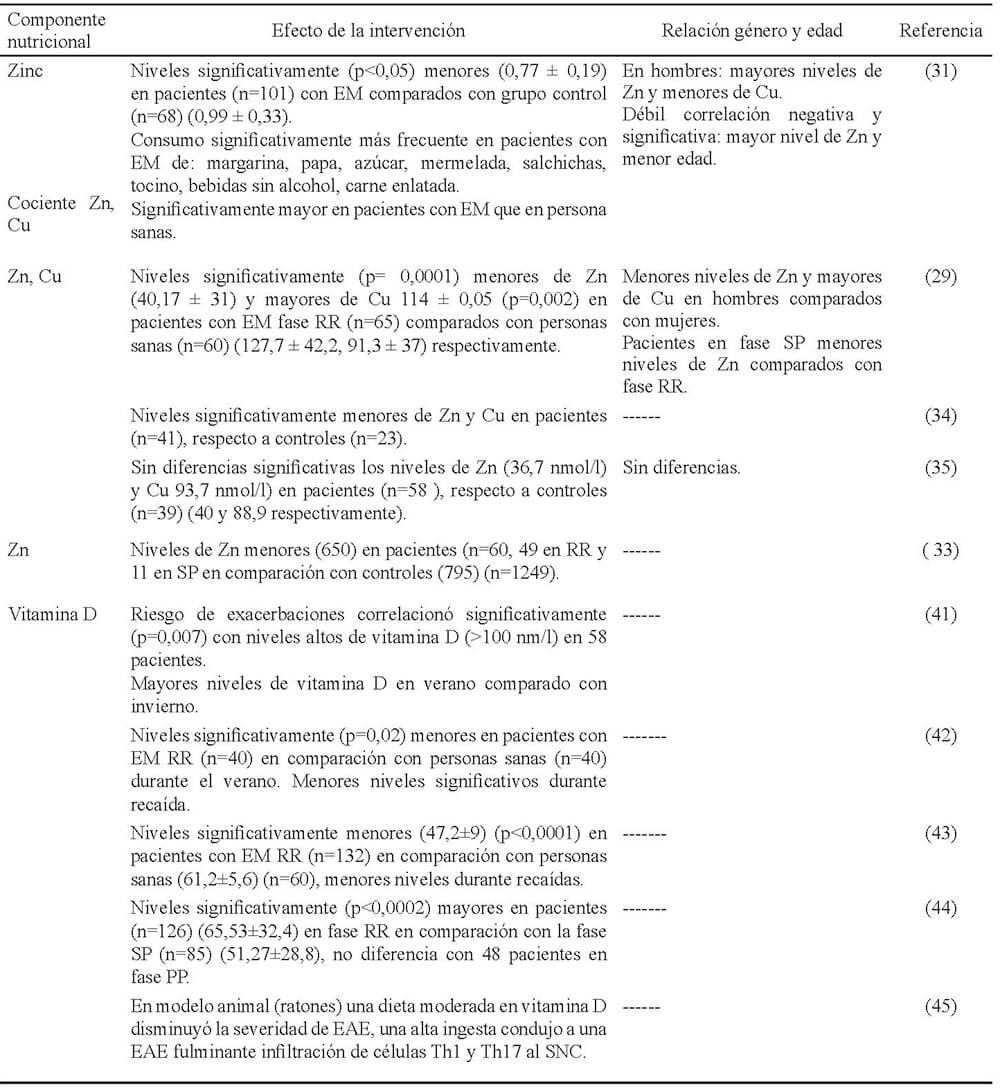
Los minerales Zn y Cu son importantes en el funcionamiento adecuado del cuerpo, incluido el sistema nervioso central y periférico. El Zn es un metal abundante en el organismo humano, presente en algunos órganos, tejidos y células, es un micronutriente esencial, (21). Participa en la respuesta inmune y en procesos inflamatorios (22), el nivel de Zn depende de los niveles de Cu, éste último compite por el Zn para unirse a la metalotioneina, reduciendo su absorción (23). Por ello, el cociente Cu/Zn es considerado como un marcador de estrés oxidativo (24)
El Zn modula la producción de citocinas proinflamatorias ILA-1β, TNF, IL6 (25, 26); se ha probado además que tiene un efecto directo sobre la proteína TPO-1 en la síntesis de mielina en oligodendrocitos (27), y se ha reportado que la ingesta de Zn decrementa la síntesis de citocinas inflamatorias (28).
Los niveles de Zn fueron medidos en el suero de pacientes con EM, a través de métodos colorimétricos (29) y otros, encontrando bajos niveles en comparación con el grupo control, ambos estudios se realizaron en una población de iraníes, además reportaron altas concentraciones de Cu, y en ratones una dieta rica en Zn mejoró la condición clínica de la encefalomielitis autoinmune experimental (EAE) (30), modelo animal más aceptado de la EM. Dos autores consideraron como punto de corte o valor normal de Zn y Cu; 70 g/dl y de 70 a 155 g/dl respectivamente (31, 32).
En una población italiana, (33) se reportaron resultados similares sin diferencia entre pacientes con EM y el grupo control, estudios semejantes han sido mostrados por otros autores (34, 21).
Vitamina D La baja exposición a la luz solar (36) y niveles bajos de vitamina D (37), han sido relacionados con el riesgo de adquirir EM. Ambos factores pueden ser interdependientes, considerando que el precursor de la vitamina D, colecalciferol (vitamina D3) es generado en la piel por exposición a la radiación ultravioleta, de manera alterna puede ser ingerida en la dieta, aunque es considerada una fuente menor (38). Se ha reportado que los pacientes con EM presentan niveles relativamente bajos de vitamina D (normal ≥50 nmol/l) (39, 40), además reportan que bajas concentraciones séricas incrementan la probabilidad tanto de recaídas, como de un inicio temprano de la progresión de la discapacidad (41), mientras niveles arriba de 70 nm/l se asocian con un menor riesgo de recaídas (44, 45).
La vitamina D ejerce efectos inmunomoduladores en células del sistema inmune innato y adaptativo, los cuales expresan ampliamente receptores de superficie para vitamina D (46).
No obstante existe un estudio que reporta que ratones con EAE alimentados con suplementos con altas dosis de vitamina D manifestaron un curso más severo de EAE, en contraste la administración oral de vitamina D a corto plazo mejoró la condición clínica de EAE (45); para lo cual se ha argumentado que deteriora la migración de monocitos (47) y células T (48) al SNC.
Los hallazgos patológicos reportados en el modelo animal (45) con alta ingesta de vitamina D fueron infiltración inflamatoria incrementada, mayor cantidad de poblaciones de células TH1 y TH17 productoras de IFN-g e IL-17, asociadas con un incremento en la extensión de desmielinización, abundante cantidad de células mieloides, además de cantidades ligeramente menores de células T reguladoras. Por estos hallazgos, se infiere que el efecto benéfico de la vitamina D se consigue a dosis moderadas.
La fibra dietética es el material derivado de la pared celular en los alimentos, que resiste la acción de las secreciones del tracto gastrointestinal (49). Su consumo se relaciona con menor riesgo a padecer enfermedades cardiovasculares, diabetes tipo 2 y mortalidad por cualquier causa, debido a sus efectos en la regulación del peso corporal, menor inflamación y cantidad de lípidos séricos y control glucémico; así como la propiedad bifidogénica de la fibra en la salud intestinal (50).
La fibra posee un alto poder para retener agua y aumenta la producción de ácidos grasos de cadena corta (AGCC) (49). Estos se producen por la degradación de polisacáridos vegetales y son: butirato, propionato y acetato, con propiedades antiinflamatorias y función de sustrato energético de colonocitos, por tanto, implicados en la función barrera de la mucosa intestinal (30). Las personas con EM pueden presentar estreñimiento, un 70 a 90 % de los individuos que la padecen pueden tener problemas para evacuar, ya que las alteraciones del sistema nervioso afectan al aparato digestivo de manera importante, alterando el tránsito intestinal; lo que exacerba la sensación de fatiga característica de la EM (51, 52), por lo que se recomienda consumir fibra a estos pacientes (Tabla 2). La recomendación internacional sobre el consumo promedio de fibra en la dieta por la FAO/WHO, es de 20 y 25 g/día para adultos. La proporción debe ser de 3/1 entre la fracción soluble e insoluble (49). La fibra insoluble, tiene un papel principal en la lucha contra la inflamación de bajo grado asociada con las enfermedades inflamatorias crónicas. Su acción está mediada por la microbiota intestinal y cualquier cambio microbiano inducido por la dieta modifica las interacciones huésped-microbio de manera consecuente, para mejorar la enfermedad (53, 54). La fibra fermentada por la microbiota intestinal produce metabolitos saludables que mejoran el desarrollo de la respuesta inmune y reducen la inflamación sistémica y local (50). Debido a esto se asocia que el consumo de la fibra puede conferir beneficios como coadyuvante en el tratamiento de la EM (Tabla 2).

Probióticos: En los últimos años se ha investigado la relación del eje microbiota intestinal-cerebro, que hace referencia a la conexión, tanto aferente como eferente, entre el cerebro y el sistema gastrointestinal mediante señales neuroendocrinas, nutrientes y señales inmunológicas (30). La dieta promueve el desarrollo de la microbiota, por tal razón, las intervenciones dietéticas tienen potencial en la prevención y tratamiento de enfermedades autoinmunes (50). La microbiota contribuye con funciones inmunológicas. En la barrera intestinal previene la colonización y el crecimiento de microorganismos patógenos, madura la barrera inmune, estimula tanto la respuesta innata como adaptativa. También condiciona el desarrollo de células T efectoras y la producción de citocinas, destacando la influencia sobre linfocitos Th17 y Treg implicados en la respuesta autoinmune y su regulación (30). Los probióticos debido a su acción antiinflamatoria y antioxidante han sido probados como parte del tratamiento para EM. Los metabolitos producidos, tras el consumo de probióticos, que tienen funciones antiinflamatorias son conocidos como Ácidos Grasos de Cadena Corta. Estos se unen y activan a los receptores (FFAR2, FFAR3 o GPR109a) en las células del epitelio intestinal para inhibir la energía nuclear de NF-kBf, potenciador de la cadena ligera de la vía de las células B activada para prevenir la inflamación (56). Algunos probióticos a los que se les ha evaluado por sus propiedades en esta patología se mencionan en la Tabla 3. Dónde, de manera general, su efecto en la EM se traduce como benéfico. (57).

Existen diversos estudios clínicos (Tabla 2) donde se ha demostrado que ciertos alimentos poseen efectos positivos en la EM, a continuación se mencionan con mayor detalle.
Aceite de pescado y de oliva: Su consumo ha mostrado tener efecto en la reducción de diferentes indicadores de inflamación factor de necrosis tumoral alfa (TNF-α), interleucina 1b (IL-1β), interleucina 6 (IL-6) y citocinas proinflamatorias), incremento en el nivel de citocinas antiinflamatorias como la interleucina 10 (IL10). Además, la suplementación con aceite de pescado tiene el rol de incrementar enzimas, como el glutatión reductasa (importante en el balance de EM). Evidencias de su efectividad han sido demostradas en pacientes de origen mexicano con EM en fase remitente-recurrente (EM-RR). Dónde los aceites, de pescado y oliva (combinados) (4g/día: 0,8 g EPA y 1,6 g DHA) o aceite de oliva (solo) (1 g de ácido oleico) durante un año mostraron un incremento en la fluidez de la membrana mitocondrial de plaquetas. Además, están directamente relacionados con una disminución en la hidrólisis del ATP y en ambos alimentos son consistentes las propiedades antioxidantes y antiinflamatorias (62-67), (Tabla 2).
Cacao: Es un producto alimenticio rico en flavonoides, estos compuestos presentan efecto cardioprotector, inhibidor en la peroxidación de lípidos, afectan al sistema nervioso central, y son relevantes como elementos para contrarrestar la fatiga en pacientes con EM. Lo anterior considerando que la producción de radical oxígeno es predominante en EM. Los flavonoides también inhiben la fagocitosis de mielina (70-72). Debido a su potencial efecto en la EM, Coe, 2019 y colaboradores determinaron su viabilidad y efecto potencial sobre la fatiga y fatigabilidad (Tabla 2) (73).
Cúrcuma (Curcuma longa): La cúrcuma contiene curcumina (diferuloimetano). Ésta presenta propiedades antioxidantes, antitumorales y antiinflamatorias reconocidas por ensayos preclínicos para el tratamiento de la inflamación. Para el caso de EM, la curcumina es recomendada específicamente por sus efectos antiinflamatorios y neuroprotectores (74). Estudios (75,76) han mostrado que la curcumina inhibe el efecto de la proliferación y diferenciación de células CD4+ por la disminución en la secreción de citocinas proinflamatorias, incluyendo IL-6. IL-1β. TGF-β, proteína quimiótactica de macrofágos -1 (PQM-1), IL17, interferon (IFN)-γ, TNF‐α, IL‐12, e IL‐23 (75,76). Sin embargo, considerando los posibles efectos en la enfermedad se requiere continuar con investigaciones al respecto (74-75).
Salmón: Según Jakobsen, 2019 (79) la ingesta recomendada de vitamina D es de 10 a 20 μg al día. El salmón salvaje es fuente importante de esta vitamina con un contenido de 8 a 55 μg/100g, en contraste con el salmón criado en granjas el cual aporta un rango de 4,2 a 10 μg /100 gramos de vitamina D. Debido a la importancia de la vitamina D en la EM, es importante que los pacientes consuman salmón de manera regular (80).
De acuerdo con la búsqueda realizada en la presente investigación los alimentos mencionados cuentan con evidencia científica de su aplicación en la patología de EM (Figura 1). Cada uno ejerce directa o indirectamente un efecto en la fisiopatología de la EM.
El Zn está implicado en la liberación de TNF-α, y se ha demostrado que aún, una deficiencia leve puede debilitar el funcionamiento del sistema inmune (32), se ha postulado que los bajos niveles pueden deberse a una mala absorción (81).
Por su parte el cobre puede catalizar las reacciones de Fenton generando especies reactivas de oxígeno que pueden dañar a las macromoléculas y si no son eliminadas podrían generar radical libre oxidrilo (OH), el cual es tóxico para las neuronas (82). A pesar de que se ha demostrado el papel de Zn en los procesos inmunológicos de la EM, sólo tres artículos (34, 29) reportan niveles significativamente bajos en pacientes con EM respecto a personas sanas y resultados benéficos del curso de EAE en ratones tras una ingesta alta de Zn (31). Se ha postulado que la diminución de Zn e incremento de Cu podrían ser parte de la etiología de la EM, causando daño oxidativo (83, 84), y podrían además ser uno de los detonantes de recaídas (84). Se ha mostrado que el cobre es usado en la síntesis de mielina y su deficiencia podría potencialmente causar mielopatía (85, 86) no obstante esto resulta contrastante, ya que se han reportado niveles elevados en pacientes con EM, en comparación con personas sanas (29). Los estudios en animales podrían hacerse extensivos en pacientes con EM administrando suplementos de Zn para indagar si tiene el mismo efecto en la mejora de la condición clínica, además la realización de estudios con mayor número de pacientes es necesaria para esclarecer su participación.
Por otra parte, la vitamina D ejerce efectos inmunomoduladores en células del sistema inmune innato y adaptativo (46). Algunos autores han demostrado que los pacientes con EM presentan niveles bajos de vitamina D en comparación con sujetos sanos, (42, 43), dichos niveles parecen ser influenciados por la estación del año, tal como lo reportan dos autores (39, 42) aunque con resultados contrastantes, ya que el primero reporta mayores niveles durante el verano, mientras que el segundo, en la misma estación reporta niveles bajos. El riesgo de mayor frecuencia de recaídas relacionado con los bajos niveles de vitamina D es reportado por dos artículos (41, 44). Otro estudio en modelo animal reveló que altas dosis de vitamina D parecen ser un estímulo para la aparición y severidad de EAE; el hallazgo puede ayudar a esclarecer e identificar la concentración adecuada para obtener acciones terapéuticas, además, podría alertar a los pacientes sobre una ingesta excesiva. En lo referente a la fibra, se ha demostrado que estimula el crecimiento de bifidobacterias, que producen efectos benéficos para la salud (50). Existe evidencia de que la microbiota intestinal puede influenciar el metabolismo y el estado inflamatorio (53).
Sin embargo, los estudios en humanos sobre la microbiota en la EM aún son escasos, una investigación de casos y controles, demostró cambio en el microbioma, con aumento de Methanobrevibacteriaceae y disminución de Lachnospiraceae y Butyricimonas en la EM (55). El primero conocido por su capacidad de reclutar células inflamatorias y activar las células dendríticas humanas y los segundos por su producción de butirato, un ácido graso de cadena corta (54), que mejora la producción de IL-10 e IL-4 (antinflamatorias) partir de monocitos estimulados con el marcador de células inmunes CD3 + (por sus siglas en inglés, cluster differenciation) llevando al sistema inmune a un estado no inflamatorio (87), por lo que las reducciones de butirato en el colon pueden alterar la función de barrera y promover la inflamación. Así mismo, cambios en la motilidad intestinal o en el sistema nervioso entérico, en pacientes con EM que cursan con estreñimiento, podrían producir condiciones favorables para el crecimiento de Methanobrevibacteriaceae (54). Por lo que, sería conveniente el consumo de fibra en estos pacientes, para incrementar la motilidad y conservar el microbioma intestinal.
El microbioma intestinal está constituido por probióticos que influyen en el sistema inmune y han sido implicado en desordenes inmunológicos incluyendo la EM (54). Mostrando cambios en la abundancia relativa de los géneros arquéales y bacterianos produciendo una disbiosis (88).
Dentro de los aspectos analizados referentes a EM y probióticos se encontraron la salud mental, discapacidad, condiciones metabólicas, inflamación, insulina, lípidos, modulación del microbioma, la respuesta inmune, niveles del Factor neurotrófico derivado del cerebro (FNDC), Factor de crecimiento nervioso (FCN) e interleucina-6(IL-6), motor y perfil metabólico, interleucinas y fatiga (57-61). El tema de salud mental fue analizado en tres investigaciones (57, 60, 62) utilizando diferentes mezclas de probióticos. En todas las indagaciones, dónde se evaluó la salud mental, se presentó un efecto significativo entre el consumo de probióticos con la EM (P< 0.05). Los demás factores analizados en las intervenciones tuvieron diferencias significativas traducidas como beneficio de los probióticos en la EM a excepción de los síntomas gastrointestinales, dónde no se identificaron diferencias.
Cabe resaltar que, existe heterogeneidad importante en los ensayos clínicos analizados, referente a las mezclas de probióticos utilizados, duración de la intervención y tipo de evaluación. Se requiere continuar con la investigación, considerando los efectos producidos por los probióticos en la EM.
En esta revisión también se analizaron componentes presentes en los siguientes alimentos: a) aceite de pescado y oliva; generando un efecto positivo a nivel molecular y celular, reducción en la secreción de células inmunes, aumento de ácidos grasos omega tres, fluidez mitocondrial, disminución de la actividad catabólica de la ATP sintasa, falta de regulación de la homeostasis de glutatión y actividad de la enzima glutatión dependiente y no hubo diferencias en la calidad de vida (65). Con la administración de aceite de pescado no se observó una reducción en los niveles séricos de interleucinas y tampoco mejoró la discapacidad de los pacientes. Se ha demostrado que ingestas de diferentes tipos de ácidos grasos poliinsaturados tienen un rol importante para determinar el estado inflamatorio en el cuerpo humano (89). b) la cocoa se ha probado para reducir la fatiga mostrando un efecto pequeño en la misma (de acuerdo con los autores) (73). Uno de los componentes analizados de la cocoa fueron los flavonoides. Estos pueden disminuir la expresión de citocinas proinflamatorias (IL-6, TNF-α, 1 β y COX-2 regulando a la baja los marcadores inflamatorios y previniendo el daño neural (90). c) cúrcuma, es una especie que destaca por su contenido de curcumina, un componente importante por su función antiinflamatoria (74, 91). El último alimento analizado es el salmón que actúa como elemento protector de la desmielinización por su contenido en vitamina D (92).
La nutrición constituye un complemento al tratamiento farmacológico de la enfermedad, ejerciendo efecto a nivel inflamatorio, sintomatológico y manejo de la patología. Se requiere continuar con la investigación, de manera uniforme (análisis de variables), para identificar el efecto de los componentes presentes en alimentos de forma independiente que puedan ser empleados como coadyuvantes en la EM y contribuir a mejorar la calidad de vida de los pacientes.
Los autores declaran que no tienen ningún conflicto de intereses.
Fecha de recepción: 10/04/2020
Fecha de aceptación: 29/06/2020