El propósito de este estudio fue describir la asociación entre el estado nutricional, la presencia de síndrome metabólico (SM), y el estado inflamatorio, en pacientes con Enfermedad de Chagas (ECh), atendidos en la consulta externa del Instituto de Medicina Tropical en Caracas. El estudio fue de tipo transversal y correlacional, en el cual se seleccionaron 34 pacientes a los cuales se les realizó un diagnóstico parasitológico, inmunológico y molecular de la ECh. Se evaluaron variables antropométricas, clínicas y bioquímicas, así como el SM el cual fue determinado por los criterios del III Panel estadounidense para el Tratamiento de Adultos del Programa Nacional de Educación sobre el Colesterol (ATP-III, por sus siglas en inglés). Se encontró que la mayoría de los pacientes presentaron sobrepeso u obesidad (73,5%), un porcentaje de grasa corporal (% GC) alto o muy alto (82,3%), y obesidad abdominal (61,8 %). La frecuencia de SM fue de 29,4% y más del 90% mostraron valores elevados de Proteína C Reactiva ultrasensible (PCRus). Valores más elevados del IMC se asociaron con un estadio más avanzado de la ECh. Los sujetos con presencia de ADN de Tripanosoma cruzi (T. cruzi) circulante en sangre, presentaron mayor % GC, y en su mayoría, fueron diagnosticados con SM. En conclusión, los pacientes evaluados mostraron un exceso de adiposidad, que puede favorecer el estado inflamatorio, el desarrollo de SM y la progresión de la ECh. Arch Latinoam Nutr 2020; 70(2): 101-114.
Palabras clave: Enfermedad de Chagas, estado nutricional, inflamación, síndrome metabólico, T. cruzi.
The purpose of the study was to describe the association between nutritional and inflammatory status and the presence of metabolic syndrome (MS) on patients with Chagas disease (CD) treated at the Outpatient Services of the Tropical Medicine Institute in Caracas, Venezuela. The study was cross-sectional and correlational. Thirty-four (34) patients were selected and a molecular, immunological, and parasitological diagnostic test was ran for Chagas disease. Anthropometric, clinic, and biochemical variables were evaluated, and the MS was determined using National Cholesterol Education Program Expert/Adult Treatment Panel III (ATP-III) criteria. The results showed a high percentage of patients overweight or presenting obesity (73.5%), a high and very high percentage of body fat (82.3%), and abdominal obesity (61.8%). The prevalence of MS was 29,4% and more than 90% of patients showed elevated values of high sensitivity C-reactive protein (hsCRP). Higher body-mass index values were associated with advanced stages of the CD. Subjects in the presence of T. cruzi DNA in the blood showed a greater percentage of body fat and, most of them, were diagnosed with MS. In conclusion, the evaluated patients showed an excess of adiposity which may favor an inflammatory status, the development of the MS, and the progress of the CD. Arch Latinoam Nutr 2020; 70(2): 101-114.
Key words: Chagas disease, nutritional status, inflammatory status, metabolic syndrome, T. cruzi.
https://doi.org/10.37527/2020.70.2.003
Autor para la correspondencia: Clara Martínez, email: [email protected]
La ECh debe su nombre al médico brasileño Carlos Ribeiro Justiniano das Chagas, quien la dio a conocer en 1909 (1), es una enfermedad potencialmente mortal causada por el parásito protozoo Tripanosoma cruzi. Se calcula que a nivel mundial hay entre 6 y 7 millones de personas infectadas por Tripanosoma cruzi, la mayoría de ellas en América Latina (2). En el área endémica de Sudamérica y Centroamérica, la ECh se transmite principalmente a través del contacto con las heces del triatomino infectado. En las zonas no endémicas (Estados Unidos, Europa, Canadá, Japón y Australia), la ECh se transmite a través de la transfusión de sangre, trasplante de órganos y por transmisión congénita (3). Los programas de control de vectores han reducido en gran medida la transmisión de la enfermedad en las áreas endémicas de América Latina.
El Tripanosoma cruzi tiene un ciclo de vida complejo y sufre varias transformaciones durante el proceso de infección. De acuerdo con la Organización Mundial de la Salud (OMS) (2), la ECh tiene dos fases clínicas distintas: aguda y crónica. La fase aguda se caracteriza por parásitos encontrados en el torrente sanguíneo, que se replican dentro de los macrófagos y una variedad de células hospederas, especialmente las células del músculo cardíaco. La fase crónica tiene dos formas: indeterminada (no presenta síntomas ni signos de lesión visceral) y la fase sintomática con afectación cardíaca o digestiva (4). La mayoría de los pacientes sobreviven a la fase aguda y entran en la etapa indeterminada sin síntomas evidentes de la enfermedad, que puede durar para toda la vida, sin embargo, el 30% de los pacientes desarrollan la enfermedad crónica, que incluye síntomas graves tales como megaesófago, megacolon, y la enfermedad cardíaca crónica (3).
En Venezuela, han sido reportados 3 de los 6 genotipos de Tripanosoma cruzi (Tc) identificados como: TcI, TcII, TcIII, TcIV, TcV y TcVI (4). Solo dos de ellos, TcI y TcIV, se han encontrado en pacientes con enfermedad cardíaca, predominando en un 80% el genotipo TcI (5,6).
Durante el proceso de la infección por Tripanosoma cruzi, el parásito interactúa con una amplia gama de componentes inmunológicos y metabólicos del hospedero (3). Aunque se han realizado muchos estudios en modelos experimentales de animales y células humanas, los mecanismos fisiopatológicos que finalmente resultan en la miocardiopatía chagásica, siguen siendo inciertos (7).
La infección por Tripanosoma cruzi resulta en la regulación positiva de la vía proinflamatoria caracterizada por aumento de la expresión del factor de necrosis tumoral alfa (TNF-α) y de la interleukina 6 (IL-6), los cuales son esenciales para el control de la parasitemia aguda, pero también puede tener efectos adversos sobre el hospedero (7,8).
Las alteraciones en el metabolismo como la resistencia a la insulina y el incremento del tejido adiposo (TA) pueden conducir a un estado inflamatorio sistémico que contribuye a la vasculopatía y al riesgo cardiovascular (9).
Se sabe que la diabetes está íntimamente asociada al aumento del riesgo cardiovascular. El síndrome metabólico (SM), caracterizado por obesidad central, dislipidemia, hiperglicemia y presión arterial limítrofe, es hoy uno de los mayores retos para la salud pública en todo el mundo, por asociarse a un importante riesgo para enfermedad cardiovascular y diabetes tipo 2 (10). Con el avance de la edad, hay un riesgo mayor para el desarrollo del SM, debido a una mayor prevalencia de sus componentes entre los adultos mayores (11). Este aumento de la obesidad y la diabetes tipo 2 en el mundo, incluye aquellos países en los que la ECh es endémica.
Tomando en cuenta los hallazgos anteriores y la ausencia de trabajos que evalúen de manera rigurosa el estilo de vida y el estado nutricional de los pacientes con ECh, el presente trabajo de investigación se propuso describir la asociación entre el estado nutricional, la presencia de SM, y el estado inflamatorio, en pacientes con ECh que acudieron a la consulta externa del Instituto de Medicina Tropical (Caracas). Esta investigación permitió dar un nuevo enfoque para el estudio de la ECh en un contexto donde la nutrición del paciente pueda ser un factor terapéutico o de control del riesgo del desarrollo de la cardiopatía chagásica.
La investigación se llevó a cabo siguiendo los principios éticos para las investigaciones médicas en seres humanos (12) y se contó con el consentimiento escrito, previa aprobación del Comité de Ética del Instituto de Medicina Tropical (IMT) de la Universidad Central de Venezuela (UCV). El estudio fue transversal de tipo correlacional, se llevó a cabo en el Laboratorio de Antropometría de la Escuela de Nutrición y Dietética, Facultad de Medicina, y en el Laboratorio de Biología Molecular de Protozoarios del IMT-UCV. En esta investigación participaron 34 pacientes adultos de ambos sexos con ECh crónico, que acudieron a la consulta de manera consecutiva durante el período junio 2015 - abril 2016, y accedieron voluntariamente a participar en el estudio.
Como criterios de exclusión se consideraron todos aquellos pacientes que tuvieran en curso enfermedades diarreicas, enfermedad inflamatoria intestinal, cáncer y pacientes con enfermedades degenerativas, el uso de medicamentos antiinflamatorios, suplementos de ácidos grasos omega 3, vitamina C y E durante los últimos 30 días, mujeres embarazadas y en lactancia.
Ensayo por inmunoabsorción ligado a enzimas (ELISA, por sus siglas en inglés): se utilizó como antígeno un extracto total de epimastigotes de un aislado de Tripanosoma cruzi TcI, deslipidizado y liofilizado, concentrado a 0,67 mg/mL, siguiendo en general la técnica de Voller et al. (1976) (13) realizando algunos ajustes prácticos de acuerdo a Alarcón de Noya et al. (2009) (14).
Determinación de parasitemia: se extrajeron 10 ml de sangre venosa periférica a cada paciente, los cuales fueron usados según la técnica de xenodiagnóstico modificado de Maekelt (1964) (15), para alimentar hasta la ingurgitación a 20 ninfas sanas de III y IV estadio de Rodnius prolixus, se examinaron sus heces a los 15, 30 y 45 días, para determinar la presencia de estadios polimórficos de Tripanosoma cruzi.
El contenido de la disección del intestino de los insectos fue mezclado con solución salina, para realizar extendidos que fueron teñidos con Giemsa, para cuantificar el número de tripomastigotes metacíclicos según Brener (1962) (16), con lo cual se inocularon i.p. 200 tripomastigotes metacíclicos/g de peso de lote de cinco ratones albinos, cepa NMRI de 15 g promedio, de acuerdo con Jansen et al. (1997) (17). A partir del tercer día post-inoculación y luego tres veces por semana, se determinó la presencia y morfología de los flagelados sanguícolas (18,19), las cuales fueron cuantificadas según Brener (1962) (16).
El hemocultivo se realizó con sangre total de los pacientes; para ello se colocaron 0,2-0,3 ml de sangre, asépticamente en tubos con medio bifásico Davis adicionado con Gentamicina (100μg/ml) incubados a 28ºC y examinados a los 7,15 y 30 días más tarde.
Reacción en Cadena de la Polimerasa (PCR, por sus siglas en inglés): para la extracción de ADN en sangre total se utilizó el kit de Nucleon™ BACC2 Genomic DNA from blood and cell cultures Fluids (Amersham, Bioscience), siguiendo las instrucciones del fabricante. Se procesaron 0,2 ml de sangre venosa. La concentración de ADN se determinó por espectrofotometría de luz ultravioleta, mediante la determinación de la densidad óptica (DO) a 260 nm. La pureza del ADN se estableció determinando el factor derivado de la relación A260/A280. La concentración se determinó tomando en cuenta que 1 unidad (u) de DO equivale a 50 μg/ml.
Se utilizó la técnica de PCR convencional para la detección de ADN mini-satélite de Tripanosoma cruzi según el protocolo descrito por Moser et al. (1989) (20) empleando los cebadores específicos: TcZ1 (cebador directo) 5`-CGAGCTCTTGCCCACACGGGTGCT-3` y TcZ2 (cebador reverso) 5`-CCTCCAAGCAGCGGATAGTTCAGG-3`. Las reacciones de amplificación del fragmento de 188 pb se realizaron según el protocolo descrito (20) con modificaciones para adaptarlo a las condiciones del laboratorio. Las condiciones de reacción fueron: desoxinucleótidos trifosfato (dNTP), 200 μmol/L, cebadores 0,5 μmol/L, Cloruro de magnesio 2 mmol/L y Taq Polimerasa 1U. La PCR se llevó a cabo por duplicado, utilizando como control negativo ADN de un paciente sano y un control de contaminación agregando agua en lugar de ADN. Se utilizaron las siguientes condiciones en el termociclador: Desnaturalización inicial a 94ºC durante 10 minutos, seguido de 30 ciclos de desnaturalización a 94ºC por 30 segundos, hibridación a 55ºC por 30 segundos y extensión a 72ºC por 30 segundos, terminando con una extensión final a 72ºC, durante 10 minutos.
Los productos de PCR fueron analizados en electroforesis de geles de agarosa al 2%, aplicando 80 volts/cm durante 45 minutos en Buffer TAE 1X. Posteriormente, fueron teñidos con bromuro de etidio 5 mg/ml durante 10 minutos, desteñidos 10 minutos y fotodocumentados en un equipo Chemi Doc XRS BioRad.
Colesterol total (CT), triacilglicéridos (TG) y glucosa plasmática: se determinaron utilizando el método enzimático colorimétrico según los procedimientos e instrucciones del kit de la casa comercial Wiener Laboratorio.
Colesterol de la lipoproteína de alta densidad (cHDL, por sus siglas en inglés): para su determinación se empleó el sistema enzimático Colesterol oxidasa/Peroxidasa con colorimetría según Trinder (1969)(21).
Colesterol de la lipoproteína de baja densidad (cLDL, por sus siglas en inglés): se estimó mediante la fórmula propuesta por Friedewald et al. (1972)(22).
Índices de riesgo cardiometabólico: se determinaron los índices CT/cHDL, cLDL/cHDL y TG/cHDL. Se consideró riesgo cardiometabólico una relación CT/cHDL: ≥ 4,5 (23), cLDL/cHDL: ≥ 3 (23) y TG/cHDL: ≥ 3 (24).
Marcador de Inflamación: se determinó la PCRus a través del método turbidimétrico de la casa comercial Turbox Orion Diagnóstica. Se consideróbajo riesgo cardiovascular una concentración sérica de PCRus < 1 mg/L, riesgo medio de 1 a 3 mg/L y riesgo alto > 3 mg/L (25).
Se midieron las siguientes variables antropométricas: peso, talla, pliegues subcutáneos (tríceps y subescapular) y circunferencia de cintura, siguiendo los criterios del Programa Biológico Internacional (26).
El peso se determinó con una balanza digital Tanita modelo HD-314 y fue registrado en kilogramos (kg). Para la talla se utilizó un estadiómetro de pared, Harpenden, marca Holtain y los resultados fueron expresados en centímetros. Para la determinación de la circunferencia de cintura se utilizó una cinta métrica modelo Lufkin Executive Thinline y los resultados se expresaron en centímetros. Finalmente, para la determinación de los pliegues cutáneos, se utilizó un calibrador marca Holtain. Se construyeron los siguientes indicadores: Índice de masa corporal (IMC), porcentaje de grasa corporal (% GC) e índice cintura-talla (ICT).
De acuerdo a su IMC los pacientes fueron clasificados en normopeso (IMC 18,5-24,9 kg/m2), sobrepeso (IMC 25-29,9 kg/m2) y obesidad (IMC≥30 kg/m2) (27). Para el cálculo del % GC se utilizó la ecuación de SIRI (28), y el cálculo de la densidad corporal con dos pliegues (tríceps y subescapular), de acuerdo a lo recomendado por Durning (29). El % GC fue interpretado usando los valores percentilares de referencia del adulto venezolano (30).
Finalmente, se consideró riesgo metabólico elevado asociado a obesidad central, un ICT mayor de 0,5 (31).
Tensión arterial: se realizó con esfigmomanómetro aneroide, según la técnica: paciente sentado, previo a reposo físico mayor a 5 minutos, y con lapso mayor a 30 minutos de no haber ingerido líquidos o alimentos. Con el brazo no dominante apoyado sobre superficie dura, se realizó la toma de tensión a nivel de la arteria braquial.
Síndrome Metabólico (SM). Se emplearon los criterios para el diagnóstico clínico de SM del III Panel estadounidense para el Tratamiento de Adultos del Programa Nacional de Educación sobre el Colesterol (ATPIII, del inglés Adult Treatment Panel III) en su versión modificada (23): obesidad abdominal (Perímetro de cintura >102 cm en hombres y > 88 cm en mujeres); Triglicéridos elevados (≥ 150 mg/dL o en tratamiento hipolipemiante específico); cHDL bajo (< 40mg/dL en hombres o < 50 mg/dL en mujeres), o en tratamiento con efecto sobre cHDL; presión arterial elevada (≥ 130/85 mm/Hg); alteración en la regulación de la glicemia (glucemia ayunas ≥ 100 mg/dL o en tratamiento para glucemia elevada). El diagnóstico se realizó por la presencia de tres de los cinco criterios anteriores.
Fases Evolutivas de la Enfermedad de Chagas: los pacientes fueron clasificados en tres fases evolutivas de acuerdo con los criterios de Carrasco et al. (1994) (32): fase I: pacientes asintomáticos sin evidencias electrocardiográficas y/o ecocardiográficas de afección cardíaca; fase II: pacientes asintomáticos con signos electrocardiográficos y/o ecocardiográficos de afección cardíaca; fase III: pacientes con insuficiencia cardíaca.
Los resultados se expresaron en términos de medidas de tendencia central y de dispersión, así como también en frecuencias absolutas y relativas. Para evaluar la normalidad de la distribución de las variables cuantitativas se utilizó la prueba de Shapiro-Wilk. Las comparaciones entre grupos se realizaron a través de las pruebas t de Student y U de Mann Whitney, la selección de la prueba se basó en la distribución estadística de las variables. Las asociaciones se evaluaron mediante las pruebas chi cuadrado (χ2) y exacta de Fisher, mientras que las correlaciones se analizaron con las pruebas de Pearson y Spearman. Para las comparaciones de las proporciones, como en el caso de los factores de riesgo para SM según el sexo, se empleó el estadístico Z. El nivel de significancia utilizado fue de 0,05 y el programa estadístico empleado fue el SPSS versión 17.0 (33).
Se estudiaron 34 pacientes con ECh, de los cuales 22 (64,7%) eran del sexo femenino y 12 (35,3%) del masculino. No hubo diferencias significativas entre las edades de los sujetos de uno u otro sexo (Masculino: 59,2±11,1 años vs. Femenino: 60,1±13,9 años; p=0,844). Los títulos de anticuerpos anti Tripanosoma cruzi fueron en promedio de 0,88±0,36 y no se observaron diferencias significativas entre dichos títulos de anticuerpos según el sexo (Masculino: 0,84±0,41 vs. Femenino 0,90±0,34; p=0,656). Las pruebas parasitológicas (xenodiagnóstico indirecto y hemocultivo), dieron resultados negativos.
El análisis de las muestras mediante PCR permitió detectar ADN de T. cruzi circulante en sangre, solo en 5 (14,7%) de los pacientes evaluados, entre los que se encontraron 3 (60%) del sexo femenino y 2 (40%) del masculino (p=0,590).
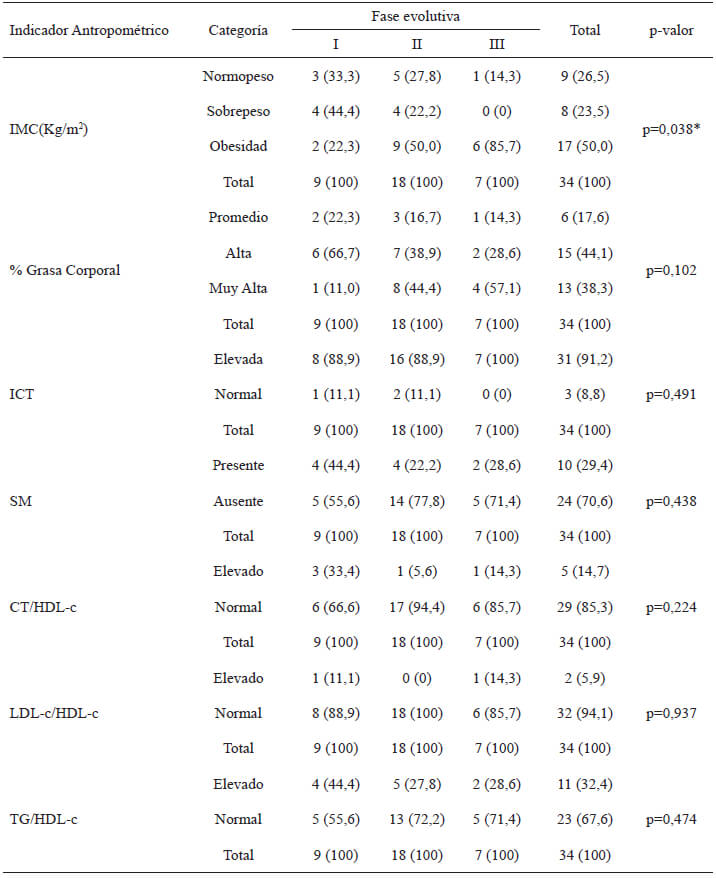
Utilizando como criterio la fase evolutiva de la enfermedad, 9 (26,5%) de los pacientes, fueron diagnosticados como Chagas I, mientras que 18 (52,9%) fueron agrupados como Chagas II y 7 (20,6%) como Chagas III, respectivamente. En todas las fases evolutivas de la enfermedad, se detectaron pacientes que presentaban ADN de T. cruzi circulante en sangre (fase I= 2; fase II= 2; fase III=1).
En la tabla 1 se muestran los estadísticos descriptivos y la comparación por sexo, de las variables antropométricas evaluadas. Se encontraron diferencias significativas entre los sexos para la talla y el % GC; siendo mayor la mediana de la talla en los hombres, y mayor la mediana del % GC en las mujeres. De acuerdo con la mediana de la CC, más del 50% de las mujeres presentaron valores de riesgo cardiovascular, mientras que más del 50 % de los hombres mostró valores adecuados de este indicador de adiposidad. Sin embargo, al corregir la CC por la estatura (ICT), se encontró un alto riesgo cardiovascular por adiposidad central, tanto en hombres como en mujeres.
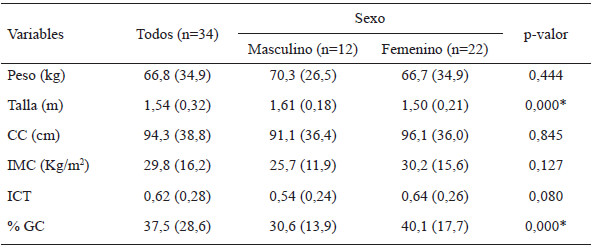
Se encontraron correlaciones positivas y significativas entre el IMC y el % GC (r= 0,57; p<0,01), la CC (r=0,81; p<0,01) y el ICT (r= 0,83; p< 0,01), indicando que los aumentos en los valores del IMC se asociaron con aumentos proporcionales en el % GC, CC e ICT. También se encontraron correlaciones significativas y positivas entre el % GC y la CC (r= 0,38; p < 0,05), y entre % GC y el ICT (r=0,53; p<0,01), por lo que los cambios observados en el % GC se asociaron directamente con las variaciones en la CC e ICT.
En la tabla 2 se muestran las frecuencias absolutas y relativas de las diferentes categorías de los indicadores antropométricos de los pacientes evaluados. Para todos los sujetos estudiados las categorías más frecuentes fueron: obesidad según el IMC, % GC alta, y CC e ICT elevados. Por otro lado, el estado nutricional antropométrico medido por el IMC (p=0,264), el % GC (p=0,425) y el ICT (p=0,279) no se asociaron al sexo de los adultos con ECh estudiados. Sin embargo, las mujeres presentaron una mayor frecuencia de valores elevados de CC, respecto a los hombres (p= 0,025).

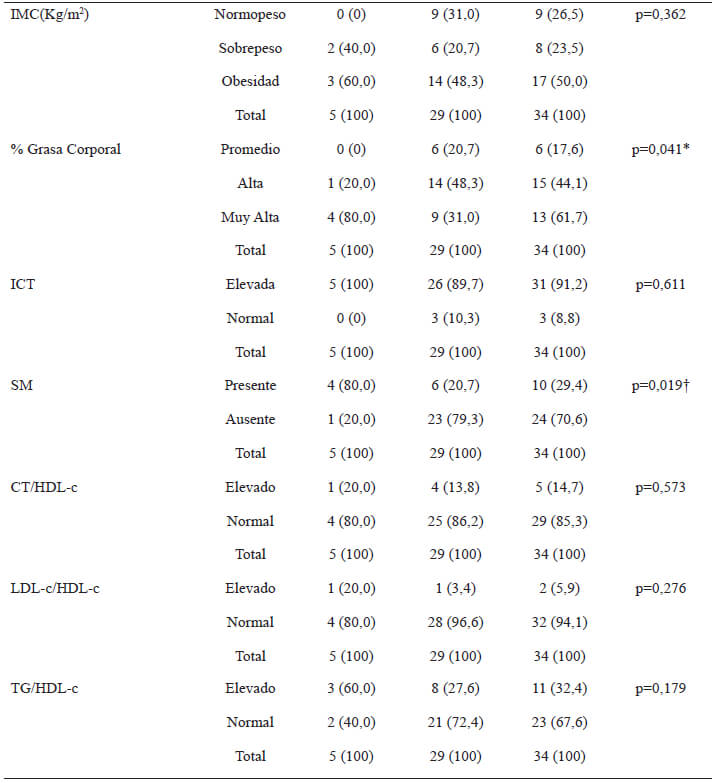
De acuerdo con la presencia de factores de riesgo para SM (tabla 3), un alto porcentaje (61,8%) de los pacientes evaluados presentaron obesidad abdominal, la más alta para los criterios de SM. Así mismo, se encontró un 41,2% de individuos con cifras de glucosa alterada, 38,2% de hipertrigliceridemia y finalmente un 23,5% de HTA en los sujetos estudiados. En este sentido, el 29,4% de los sujetos evaluados presentaron 3 o más factores de riesgo, lo que significa, que fueron diagnosticados con SM.
Respecto a los índices de riesgo cardiometabólico (tabla 3), la relación TG/HDL-c presentó la más alta proporción, seguido de la relación CT/HDL-c y LDL-c/HDL-c. No se encontró asociación significativa entre estos indicadores y el sexo de los participantes.

La mediana para las concentraciones séricas de la PCRus fue de 2,9 mg/dL (rango= 3,5) en el total de la muestra, sin diferencias significativas asociadas al sexo (p>0,05). La clasificación del riesgo cardiovascular de acuerdo con los valores de la PCRus como marcador de inflamación, se muestra en la tabla 4. Una elevada proporción de los sujetos estudiados presentaron un riesgo cardiovascular medio o alto. La proporción de sujetos del sexo masculino con riesgo medio resultó significativamente superior a la encontrada en el sexo femenino.

Por otra parte, se evaluaron las asociaciones entre la presencia de ADN de T. cruzi (tabla 5), o la fase evolutiva de la enfermedad (tabla 6), y el estado nutricional, la presencia de SM y los índices de riesgo cardiometabólico, en pacientes adultos con ECh. La presencia de ADN de T. cruzi se correlacionó positivamente con el % GC y con el SM; es decir, los sujetos con presencia de ADN de T. cruzi circulante en sangre, presentaron mayor % GC en comparación con aquellos a los que no se le detectó ADN del parásito; así mismo, el 80% de los sujetos que presentaron ADN de T. cruzi fueron diagnosticados con SM (tabla 5). En adición, el avance en la fase evolutiva de la enfermedad se asoció con un aumento en el IMC, encontrándose que una elevada proporción de los pacientes que se hallaban en las fases 2 (50,7%) y 3 (85%) de la enfermedad, presentaron obesidad de acuerdo con el IMC (tabla 6). Finalmente, se observó que las concentraciones séricas de la PCRus correlacionaron significativamente con la presencia del ADN de T. cruzi (rho=0,352; p=0,041); sin embargo, no se asociaron con la fase evolutiva de la ECh (rho=0,037; p=0,836).
La PCR es un método sensible, debido a que amplifica una secuencia específica del ADN de T. cruzi generando múltiples copias (34). Con la utilización de esta técnica se logró detectar ADN de los parásitos a pesar de que estos suelen estar confinados a los tejidos en la fase crónica (34). La detección de parásitos circulantes en una fracción de pacientes con infección crónica, indica que el ciclo de vida del parásito intracelular está activo, al menos de forma intermitente (35), por lo que las formas circulantes del parásito solo pueden detectarse cuando estos son liberados al torrente sanguíneo.
En lo que respecta al estado nutricional de los pacientes con ECh, mostraron un porcentaje elevado de sobrepeso y obesidad, un porcentaje de grasa corporal alto o muy alto y valores de CC e ICT elevados. Resultados similares fueron reportados anteriormente en Brasil, donde de 66 pacientes evaluados, el 94% tenía sobrepeso u obesidad y el 55% presentó aumento de la circunferencia de cintura (36), así mismo en Argentina de los 113 pacientes evaluados, el 70% de los hombres y el 90% de las mujeres presentaron sobrepeso u obesidad; además, el 78% de las mujeres y el 27% de los hombres, presentaron un índice cintura/cadera de riesgo cardiovascular (37).
Es importante resaltar, que el ICT es un indicador que no ha sido utilizado en estudios de pacientes con ECh. En Venezuela, existe muy poca información sobre la relación cintura/talla en adultos. Sin embargo, los resultados del presente estudio coinciden con los reportados por otros investigadores en población adulta sin ECh (38,39). El ICT puede ser un óptimo predictor de factores de riesgo del SM y de obesidad abdominal específicamente, la cual está asociada con enfermedades crónicas no transmisibles (40).Algunos investigadores le conceden un valor particular al ICT, al opinar que es mejor predictor de riesgo metabólico y coronario (dislipidemias y diabetes tipo 2) en pacientes con SM (31).
La frecuencia de obesidad abdominal encontrada en esta investigación fue similar a la referida en varios estudios realizados en Brasil en adultos con ECh (36,41).Se ha planteado que la obesidad abdominal sería el más importante de los factores de riesgo y el que conllevaría al desencadenamiento de las demás anormalidades en el SM. Por otra parte, la frecuencia de hiperglicemia e hipertrigliceridemia encontrados en el presente estudio, fueron mayores a la estadística general reportada en Brasil en pacientes con ECh (36, 41, 42).
El análisis de la literatura existente, apoya claramente la idea de que la infección con T. cruzi conduce a un estado hipoinsulinémico en el huésped infectado. La hipoinsulinemia inducida por T. cruzi ha sido demostrada y caracterizada parcialmente en un modelo murino de ECh (43). Además, hay evidencia en humanos que padecen la ECh, de una reducción de la secreción de insulina (42). También se ha observado una relación entre la infección por T. cruzi y la resistencia a la insulina, especialmente en lo que respecta a la función adipocítica (44).
En este estudio, la relación TG/HDL-c presentó la frecuencia más alta entre los índices de riesgo cardiometabólico. La presencia de alteraciones lipídicas, probablemente se deba al incremento de la adiposidad abdominal en este grupo de pacientes. Existe evidencia contundente, tanto en animales como en humanos que los lípidos pueden inducir resistencia a la insulina (45). Hasta la fecha solo se ha reportado un estudio donde se observa una relación entre la miocardiopatía chagásica crónica y el índice aterogénico expresado como la relación TG/HDL-c, donde este índice se asoció con la severidad de la enfermedad (46). El uso de los índices lipídicos resulta nuevo en pacientes con ECh. Si bien no se cuenta con numerosos estudios donde se evalúen estas relaciones lipídicas con la enfermedad, resulta interesante que en la presente investigación el índice más alterado haya sido TG/HDL-c, lo que es consistente con otros estudios realizados en población adulta con exceso de peso, donde el índice TG/HDL-c aumenta en relación con el aumento de la masa corporal (47). Adicionalmente, este índice lipídico presenta una asociación estadísticamente significativa con la glucosa alterada en ayuno, así como con el SM y la sensibilidad a la insulina (48,49).
Una elevada proporción de los sujetos estudiados presentaron un riesgo cardiovascular medio o alto, de acuerdo con los valores de PCRus como marcador de inflamación. Aunque la PCRus es un marcador inflamatorio inespecífico, es un fuerte predictor independiente de riesgo y eventos de enfermedad coronaria (50). Por otra parte, se ha descrito que los componentes del SM se correlacionan con concentraciones aumentadas de PCRus en plasma y la medición de PCRus contribuye a la predicción del riesgo en individuos con SM (50). Sin embargo, en esta investigación no se encontraron correlaciones significativas entre los indicadores antropométricos, la glicemia, la presión arterial, el perfil lipídico, incluyendo los índices de riesgo cardiometabólico, y la PCRus. La mayoría de los pacientes evaluados, mostraron valores elevados de este marcador de inflamación, independientemente de la presencia de factores de riesgo para SM. Es probable que el estado inflamatorio observado, esté asociado principalmente con la infección por el parásito.
El incremento del SM va asociado a la expansión de la epidemia mundial de diabetes tipo 2 y de enfermedades cardiovasculares. El SM aumenta con la edad, es un poco más frecuente en mujeres y se ha incrementado en la última década (51).En Venezuela, la prevalencia varía entre 25,8 a 41,7% según los datos publicados y la metodología utilizada (52). Si se comparan los resultados obtenidos de esta investigación con la estadística de SM en Venezuela, se observa que la frecuencia de SM en la población adulta con ECh, se ubica dentro del rango para la población adulta sin ECh en el país. Aunque el SM es una amenaza importante para la salud pública, su asociación con la ECh comienza a ser estudiada.
El Tripanosoma cruzi se replica y persiste dentro de tejidos que tienen una alta tasa de metabolismo de ácidos grasos tales como el músculo cardíaco y el TA, por ello el adipocito es un objetivo importante para la infección por T. cruzi. Este cambia profundamente su homeostasis celular, tanto in vitro como in vivo, como consecuencia de dicha infección (53). Los amastigotes, forma intracelular de T. cruzi, se benefician del entorno metabólico de la célula huésped que favorece la oxidación de ácidos grasos sobre la oxidación de glucosa. El silenciamiento de enzimas como la piruvato deshidrogenasa PDH, enzima clave del equilibrio entre la utilización de glucosa y de ácidos grasos, promueve el crecimiento de los amastigotes. Adicionalmente la permanencia de T. cruzi en los adipocitos le ofrece una ventaja selectiva porque le permite sobrevivir frente a la respuesta inmune (54) y puede permanecer en los mismos como un área de reserva.
El SM es un estado de inflamación crónica de bajo grado. Esto se ha relacionado con la liberación de citocinas por el TA (54). En este sentido, pareciera que una composición corporal predominantemente adiposa favorece la presencia del parásito y ambos eventos, probablemente contribuyen con el desarrollo del SM en los pacientes con ECh. Este es el primer estudio en el que se reporta el % GC y SM como variables asociadas a la presencia de ADN T. cruzi circulante en pacientes crónicos con ECh.
A diferencia de los resultados positivos emergentes en los estudios sobre la obesidad y el SM denominado "paradoja de la obesidad", observado en varias condiciones médicas, infecciosas y no infecciosas, incluyendo la ECh, donde la adiposidad proporciona un "escudo inmuno-metabólico" que beneficia a las personas en su lucha contra estas enfermedades (55), en esta investigación, se encontró que la obesidad medida por el IMC, se asoció con la progresión de la ECh, lo cual difiere de otras investigaciones donde la obesidad se ha relacionado con una menor probabilidad de presencia de T. cruzi (56,57). Posiblemente esto se deba a que dichos estudios, han sido realizados en regiones geográficas donde predominan los genotipos TcII, TcV y TcVI, asociados con enfermedad digestiva la cual produce trastornos gastrointestinales y pérdida de peso (4,58), mientras que, en Venezuela, ha sido encontrado predominantemente el genotipo TcI (4-6), asociado a la forma cardíaca, que es la manifestación más grave y frecuente de la ECh crónica en el país. En este sentido, es bien conocido, que los pacientes con ECh cardíaco tienden a acumular más TA que aquellos que tienen la forma digestiva (59).
La presencia de obesidad en estos casos aumenta significativamente la morbilidad y mortalidad por otras enfermedades, como hipertensión, dislipidemia, enfermedad arterial coronaria, enfermedades del tracto biliar, enfermedades osteoarticulares, diabetes tipo 2 y algunos cánceres. Asimismo, la obesidad se asocia con estados de inflamación crónica de bajo grado que promueve la secreción de citocinas, conduce al inicio de eventos proinflamatorios y estrés oxidativo, y este conjunto de desequilibrios inmuno-metabólicos, pueden favorecer el establecimiento de la miocardiopatía chagásica crónica (60). Sin embargo, se necesitan más estudios para confirmar la relevancia de estas observaciones y su importancia fisiológica, en especial, el impacto que un elevado IMC pueda tener en la evolución de la ECh.
Una limitación del presente estudio fue el tamaño muestral, por lo que es necesario a futuro evaluar un mayor número de pacientes, y de esta forma tener resultados más concluyentes. En este sentido, es recomendable, profundizar en la evaluación de la composición corporal y en el uso de nuevos indicadores antropométricos para estimar el estado nutricional de los individuos, además de la utilización de los índices lipídicos y la relación de cada una de estas variables con la progresión de la ECh. Igualmente, es importante poder identificar los genotipos y evaluar la ausencia de manifestaciones digestivas.
En conclusión, los resultados sugieren que un exceso de adiposidad podría favorecer la supervivencia del parásito, contribuir con el desarrollo del SM y de un estado inflamatorio en los pacientes con ECh, agravando de esta manera la evolución de la enfermedad. Este estudio pone de manifiesto la importancia de la evaluación nutricional de estos pacientes, con el propósito disminuir las comorbilidades, y alcanzar una mejor calidad de vida. El presente trabajo abre las puertas para un nuevo enfoque en el estudio de la ECh.
Al Dr. Iván Mendoza sin cuya invaluable colaboración habría sido imposible realizar este estudio. A la técnico de laboratorio Marlenes Rodríguez por su colaboración.
Los autores declaran que no tienen ningún conflicto de intereses.
Recibido: 27/05/2020
Aceptado: 21/09/2020