Este trabajo se fundamenta en la evaluación de la actividad antiinflamatoria de extractos de sofrito de tomate, así como de compuestos estándares de la dieta mediterránea, usando un modelo experimental optimizado basado en larvas de pez cebra. La migración de neutrófilos en larvas de pez cebra de 96 horas post fertilización se indujo mediante una lesión y se potenció añadiéndole lipopolisacárido, dicha migración se visualizó y cuantificó mediante análisis de imagen. El efecto antiinflamatorio del extracto de tomate y de los compuestos utilizados fue correlacionado porcentualmente por la disminución de la migración de los neutrófilos. Los resultados muestran que el extracto de tomate presentó una reducción en la migración de neutrófilos de 40 % respecto al grupo control. Por otra parte, el ácido clorogénico y la cianidina presentes en el sofrito de tomate utilizados como estándares presentaron una disminución de la migración de neutrófilos de un 66,7 % y 62,5 % respectivamente. Estos porcentajes son comparables a los resultados observados en ensayos con drogas antiinflamatorias como la indometacina y piroxicam. Los resultados muestran que el extracto de sofrito de tomate presenta posible actividad antinflamatoria demostrada por la reducción de la migración de neutrófilos, además el modelo se mostró sensible y válido para ser aplicado en matrices alimentarias complejas. Arch Latinoam Nutr 2020; 70(3): 182-190.
Palabras clave: Pez cebra, antiinflamatorio, neutrófilos, dieta mediterránea, migración, sofrito de tomate.
The main of this study was to evaluate the anti-inflammatory activity of tomato sofrito extracts, as well as standard compounds present in the Mediterranean diet, using an optimized experimental model based on zebrafish larvae. Neutrophil migration in zebrafish larvae 96 hours post fertilization was induced by a cut in the caudal fin and enhanced by adding lipopolysaccharide and was visualized and quantified by image analysis. The anti-inflammatory effect of tomato extract and the compounds used was correlated by the percentage decrease in the migration of neutrophils. The results showed that, tomato extract showed a reduction in neutrophil migration of 40% compared to the control group. Moreover, chlorogenic acid and cyanidin present in tomato sofrito sauce showed a decrease in neutrophil migration of 66.7% and 62.5% respectively. These percentages are comparable to the results observed in trials with anti-inflammatory drugs such as indomethacin and piroxicam. The results show that tomato sofrito extract has possible anti-inflammatory activity demonstrated by the reduction of neutrophil migration, furthermore the model was sensitive and valid to be applied in complex food matrices. Arch Latinoam Nutr 2020; 70(3): 182-190.
Key words: Zebrafish, anti-inflammatory, neutrophils, Mediterranean diet, migration, tomato sauce.
https://doi.org/10.37527/2020.70.3.004
Autor para la correspondencia: Alberto Bustillos, email: [email protected]
Varias enfermedades crónicas tienen en su etiología y mecanismo patológico un importante componente de tipo inflamatorio. La inflamación surge como una respuesta del sistema inmune del organismo al daño celular y tisular, e involucra un componente celular y otro oxidativo (1). El componente celular implica el movimiento de leucocitos, principalmente de neutrófilos de los vasos sanguíneos hacia el tejido lesionado (2). Una vez que los leucocitos llegan al sitio de la lesión, se disparan una serie de procesos que incluyen la formación de radicales libres y la liberación de ácido araquidónico desde los fosfolípidos de la membrana, el cual es metabolizado por la vía de las ciclooxigenasas o lipooxigenasas, produciendo así prostaglandinas, leucotrienos y tromboxanos, mediadores inflamatorios necesarios en el proceso de inflamación (3).
Los neutrófilos son un tipo de leucocitos polimorfonucleares que desempeñan un rol importante dentro de los procesos inflamatorios. Suelen ser los primeros leucocitos que se reclutarán en el sitio de una inflamación y son capaces de eliminar patógenos por varios mecanismos (4). El reclutamiento en los sitios de infección se encuentra guiado por los patrones moleculares asociados al daño tisular denominados DAMP (5), una vez los neutrófilos han sido reclutados, fagocitan activamente los microorganismos o forman trampas extracelulares de neutrófilos (NET) para eliminar los patógenos (6). Para su función microbicida se requiere la activación del complejo Nicotinamida-Adenina-Dinucleótido-Fosfato (NADPH) oxidasa para la producción de especies reactivas de oxígeno conocidas como ROS que guían la eliminación de los patógenos (7).
Para el estudio de los mecanismos y funciones que llevan a cabo los neutrófilos se han empleado una serie de técnicas que permitan comprender su biología. Entre los modelos usados se encuentran los neutrófilos humanos primarios purificados, líneas celulares del tipo neutrófilo, modelos murinos y el uso del pez cebra como un modelo in vivo de inmunidad (8).
Al igual que los mamíferos, los teleósteos poseen varios tipos de granulocitos y un linaje separado de macrófagos. El granulocito más abundante en el pez cebra, es el neutrófilo, que se caracteriza por tener un núcleo segmentado multi lobular de 2 a 3 lóbulos. Esta célula es similar al neutrófilo humano, que también tiene un núcleo de múltiples lóbulos y un citoplasma heterofílico. A medida que el neutrófilo madura, también lo hacen sus gránulos, expresando y acumulando varias enzimas necesarias para su función. Los heterófilos del pez cebra tiñen fuertemente la actividad histoquímica de la mieloperoxidasa, lo que indica la presencia de la enzima peroxidasa dentro de la célula de los peces (9). Varios estudios señalan que los neutrófilos polimorfonucleares son las células inmunes innatas más numerosas, siendo el leucocito la célula dominante en larvas de pez cebra a los 2 días post fertilización, y también en mamíferos adultos (10).
Este modelo animal presenta múltiples ventajas como su alta fecundidad, pequeño tamaño, rápido desarrollo extra uterino y la transparencia óptica de embriones y larvas. Además, presenta características favorables como su bajo costo de mantenimiento, así como el uso de pequeñas cantidades de compuestos que se disuelven en el medio circundante y son absorbidos a través del tracto gastrointestinal o a través de su piel, lo que permite una evaluación rápida de la actividad farmacológica in vivo (11-14).
Dentro de este contexto, la nutrición es uno de los factores determinantes de la salud, varios estudios demuestran que una dieta equilibrada contribuye a la prevención de diversas enfermedades de etiología inflamatoria. Específicamente, la denominada “dieta mediterránea” se ha asociado con beneficios en la prevención de muchas patologías crónicas más prevalentes en las sociedades occidentales, se sabe que la dieta mediterránea proporciona importantes componentes dietéticos como carotenoides y compuestos fenólicos, que pueden contribuir a reducir el riesgo de desarrollar diferentes patologías (15).
Entre los alimentos representativos de la dieta mediterránea se encuentran los derivados del tomate, como el sofrito del tomate, que se caracteriza por contener una variedad de compuestos fenólicos como son la naringenina, oleuropeína, rutina, cianidina, ácido clorogénico y apigenina (16).
El objetivo del presente estudio es evaluar y caracterizar la posible actividad antiinflamatoria de compuestos presentes en un extracto de sofrito de tomate desgrasado y homogeneizado, alimento importante dentro de la dieta mediterránea, empleando larvas de Danio rerio como modelo experimental.
Los procedimientos con el pez cebra, larvas y embriones han sido autorizados por el Comité Ético de Experimentación Animal de la Universidad de Barcelona, número de autorización o protocolo 7971 del Departament de Ramaderia i Pesca de la Generalitat de Catalunya (Procediment DAAM 7971).
Los peces cebra adultos (Danio rerio) silvestres, sin ninguna caracterización de cepa específica, se obtuvieron a través de un proveedor comercial (Pisciber BSF, Barcelona - España). Machos y hembras se mantuvieron en acuarios con un sistema de flujo cerrado con agua estandarizada, según normativa ISO (International Organization for Standarization) 7346-1 y 7346-2 (ISO, 1998; 2mM CaCl2.2H2O; 0,5 mM MgSO4.7H2O; 0,75mM NaHCO3; 0,07 mM KCl). Los peces se mantuvieron bajo temperatura controlada de 28ºC y un ciclo de luz oscuridad de 14/10 horas. Los embriones fueron recolectados, limpiados y seleccionados de acuerdo a su viabilidad, y se mantuvieron en medio Danieau’s 0.3X (17,4 mM NaCl; 0,23 mM KCl; 0,12 mM MgSO4.7H2O; 0,18 mM Ca (NO3)2; 1,5 mM HEPES; pH 6,5) [15]
Las soluciones de compuestos naturales y de fármacos antiinflamatorios fueron adquiridos en Sigma Aldrich, se disolvieron en una solución stock de dimetilsulfóxido (DMSO), a partir del stock se hicieron diluciones seriadas en medio Danieau’s, controlando una concentración inferior al 1% (v/v) de DMSO.
El extracto del sofrito de tomate desgrasado fue proporcionado por el grupo “Polifenoles naturales y otros componentes bioactivos presentes en los alimentos” de la Facultad de Farmacia de la Universidad de Barcelona. La elaboración del sofrito de tomate, el desgrasado, y homogeneizado para la cuantificación de carotenoides se realizó según lo descrito por Rinaldi de Alvarenga et al., (2017) (16). Brevemente, para el proceso de elaboración del sofrito de tomate se utilizó el tomate Lycopersicon esculentum mil, c.v. Pera, ajo, cebolla y aceite de oliva extra virgen, todos los ingredientes fueron previamente lavados y cortados. El sofrito se elaboró de manera tradicional, que consiste en sofreír el ajo y la cebolla en aceite de oliva (1 minuto) antes de agregar los tomates licuados y llevar a cocción (100ºC, 60 minutos).
Se utilizó 0,5 g de extracto seco del sofrito que proviene de sofrito previamente centrifugado, se reconstituyó con 1 ml de DMSO al 100% y luego se preparó una solución 1:400 en medio Danieau’s para llevar a cabo la cuantificación de neutrófilos.
El ensayo de migración de neutrófilos se basó en el modelo descrito por Cordero et al. (2013)(17). Se utilizaron larvas de pez cebra de 4 dpf previamente despigmentadas con N-phenylthiourea (PTU) 0.2 mM (17). Se descartaron las larvas que no presentan el desarrollo adecuado a su edad. En estas larvas se indujo una inflamación, mediante lesión en la aleta caudal y se potenció la inflamación mediante la adición de 10μg/mL del lipopolisacárido (LPS) de Salmonella typhosa en el medio. La exposición a compuestos presentes en la dieta mediterránea se realizó durante ocho horas, siendo 1 hora de preexposición sin inducción de la inflamación y una incubación conjuntamente con LPS de siete horas, una vez realizado el corte de la aleta caudal (Figura 1A). Las larvas fueron anestesiadas y los neutrófilos fueron teñidos con el kit Leucognost pox (VWR), puesto que todas las células maduras de la línea neutrofílica son mieloperoxidasas positivas (MPO+). Una vez realizada la tinción de neutrófilos, se utilizó el microscopio NIKON eclipse TS100 para capturar las imágenes con un aumento 10X.
El análisis de imágenes se realizó con el programa Image J (versión 1.50c). Consistió en las siguientes fases: primero se obtuvo una única imagen a partir de tres imágenes capturadas con diferentes planos de enfoque, seleccionando para cada píxel la mínima intensidad de las tres; esto permitió una mejor localización de los neutrófilos presentes en diferentes distancias focales. Luego se invirtió la imagen para que los neutrófilos se observaran como zonas brillantes sobre fondo obscuro y se incrementó el contraste de la imagen aplicando una transformación exponencial. Se aplicó un umbral para eliminar el fondo y saturar la señal seleccionada. En las condiciones experimentales aplicadas, la mayoría de las larvas presentaban una acumulación elevada de neutrófilos que dificultaba su cuantificación individual. Por esta razón, se optó por medir la intensidad integrada en una región estandarizada (ROI) de la cola del pez cebra como se muestra en la Figura 1. Dado que la señal está saturada, la intensidad medida es proporcional al área teñida. En muestras en que fue posible contar el número de neutrófilos se comprobó que la intensidad era aproximadamente proporcional al número de neutrófilos (18).
Los ensayos se realizaron con un mínimo de 20-25 larvas para cada compuesto evaluado por triplicado. Cada ensayo se comparó con su propio control negativo para corregir la variabilidad propia del modelo.
Para los ensayos de migración de neutrófilos, los resultados se expresaron como la media ± error estándar de la media (SEM). Se analizaron con el programa Graph Pad 7.02 Software Inc. Con un análisis ANOVA de dos vías, test de comparación múltiple de Bonferroni. Los resultados se reportaron como porcentaje, donde los controles negativos corresponden al 100% de la migración de neutrófilos. En todos los casos se consideran diferencias estadísticamente significativas a tres niveles de significancia, *p<0.05; **p<0.01; ***p<0.001.
El uso del modelo larvario de pez Danio rerio, permitió visualizar diferencias significativas en la población de neutrófilos controles y tratados (Figura 1). Como se observó en la zona de la lesión, los embriones controles presentan mayor intensidad de neutrófilos con respectos a los embriones que fueron previamente tratados con los diferentes compuestos estudiados.

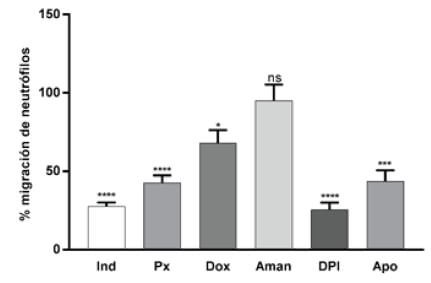
Se ensayaron diferentes compuestos bien conocidos por su efecto antiinflamatorio, como son la indometacina y el piroxicam, productos no antiinflamatorios tales como la doxepina, amantadina y productos inhibidores de enzimas NADPH oxidasas como el dibenzoidolium (DPI) y la apocinina (Figura 2 y Tabla 1).
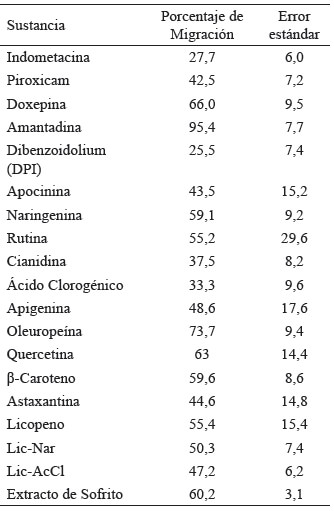
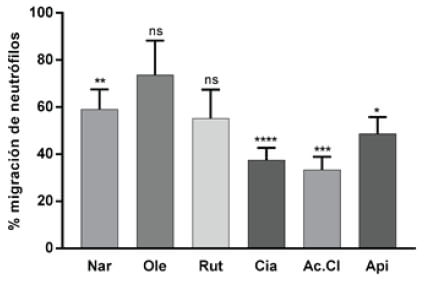
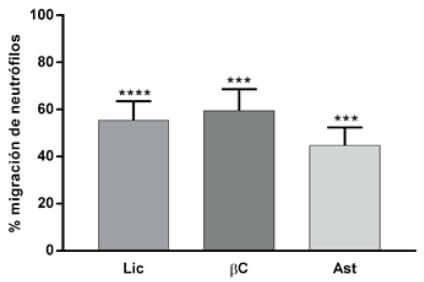
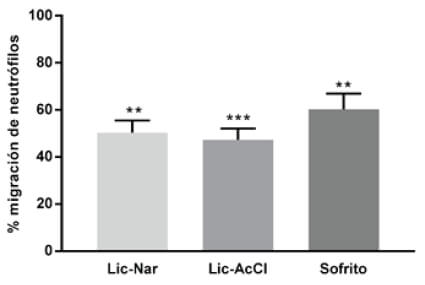
El efecto de dichos compuestos sobre la migración de neutrófilos fue evaluado con el modelo propuesto en el presente trabajo (Figura 3 y Tabla 1). Además, de los compuestos fenólicos se evaluó la migración de neutrófilos en larvas expuestas a compuestos carotenoides como el Licopeno, Beta-Caroteno y Astaxantina (Figura 4). Finalmente, se realizó un ensayo de migración de neutrófilos, exponiendo larvas de pez cebra a una muestra de extracto de sofrito de tomate desgrasada. Además, se evaluó si las mezclas de compuestos flavonoide y carotenos potenciaban el efecto sobre la disminución de neutrófilos, se analizaron las combinaciones de mezclas de aquellos compuestos que presentaron mayores diferencias significativas respecto del control, como la naringenina-licopeno y ácido clorogénico–licopeno (Figura 5 y Tabla 1).
El método propuesto para la cuantificación de la migración de neutrófilos en larvas de pez cebra, es una adaptación del método descrito por Cordero et al. 2013 (17). El mismo que es sensible y reproducible al ser expuesto a controles antiinflamatorios, así como a matrices alimentarias complejas como el extracto de sofrito de tomate.
Nuestros resultados para el caso de la indometacina y el piroxicam reportaron una migración de neutrófilos en relación al control de 27,7% y 42,5% respectivamente. Estos datos concuerdan con la capacidad antiinflamatoria de dichos fármacos no esteroideos (AINEs), los mismos que inhiben ambas isoformas de la enzima ciclooxigenasa (COXs) (19). La isoforma COX-1 que se expresa de forma constitutiva en la mayoría de los tejidos y la COX-2 que puede ser inducida por varios estímulos como citoquinas, prostaglandinas y productos bacterianos como el lipopolisacárido. Se ha demostrado que la inhibición de COXs bloquea la adherencia de los neutrófilos, disminuyen la desgranulación, inhiben la actividad de las elastasas e inducen la apoptosis de los neutrófilos, lo que resultaría en una disminución en la presencia de neutrófilos en el sitio de la inflamación (20).
El ensayo con (DPI), inhibidor de la enzima NADPH oxidasa, mostró una inhibición significativa (p<0,0001) y una migración de neutrófilos de 25,5% respecto de los controles. Las NADPH oxidasas están dedicadas exclusivamente a la producción de especies reactivas de oxígeno (ROS) (21). Se evaluó también el efecto de otro inhibidor de la NADPH oxidasa, la apocinina, un compuesto fenólico aislado de la planta medicinal Picrorhiza kurroa, dicho compuesto mostró una inhibición significativa en la migración de neutrófilos alcanzando el valor del 43,5% respecto a los controles (22, 23).
Por otra parte, el tratamiento con doxepina, que es un fármaco antidepresivo, produjo una inhibición moderada pero significativa de la migración de neutrófilos, cabe señalar que dicho compuesto no es catalogado como un antiinflamatorio, sin embargo, se ha reportado actividad antiinflamatoria y ha sido utilizado para tratar la dermatitis atópica (24).
Cabe señalar que la amantadina, fármaco antiviral generalmente utilizado para tratar y prevenir la gripe tipo A (25) y sin actividad antiinflamatoria conocida, al ser evaluado mediante el método propuesto, no presentó diferencia significativa respecto de su control, mostrando un 95,4% en la migración de neutrófilos. El resultado fue el esperado, puesto que, al no ser un compuesto antiinflamatorio, no tiene efecto sobre la migración de neutrófilos.
Al evaluar los componentes fenólicos del extracto del sofrito del tomate los resultados mostraron que la cianidina (Cia) y el ácido clorogénico (Ac.Cl) producen una mayor reducción de la migración de neutrófilos, fenómeno que se relaciona con un posible incremento de la actividad antiinflamatoria. La cianidina, un flavonoide que pertenece a las antocianinas, reportó una migración del 37,5%, porcentaje comparable a los observados en los antiinflamatorios indometacina y piroxicam. El efecto antiinflamatorio de las antocianinas ha sido previamente ensayado y demostrado. Entre dichos estudios se encuentra el realizado por Tsuda et al (2002), en el cual se administró cianidina-3-glucósido (C3G) a ratas por vía oral, los análisis de los resultados revelaron una atenuación de la respuesta inflamatoria, siendo la disminución de la expresión de la enzima óxido nítrico sintasa inducible (iNOS) (26) y la supresión de la producción de citoquinas proinflamatorias los posibles mecanismos que regularon dicho efecto (27).
Se observó también un efecto reductor en la migración de los neutrófilos en el tratamiento con ácido clorogénico, que es un compuesto fenólico, muy abundante en el café, donde representa el 98% del contenido fenólico total (28). La ingesta de café es considerada también parte importante de la dieta mediterránea. El ácido clorogénico además de sus propiedades antiinflamatorias reportadas en el presente estudio y en otros (29-31), es capaz de ejercer funciones esenciales en la regulación del metabolismo de la glucosa y de los lípidos, así como en los trastornos relacionados con diabetes, enfermedad cardiovascular, obesidad y cáncer (32). Otro tipo de compuestos de consumo frecuente en la dieta mediterránea, son los carotenoides presentes en los tomates y las zanahorias. Los principales pigmentos carotenoides bioactivos son el licopeno y β-caroteno. Los fuertes efectos antioxidantes y otros efectos beneficiosos in vitro e in vivo de los carotenos están asociados con su capacidad para actuar como captadores de radicales libres. Los carotenoides son pigmentos responsables del color de frutos, flores y hoja. El licopeno es lipofílico, de color rojo y está presente en tomates maduros, el color naranja de la zanahoria debido al β-caroteno y el color rosa/rojo se debe a la astaxantina. La mayor parte de investigaciones sobre los efectos saludables de la ingesta de tomate y productos de tomate se centra en el licopeno (33). Se han estudiado sus beneficios para la salud, sobre todo en la prevención del cáncer y problemas cardiovasculares (34). Ensayos en modelos animales han examinado el rol del licopeno sobre la inflamación y arterosclerosis, sugieren que dicho compuesto puede actuar como un agente antiinflamatorio (34-36). Nuestros resultados muestran un leve efecto inhibidor de la migración de los neutrófilos, que se traduciría en un moderado efecto antiinflamatorio.
Además, se evaluó si las mezclas de compuestos flavonoide y carotenos potenciaban el efecto sobre la disminución de neutrófilos, se analizaron las combinaciones de mezclas de aquellos compuestos que presentaron mayores diferencias significativas respecto del control, como la naringenina-licopeno y ácido clorogénico-licopeno.
La migración de neutrófilos en larvas de pez cebra, expuestas al extracto del sofrito de tomate fue del 60,2%, porcentaje que se encuentra en el mismo rango de migración que se observó con compuestos individuales, por otra parte, la combinación de compuestos no potencia el efecto inhibidor en la migración de neutrófilos y en el caso de la mezcla ácido clorogénico-licopeno incluso se reduce ligeramente la capacidad de inhibición de la migración de los neutrófilos que de manera aislada se reportaba para el ácido clorogénico.
Se ha evaluado la actividad antiinflamatoria del extracto del sofrito de tomate desgrasado mediante el uso de un modelo adaptado y optimizado para medir cambios en la migración de neutrófilos in vivo en embriones de pez cebra. Se ha demostrado experimentalmente que el extracto de sofrito de tomate desgrasado y homogeneizado, así como varios de sus compuestos fenólicos y carotenoides presentan actividad antiinflamatoria, evidenciándose de esta manera que el aporte nutricional de dichos compuestos podría contribuir a mitigar y prevenir patologías con procesos inflamatorias de distinta naturaleza. Finalmente, el modelo de embriones de pez cebra utilizado ha sido fiable y reproducible para la evaluación de fracciones y compuestos individuales con potencial actividad antiinflamatoria.
Programa de Becas de la Secretaría de Educación Superior, Ciencia, Tecnología e Innovación (SENESCYT) del Ecuador. Dirección de Investigación y Desarrollo de la Universidad Técnica de Ambato (DIDE). Departamento de Farmacología, Toxicología y Química Terapéutica de la Universidad de Barcelona. Departamento de Nutrición de la Facultad de Farmacia de la Universidad de Barcelona y al grupo “Polifenoles naturales y otros componentes bioactivos presentes en los alimentos”.
A la unidad de Toxicología del Departamento de Farmacología, Toxicología y Química Terapéutica por las facilidades brindadas para la realización de este trabajo, también agradecemos al grupo “Polifenoles naturales y otros componentes bioactivos presentes en los alimentos”. Al Institut de Recerca en Nutrició i Seguretat Alimentària (INSA·UB) de la Universitat de Barcelona (UB), a la Secretaría de Educación Superior, Ciencia, Tecnología e Innovación (SENESCYT) del Ecuador por la beca predoctoral y a la Dirección de Investigación y Desarrollo de la Universidad Técnica de Ambato (DIDE).
Recibido: 02/10/2020
Aceptado: 17/12/2020