 , Norma Julieta Salazar-López1
, Norma Julieta Salazar-López1  , Maribel Robles-Sánchez2
, Maribel Robles-Sánchez2  , Gustavo A. González-Aguilar1
, Gustavo A. González-Aguilar1  , J. Fernando Ayala-Zavala1
, J. Fernando Ayala-Zavala1  , Leticia X. Lopez-Martinez3
, Leticia X. Lopez-Martinez3  .
.Las frutas exóticas se encuentran dentro del grupo de las frutas tropicales y su carácter perecedero limita su exportación a mercados distantes. En general, su consumo es local, son subutilizadas o poco valoradas tanto en el hogar como industrialmente; sin embargo, debido su alto valor nutricional, su consumo se ha incrementado significativamente en los últimos años. Estas frutas son fuente de compuestos bioactivos como fibra, vitamina C, carotenoides, ácidos fenólicos y polifenoles, los cuales han sido asociados a la reducción de los riesgos de enfermedades crónicas causadas por el estrés oxidativo. Estos compuestos bioactivos han demostrado que poseen varias actividades biológicas in vitro e in vivo incluyendo actividad antioxidante, antimicrobiana, antiinflamatoria, antiedad, neuroprotectora y antiviral entre otras. Por lo tanto, la obtención de ingredientes funcionales a partir de las frutas tropicales consideradas exóticas resulta viable; así como su utilización para el desarrollo de alimentos funcionales y nutracéuticos, para elaboración de productos de la industria farmacéutica y la conservación de alimentos. En la presente revisión se discute la información más relevante publicada en el período 2010-2020 de las principales bases de datos científicas, incluyendo Scopus, Science Direct, PubMed, Medline y Scielo, sobre los compuestos fenólicos y las bioactividades reportadas de las frutas tropicales exóticas como acai (Euterpe oleraceae), acerola (Malpighia emarginata), buruti (Mauritia flexuosa) caqui (Diospyros kaki), chicozapote (Manilkara zapota), litchi (Litchi chinensis), maracuyá (Passiflora edulis), noni (Morinda citrifolia) rambután (Nephelium lappaceum), pitaya blanca (Hylocereus undatus), pitaya roja (Hylocereus polyrhizus) y su relación con sus potenciales efectos benéficos en la salud. Arch Latinoam Nutr 2020; 70(3): 205-214.
Palabras clave: Compuestos fenólicos, frutas tropicales exóticas, propiedades bioactivas.
Exotic fruits are found in the group of tropical fruits and their perishable nature limits their export to distant markets. In general, their consumption is local; they are underutilized or little valued both at home and industrially; however, its consumption has increased significantly in recent years due to its high nutritional value. These fruits are a source of bioactive compounds such as fiber, vitamin C, carotenoids, phenolic acids and polyphenols, which have been associated with reducing the risks of chronic diseases caused by oxidative stress. These bioactive compounds have been shown to possess various in vitro and in vivo biological activities, including antioxidant, antimicrobial, antiviral, anti-inflammatory, anti-aging, neuroprotective, and among others. Therefore, obtaining functional ingredients from tropical fruits considered exotic is viable and used to develop functional and nutraceutical foods, prepare products for the pharmaceutical industry and food preservation. This review discusses the most relevant information published in the 2010-2020 period from the main scientific databases, including Scopus, Science Direct, PubMed, Medline and Scielo, on phenolic compounds and reported bioactivities of exotic tropical fruits such as acai (Euterpe oleraceae), acerola (Malpighia emarginata), persimmon (Diospyros kaki), chicozapote (Manilkara zapota), litchi (Litchi chinensis), passion fruit (Passiflora edulis) noni (Morinda citrifolia), rambutan (Nephelium lappaceum), white pitaya (Hylocereus undatus) and red pitaya (Hylocereus polyrhizus) and their relationship with their potential beneficial effects on health. Arch Latinoam Nutr 2020; 70(3): 205-214.
Key words: Phenolic compounds, exotic tropical fruits, bioactive properties.
https://doi.org/10.37527/2020.70.3.006
Autor para la correspondencia: Leticia X. Lopez-Martinez, email: [email protected]
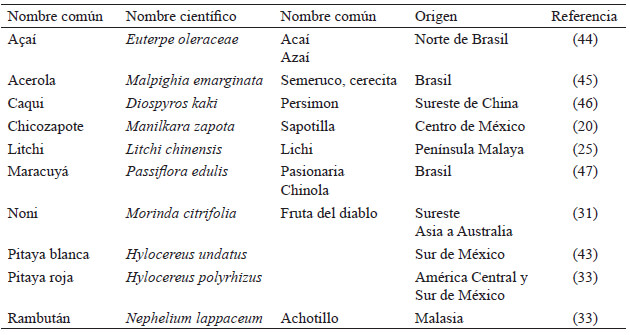
Las frutas tropicales exóticas son frutas que crecen en climas tropicales o subtropicales, en la zona geográfica que se extiende desde 30° latitud sur hasta 30° latitud norte. Las condiciones de temperatura en esta área varían entre 16 a 36°C durante el año (1). Estas frutas son importantes para los países en desarrollo desde una perspectiva nutricional y de compuestos bioactivos. Un componente importante de las frutas es la fibra, que se define como la parte comestible de plantas o carbohidratos que son resistentes a la digestión y absorción en el intestino delgado humano, con fermentación completa o parcial en el intestino grueso (2, 3). De las vitaminas en frutas, destaca la vitamina C, que es un término genérico el cual agrupa a los ácidos, dehidroascórbico, isoascórbico y L-ascórbico, el cual es la forma biológicamente activa de esta y posee efectos protectores contra enfermedades cardíacas y ciertos tipos de cáncer (3). Los carotenoides son potentes inhibidores del oxígeno singlete y eliminadores del anión superóxido y radical hidroxilo, puede detener las reacciones en cadena de peróxido protegiendo a los ácidos grasos y membranas reduciendo el riesgo de formación de placa aterosclerótica (4). Los compuestos fenólicos se han relacionado con la reducción del riesgo de desarrollar enfermedades como diabetes, obesidad, distintos tipos de cáncer, entre otros (5,6). Estos efectos se han atribuido a su capacidad de inhibir la oxidación de ADN, proteínas y lípidos. Frutas como la acerola, el litchi, el açaí y el chicozapote, es difícil encontrarlos en sitios de venta, ya que solo se importan de países productores tradicionales, sino que a menudo están integrados solo mercados locales (7). En la Tabla 1 se especifican los lugares de origen de las frutas tropicales exóticas de esta revisión. Sin embargo, estas frutas son cada vez más demandadas por su sabor característico, alto contenido y variedad de compuestos bioactivos, así como sus beneficios en la salud, los cuales han sido evidenciados en diversas publicaciones científicas. Desafortunadamente, las frutas tropicales exóticas, no se consumen con frecuencia, debido a la falta de familiaridad de los consumidores y en ocasiones por sus altos precios. Por lo cual es importante dar a conocer a la población los distintos beneficios en la salud que tienen estos frutos, para promover aún más su consumo.
El presente artículo es una investigación de tipo documental, se recopiló literatura relevante a través del análisis de las principales bases de datos científicas, incluyendo Scopus, Science Direct, PubMed, Medline y Scielo del 2010 al 2020. Los trabajos completos fueron evaluados para seleccionar artículos originales considerando los siguientes criterios de selección en español y en inglés: (a) frutas tropicales exóticas, (b) compuestos fenólicos, (c) propiedades bioactivas y (d) bioactividades de frutas tropicales exóticas.
Se seleccionaron artículos sobre los compuestos fenólicos de frutas tropicales exóticas que mostraron propiedades bioactivas. Se clasificaron de acuerdo con la fruta tropical exótica y la bioactividad de acuerdo con la evidencia encontrada.
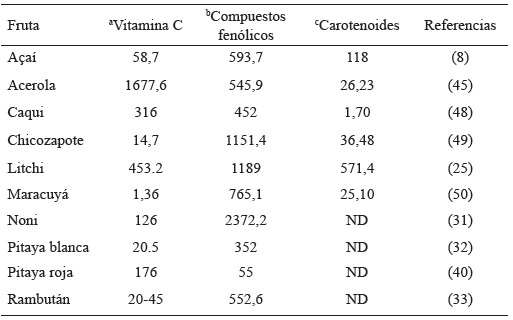
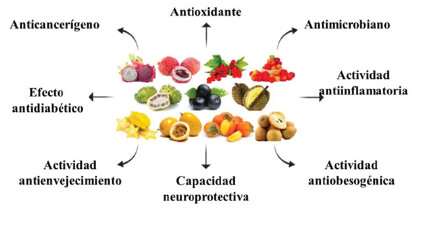
Las frutas tropicales exóticas son consideradas una buena fuente de compuestos bioactivos (Tabla 2), especialmente de compuestos fenólicos los cuales son capaces de proteger el cuerpo humano contra el daño inducido por los radicales libres y otras especies reactivas a través de distintos mecanismos. Estas propiedades permiten considerarlas como benéficas para la salud humana (Figura 1).
Extractos metanólicos de pulpa de açaí colombiano muestran capacidad antioxidante in vitro inhibiendo los radicales ABTS y DPPH con valores de 24,7 y 21,049 μmol Trolox Equivalente (TE)/100 g respectivamente (8), estos valores son mayores a los reportados en muestras de açaí de Brasil con valores de 2,78 y 13,340 μmol TE/100 g, para ABTS y DPPH respectivamente (8). La administración de extractos acuosos ricos en antocianinas de pulpa de açaí (3 g/kg) en ratas Wistar alimentadas con dietas altas en grasas reduce el contenido de triglicéridos totales en hígado (44%) y una atenuación de la esteatosis hepática del 80% (9). Además, el açaí posee propiedades antiinflamatorias, como lo muestran Machado et al. (10) donde se utilizaron macrófagos RAW 264.7 expuestos a fitohemaglutinina para inducir la inflamación, los extractos etanólicos de açaí disminuyeron concentración de citocinas proinflamatorias IL-1 (70 %) beta, IL-6 (70 %) TNF-alfa (26 %) y IFN-gamma (18 %) e incrementa los niveles de la citocina antinflamatoria IL-10 en un 47 %. En otro estudio, extractos de açaí (5 mg /L) regularon la concentración de citocinas proinflamatorias TNF-α (0,42 veces), TLR- 4 (0,52 veces), TRAF-6 (0,64 veces), NF-κB (0,76 veces)en células miofibroblásticas de colon humano (CCD-18Co) expuestas a lipopolisacáridos (2 μg/mL) para producir la inflamación (11).Extractos acuosos y etanólicos de pulpa de açaí fueron suministrados a ratas Wistar a las que se administró azoximetano (15 mg/kg) para generar cáncer de colon, y determinar sus efectos sobre la proliferación celular. Los extractos en concentraciones de 2,5 y 5,0 % que son ricos en antocianinas redujeron levemente (1,2 y 3,0 %) proliferación celular en el epitelio intestinal, pero incrementaron en un 42 y 45 % los niveles de apoptosis determinados por el biomarcador caspasa 3 (6).
Extractos etanólicos de pulpa de acerola han mostrado capacidad antioxidante in vitro inhibiendo la formación con valor de IC50 de (531,22g /g DPPH) y para reducción de hierro de (31,52 mmol Fe2SO4 /g) además demostraron efecto antibacteriano evaluado por medio de la concentración inhibitoria mínima (MIC) y de concentración bactericida mínima (MIB) contra Listeria monocytogenes con valores de 10 y 12,5 mg/mL, respectivamente. En un estudio similar se evaluaron extractos etanólicos y cloroformo de acerola sobre Bacillus cereus, Staphylococcus aureus, Listeria monocytogenes, Salmonella typhimurium, Escherichia coli y Klebsiella pneumonia. Los extractos inhibieron el crecimiento de todas las bacterias con MIC en el intervalo de 1,25–10,0 mg/mL (14). Diferentes estudios han mostrado la capacidad de inhibir la actividad carcinógena in vivo de la acerola, en este contexto Düsman et al. (15) evaluaron la actividad radioprotectora y antimutagénica de jugo de acerola (1 mL/100 g) en ratas tratas con de 25μ Ci de radio isotopo yodo-131 (131I). El tratamiento con jugo se evaluó previo, simultáneo y posteriormente a la radiación ionizante. El jugo disminuyó el porcentaje de anomalías cromosómicas causadas por 131I en tratamientos radio protectores previos, simultaneo y posterior de 1,3, 4,3 y 1,2 %, respectivamente. Las anomalías disminuyeron aproximadamente un 72 % (durante el tratamiento y postratamiento simultáneos) y un 70 % en el pre tratamiento.
B. subtilis encontrándose zonas de inhibición de 13 y 17 mm, respectivamente. Shafi y Tabassum (17) estudiaron el efecto antidiabético de un extracto etanólico de caqui (EEC), en ratas con hiperglicemia inducida (STZ; 50 mg/kg), los resultados mostraron una disminución en los niveles de glucosa de 207,50 a 152,65 mg/dL entre el grupo diabético y el grupo diabético tratado con EEC. Se observó un comportamiento similar en la disminución de colesterol total sérico (195,18 a 161,3 mg/dL), de los triacilglicéridos (195,18 a 159,1 mg/dL) y un aumento de lipoproteínas de alta densidad de 18,8 a 22,6 mg/dL(10). Direito et al. (18) evaluaron la actividad antiinflamatoria de un extracto liofilizado de acetona: agua (80:20, v/v) de caqui en ratas Wistar con artritis inducida, mediante la inyección intradérmica de una emulsión de colágeno bovino tipo II. El tratamiento con el extracto de caqui (15 mg/kg por día) mostró efecto antiinflamatorio, reduciendo el volumen del edema en un 46 % así como las alteraciones radiológicas atribuidas a la artritis en el hueso.
Singh et al. (19) determinaron la actividad antioxidante de extractos etanólicos de chicozapote evaluando la capacidad de inhibir al radical DPPH y ABTS con valores de 2,5 y 3,4 mM TE/g, en un estudio similar se determinó la actividad antioxidante de extractos metanólicos de chicozapote con valor IC50 de 5,2 μg/mL para la inhibición del DPPH (20).
Khalek et al. (21) evaluaron el efecto antitumoral del extracto de acetato de etilo de chicozapote contra el carcinoma de ascitis de Ehrlich (EAC) en ratones albinos suizos machos. En la inhibición del crecimiento celular de EAC se encontró que el número promedio de células tumorales viables por ratón tratado con los extractos a dosis de 50 y 100 mg/kg disminuyó en un 47,7 y 65,1 % respectivamente, con respecto al control.
En otro estudio se evaluaron las propiedades antienvejecimiento in vitro de extractos etanólicos de chicozapote que incluyen las actividades anticolagenasa y antielastasa. Los extractos mostraron inhibiciones de colagenasa de IC50=65,68 μg/mL, catorce veces mayor IC50=4,47 μg/mL al estándar galato de epigalocatequina (EGCG). Un resultado inverso se obtuvo en la inhibición de elastasa donde el IC50 de EGCG=65,68 μg/mL y del extracto fue aproximadamente 2 veces menor (IC50=36,82 μg/Ml)(22). De forma similar, se determinó el efecto de extractos etanólicos de chicozapote sobre la elastasa.
Los extractos mostraron un efecto inhibitorio de IC50=35,73 mg/mL, aproximadamente tres veces mayor que EGCG (IC50=10,23 mg/mL) utilizada como estándar (23).
En un estudio realizado por Septembre-Malaterre et al. (24), se evaluó la actividad antioxidante de extractos con acetona de pulpa de litchi mostrando una actividad leve (58,3%) en la inhibición de DPPH, en un contexto diferente desarrollaron un estudio en ratas con hiperglucemia inducida por administración de estreptozotocina (STZ, 30 mg/kg) y alimentadas con una dieta con extractos de litchi. Después de 30 días tratamiento, se observó que se mejoró la tolerancia a la glucosa en 27,8 % (25). Ichinose et al. (26) investigaron la actividad antiviral del oligonol (extracto de lichi que contiene monómeros de catequina y oligómeros de proantocianidina) contra la replicación de betanodavirus. El oligonol mostró una inhibición de la replicación de betanodavirus dosis dependiente con valores de la dosis de extracto (IC50 = 0,9-1,8 μg/mL).
Ramaiya et al. (27), evaluaron la actividad antioxidante por el método de DPPH de extractos metanólicos de maracuyá presentando un valor IC50=429,6 μg/mL, en este mismo estudio se determinó la actividad antimicrobiana mediante el método de difusión en disco sobre S. aureus (14,5 mm), B. cereus (14,5 mm), B. subtilis (14,0 mm), L. monocytogenes (14,5 mm), Pseudomonas aeruginosa (10,6 mm), Salmonella enteritidis (6,8 mm) y E. coli (10,6 mm). Doungue et al. (28) evaluaron el efecto neuro protector de pulpa de maracuyá (400 mg /200 g) en ratas Wistar a las que se les indujo Alzheimer (administración intraperitoneal de 32,5 mg/kg de AlCl₃ por 60 días). Posteriormente fueron tratadas por 28 días más con 200 o 400 mg/200 g de peso de una fracción rica en flavonoides. Los tratamientos disminuyen a la acetilcolinesterasa (AChE) en el hipocampo 36 y 52 % y en el córtex de 40 y 60 % para las distintas concentraciones utilizadas mejorando los cambios neuroconductuales lo cual impacta en la función cognitiva y confirmada por la prueba del laberinto de agua de Morris.
La actividad antioxidante de extractos etanólicos (70 %) de jugo de noni fue determinado por el método de DPPH reportando valores de IC50 de 18,70 mg/mL, en el mismo estudio se determinó la actividad inhibidora de α-amilasa donde se determinaron valores de inhibición de 45% de inhibición a 10 mg/mL (29).
La actividad antineoplásica de jugo de noni (NJ) y Divinenoni Gold (DNG) en ratones portadores de carcinoma de ascitis de Ehrlich (EAC) se evaluó administrando 0,35 mL de jugo de noni/ratón, una vez al día durante 14 días. Media hora antes de la primera administración de NJ y DNG cada animal recibió una dosis única de cisplatino. Los resultados revelan que NJ y DNG, mostraron una disminución significativa del volumen del tumor, recuento de células viables y aumentó el tiempo medio de supervivencia de las ratas (30). Se estudió el efecto de la administración de jugo de noni en ratas Brown Norway con inflamación pulmonar inducida con ovoalbúmina (10 mg/kg) y prednisolona (10 mg/kg) administradas intraperitonealmente, encontrándose que después de la administración oral (4,55 mL /kg) o intraperitoneal (2,17 mL/kg) de jugo de noni, se presentó la disminución del número de células inflamatorias en el pulmón (macrófagos menos 20-26%, linfocitos menos 58-34%, eosinófilos menos 53-30%, neutrófilos menos 70-28% respectivamente) (31).
Sudha et al. (32). determinaron la actividad antioxidante de extractos acuosos de pitaya blanca (de 25100 mg/μL) por el método de DPPH, ellos concluyen que la capacidad antioxidante de los extractos es de baja a moderada (18,5 a 30 %) y presenta un comportamiento dependiente de la dosis. En el mismo estudio se analizó la actividad de las enzimas α-amilasa y lipasa, encontrándose inhibiciones de 1,0 a 32,4% y de 6,1 a 46,9%, respectivamente. El efecto antidiabético de la pitaya roja también ha sido demostrado por (33) quienes sugieren que el consumo diario de 600 g de fruta de pitaya roja disminuyó el nivel de glucosa en sangre en pacientes diabéticos tipo II.
En la evaluación de la capacidad antioxidante por medio de la reducción de la formación de especies reactivas de oxígeno inducida por H2O2 por extractos de pulpa de rambután (40 mg/mL) se observó una actividad inhibidora moderada (25 %) (34). Sekar et al. (35), determinaron las propiedades antibacterianas del extracto metanólico de rambután mediante el método de difusión en disco contra Streptococcus pyogenes, S. aureus, E. coli y P. aeruginosa. El extracto mostró inhibición contra S. pyogenes y S.aureus de 5,0-12,0 mm, Al mismo tiempo, no mostró zona de inhibición para E. coli y P. aeruginosa.
Ahmad et al. (36) describieron que la geranina, un elagitanino aislado del rambután es eficaz contra la cepa del virus del dengue tipo 2 (DENV-2).
Los compuestos fenólicos presentes en las frutas tropicales exóticas ejercen diversas actividades biológicas que incluye antioxidante, antiinflamatoria, antidiabético, neuroprotectora y antibacteriana, entre otras encontrándose evidencia utilizando modelos in vitro e in vivo como se ha descrito anteriormente.
Los extractos de frutas tropicales exóticas realizados con diversos solventes han demostrado ejercer su capacidad antioxidante in vitro estabilizando radicales sintéticos como el DPPH, el ABTS, por medio de su potencial reductor del hierro, inhibición de la oxidación inducida por radicales peroxilo entre otros (12, 31, 37). Estas actividades se han asociadoa la presencia de compuestos fenólicos y sus posibles efectos sinérgicos con otras moléculas como carotenoides y vitamina C (12, 38). Las actividades antioxidantes se presentan en diferentes unidades por lo cual una comparación de resultados es complicada, sin embargo, acorde a los resultados reportados los extractos de pitaya y de litchi presentan actividades de moderadas a bajas en % de inhibición del radical DPPH, en el mismo contexto la actividad antioxidante reportada como IC50 de DPPH se presentó en el orden maracuyá, caqui y noni, mientras el chicozapote y el acaí presentan actividades antioxidantes similares. El resultado de las diferentes actividades antioxidantes puede estar relacionada con el contenido total de compuestos fenólicos. Sin embargo; los efectos sinérgicos o antagonistas entre los diferentes compuestos fenólicos presentes además de los carotenoides y la vitamina C pueden afectar esta actividad y por lo tanto tales relaciones pueden no ser tan estrechas. Diferentes estudios han demostrado que el antioxidante individual de los compuestos fenólicos es diferente si son ensayados individualmente o juntos (12, 35), debido a las interacciones entre ellos, que pueden ser sinérgicas o antagónicos, esto dependiendo de los compuestos y condiciones en estudio dentro del sistema modelo (37, 38).
Los experimentos in vivo sugieren que la actividad antiinflamatoria de los compuestos fenólicos presentes en los extractos de pulpa de frutas exóticas tropicales en células intestinales y en células miofibroblásticas de colon humano afectaron la liberación y/o la acción de citocinas proinflamatorias, enzimas y mediadores de la inflamación, así como la modulación del inflamasoma NLRP3 y (TLR-4) y el factor nuclear Kappa-B (NF-KB)(11), así como una atenuación de la activación de los neutrófilos y la consiguiente reducción de la liberación de productos proinflamatorios derivados de estos neutrófilos, los cuales interfirieren directamente con los mecanismos patológicos detrás de la lesión en la artritis reumatoide (18).
La actividad antioxidante de diferentes frutas tropicales exóticas ha sido asociada con efectos antiinflamatorios (11, 18). Los mediadores inflamatorios como especies reactivas de oxígeno, óxido nítrico, prostaglandinas y citoquinas amplifican la respuesta inflamatoria; dañando en ocasiones a los tejidos periféricos y se han asociado con enfermedades (38). La patogenia de la enfermedad de Alzheimer (EA) se basa en la insuficiencia del neuro-mediador acetilcolina, que se descompone por la acetilcolinesterasa (AChE), responsable de la mayoría sus síntomas (39). Por lo tanto, los inhibidores de AChE se han convertido en el tratamiento ampliamente utilizado contra esta enfermedad. En este sentido, las fracciones de maracuyá ricas en flavonoides han demostrado la reducción del nivel de citocinas en el hipocampo y el incremento de la acetilcolina la cual impacta en la función cognitiva (28). La capacidad de inhibir el crecimiento de las células cancerosas puede confirmar que los compuestos bioactivos pueden servir como agentes quimiopreventivos. Compuestos como el ácido gálico, la quercetina, la miricetina y la catequina han demostrado la capacidad de reducir el daño del ADN de las células inducidas por algún compuesto carcinógeno, inhibiendo así la invasión de tumores (21). De manera similar, se reportó la actividad antineoplásica de jugo de frutas tropicales como el noni, el cual ha mostrado disminuir el volumen de los tumores y el recuento de células viables, los autores concluyen que la actividad antineoplásica del jugo de noni se debe principalmente a sus propiedades antioxidantes (29). Extractos de açaí rico en cianidina 3-glucosido y cianidina 3-rutinosido disminuyeron el recuento de células tumorales, así como el daño del ADN, atenuando el paso de iniciación de la carcinogénesis de colon de ratón inducida químicamente por azoximetano (6). Por otro lado, también se ha demostrado que la acción conjunta aditiva de la vitamina C y los flavonoides presentes en el jugo de acerola disminuyen el número de alteraciones cromosómicas generadas por la dosis terapéutica de 25μCi de radioyodo-131 en las células de médula ósea de ratas Wistar (6).
La administración oral de extractos acuosos de açaí en ratas con dietas altas en grasa, reducen los triglicéridos del hígado y atenúan la esteatosis hepática, lo cual se asoció con la regulación positiva mediada por los compuestos fenólicos del extracto de los genes involucrados en la señalización de adiponectina, incluido el receptor 2 de adiponectina, PPAR-α, y su gen diana, carnitina palmitoiltransferasa (9). Por otra parte, la administración de extractos acuosos de pulpa de pitaya blanca, mejoró la resistencia a la insulina inducida por una dieta alta en grasas, la esteatosis hepática y la hipertrofia adiposa por medio de la regulación de la expresión de genes involucrados en el metabolismo de lípidos y colesterol (Srebp1, HMGCoR, Cpt1b, HL, Insig1 e Insig2) y el aumento de la hormona FGG21 producida por el hígado como respuesta a la ingesta de grasa, migrando a la grasa parda y produciendo un gran aumento de gasto energético y sus genes (Klb, FGFR2, Egr1 y cFos) (40).
Diversos estudios han demostrado la capacidad de extractos fenólicos de frutas exóticas en las enfermedades cardiovasculares y su capacidad de disminuir los niveles de lípidos en la sangre para contrarrestar la etiología de la dislipidemia y de la diabetes tipo 2. Extractos etanólicos de caqui han demostrado efectos hipolipemiantes en ratas diabéticas, dando como resultado la reducción de los triglicéridos, el colesterol total, el colesterol de la excreción fecal así como la reducción de colesterol hepático y un aumento de las lipoproteínas de alta densidad (18), así como la inhibición de α-amilasa y lipasa pancreática de extractos acuosos de pitaya blanca (32) y la disminución de glucosa en personas con diabetes tipo 2 por el consumo de pitaya roja (33). Estos efectos son atribuibles a los flavonoides y otros compuestos fenólicos que mitigan el estrés oxidativo inducido por la diabetes, modulación de la digestión de los carbohidratos además de un posible aumento de la secreción de insulina y la inhibición de las enzimas intestinales.
En otras actividades protectoras, el envejecimiento de la piel es un fenómeno biológico complejo causados por el paso del tiempo, así como la exposición a los rayos UV los cuales generan especies reactivas de oxígeno causando el daño oxidativo de colagenasa que es responsable de la descomposición del colágeno y la secreción de la elastasa que es la principal responsable de la descomposición de la elastina, dado que el colágeno y la elastina mantienen la integridad estructural de la piel y su elasticidad, su pérdida contribuye al envejecimiento de la piel (41).
Extractos de chicozapote que inhibieron a la colagenasa y a la elastasa (23). Sin embargo, estas enzimas no son las únicas que tienen un papel crucial, ya que los fibroblastos son los responsables de la síntesis de colágeno y elastina. Estos fibroblastos pueden ser atacados por las especies reactivas de oxígeno, provocando que la síntesis de estos componentes sea afectada. Por esta razón, los compuestos fenólicos no solo tendrán una acción sobre las enzimas que degradan los componentes de la matriz extracelular, pero el efecto antioxidante de los compuestos fenólicos presentes en los extractos puede aliviar el efecto de las especies reactivas de oxígeno sobre los fibroblastos (41).
Existen diversos estudios que demuestran el efecto antimicrobiano de extractos etanólicos de frutas exóticas tropicales como caqui, acerola y maracuyá contra L. monocytogenes, B. cereus, S. aureus, S. typhimurium, E. coli, y K. pneumonia, todos los extractos mostraron actividades inhibitorias, siendo loas extractos metanólicos de maracuyá los inhibidores más potentes. Las actividades inhibitorias son atribuidas a los compuestos fenólicos presentes en los extractos incluyendo ácidos fenólicos y flavonoides como epicatequina, rutina, quercetina y kaempferol (13, 14, 33). La difusión de los ácidos fenólicos desasociados a través de la membrana produce la acidificación del citoplasma y en ocasiones generan la muerte celular de los microorganismos (13) y los flavonoides que tienen la capacidad de alterar las membranas celulares microbianas generando permeabilización de la membrana citoplasmática (42, 43).
Los estudios de los extractos de frutas tropicales exóticas como agentes antivirales que sean capaces de inhibir el ciclo de replicación del patógeno en la célula infectada y no afecte a células sanas son escasos, compuestos sobre la geranina, (elagitanino aislado del rambután) y oligonol son compuestos eficaces para inhibir la replicación de los virus del dengue tipo 2 (DENV-2) y el betanodavirus, respectivamente, por medio de la inhibición de la fijación de virus a las células huésped así como la afectación de las primeras etapas de replicación del virus al reaccionar con la proteína de su envoltura (proteínas E) (26,32). Un ensayo de tiempo de adición mostró que la acción de oligonol tiene lugar en una etapa temprana de la infección viral, inhibiendo parcialmente la fijación del virión a la célula interactuando con algunos componentes de sus membranas celulares (26).
La combinación de estudios in vitro con in vivo permite tener una mayor información sobre la asociación entre el contenido de compuestos bioactivos de las frutas tropicales exóticas estudiadas y sus efectos sobre la salud del humano.
Las frutas tropicales exóticas parecen ser una fuente excelente de compuestos bioactivos con actividad antioxidante, antidiabética, antiinflamatoria, entre otras, con lo que su aplicación para promover efectos benéficos a la salud es prometedora. Por lo que es una alternativa para el diseño de nuevos alimentos y bebidas funcionales. El rendimiento del jugo de algunas de estas frutas es extremadamente alto y el jugo es una fuente importante de compuestos bioactivos. La preparación de nuevas bebidas alcohólicas, no alcohólicas y bebidas basada en compuestos fenólicos; así como su uso en la elaboración de pastas y productos de panadería, y su consumo periódico, puede contribuir a distintos beneficios a la salud, mitigando varios trastornos generados por el estilo de vida, como el sobrepeso, el síndrome metabólico, la diabetes. Estos beneficios podrían aumentar la demanda, la distribución y comercialización de estas frutas exóticas. Por lo tanto, es necesario desarrollar trabajos adicionales sobre estas frutas tropicales exóticas para generar más información para la elaboración de alimentos funcionales, estabilidad de sus compuestos bioactivos y los beneficios de su consumo, así como los posibles mecanismos de acción.
Los autores declaran que no tienen ningún conflicto de intereses.
Recibido: 27/06/2020
Aceptado: 16/12/2020