 ,
Begoña Cerda2
,
Begoña Cerda2  ,
Ana Catherine Arévalo1
,
Ana Catherine Arévalo1  ,
María Alejandra Granja1
,
María Alejandra Granja1  ,
Pilar Zafrilla2
,
Pilar Zafrilla2  .
.La vitamina D es esencial para el funcionamiento del organismo. Su deficiencia puede estar asociada tanto a patologías óseas, como a otras afecciones sistémicas. La prevalencia de la hipovitaminosis está aumentando, en todas las edades, incluidos niños y adolescentes. El objetivo del presente estudio fue evaluar los niveles sanguíneos de vitamina D en niñas colombianas, analizando también la dieta, la actividad física y la exposición solar. Se realizó un estudio descriptivo transversal con 52 niñas sanas prepúberes de Pasto (Colombia), entre 7 y 10 años. Se analizaron los niveles de albúmina, calcio, fósforo, magnesio, calcitriol (1,25 dihidroxicolecalciferol) y calcidiol (25 hidroxicolecalciferol). Se realizaron encuestas sobre hábitos alimentarios, actividad física y exposición solar. El 51,1% de las niñas evaluadas presentó insuficiencia de 25-OH-VITD y el 40% presentó deficiencia (< 20 ng/mL). Ninguna niña se encontraba en desnutrición u obesidad, el 10% se encontraba en riesgo de bajo peso (IMC ≤ -1DE y > -2DE), el 4 % presentaba sobrepeso (≥ +1DE y < +2DE), y el 34 % se encontraban en riesgo de talla baja (T/E: -1 y -2 DE). La ingesta media de calorías/día fue inferior a las recomendadas. Se observó una ingesta deficiente de vitamina D, calcio y magnesio (p > 0,05), así como de fibra (p > 0,05). Se pone de manifiesto una deficiencia de vitamina D en las niñas evaluadas a pesar de tener una actividad física y una exposición solar adecuadas. Además, se observan ingestas deficientes de fibra, calcio, magnesio y vitamina D. Habría por tanto que asegurar la ingesta e incluso suplementar para evitar problemas de salud en la edad adulta. Arch Latinoam Nutr 2021; 71(1): 5-12.
Palabras clave: Vitamina D, adolescentes, deficiencia de vitamina D.
Vitamin D is essential for the body to function. Its deficiency can be associated with bone pathologies as well as other systemic conditions. The prevalence of hypovitaminosisis increasing, in all ages, including children and adolescents. The objective of this study was to evaluate blood levels of vitamin D in Colombian girls, also analyzing diet, physical activity and sun exposure. A descriptive cross-sectional study was carried out with 52 healthy prepubertal girls from Pasto (Colombia), between 7 and 10 yearsold. The levels of albumin, calcium, phosphorus, magnesium, calcitriol (1.25 dihydroxycholecalciferol) and calcidiol (25 hydroxycholecalciferol) were analyzed. Surveys were conducted one a ting habits, physicalactivity and sun exposure. 51.1% of the girls evaluated presented 25-OH-VITD insufficiency and 40% presented deficiency (<20 ng / mL). None of the girls were under nourished or obese, 10% were at risk of low weight (BMI ≤ -1SD and> -2SD), 4% were overweight (≥ + 1DE and <+ 2DE), and 34% were they were at risk of short stature (T / E: -1 and -2 SD). The average calorie intake / day was lower than recommended. A deficient intake of vitamin D, calcium and magnesium (p> 0.05), as well as fiber (p> 0.05) was observed. A vitamin D deficiency is evident in the girls evaluated despite adequate physical activity and sun exposure. In addition, deficient intakes of fiber, calcium, magnesium and vitamin D are observed. Therefore, it would be necessary to ensure the intake and even supplement to avoid health problems in adulthood. Arch Latinoam Nutr 2021; 71(1): 5-12.
Key words: Vitamin D, teenage, vitamin D deficiency.
https://doi.org/10.37527/2021.71.1.001
Autor para la correspondencia: Begoña Cerdá Martínez-Pujalte. E-mail: [email protected]
La deficiencia de vitamina D en niños y adolescentes es un problema importante, y una de las deficiencias nutricionales menos tratadas en esta edad (1,2). La prevalencia de hipovitaminosis D está aumentando, se estima que más de mil millones de personas de todas las edades incluyendo los niños, sufren esta deficiencia (2,3). El raquitismo y la osteomalacia, patologías asociadas a la deficiencia grave de vitamina D, aunque se pueden prevenir, siguen siendo enfermedades comunes incluso en países de altos ingresos (4). Hasta el momento, el interés por determinar los niveles de vitamina D se han limitado a las patologías de compromiso renal, enfermedades autoinmunes y en las mujeres en edad menopáusica (5,6).
El impacto en la salud de la hipovitaminosis D se ha subestimado, a pesar de la importancia de la vitamina D para la salud. En los últimos años se ha descrito, que la deficiencia de vitamina D puede estar asociada no sólo a patologías óseas, sino también, a otras afecciones graves como el cáncer, enfermedades autoinmunes, diabetes, síndrome metabólico, hipertensión, enfermedad cardiovascular, deficiencias cognitivas y respuestas del sistema inmune a contaminación por virus (7, 8,9). La vitamina D tiene funciones esenciales desde la concepción hasta la vejez, y su deficiencia se ha asociado con un aumento de la mortalidad (2). Se ha mostrado que los niveles de esta vitamina en sangre durante la infancia tienen una incidencia directa en la calidad de la masa ósea en el adulto (5).Existe una relación clara entre niveles insuficientes de vitamina D en la infancia con los problemas de salud en la edad adulta, como son enfermedades óseas, cáncer, enfermedades autoinmunes, afecciones cardiovasculares, y su alta prevalencia en las mujeres adultas es bien conocida (3,10,11).
La deficiencia de vitamina D se puede explicar por un bajo aporte en la ingesta dietética o por falta de exposición a la radiación solar. El organismo es capaz de sintetizar el 90% de la vitamina D requerida por el organismo a partir de la radiación solar, por ello la ubicación geográfica puede asociarse con deficiencias en aquellos lugares en donde la radiación solar no sea elevada (10,12). En Colombia y en Latinoamérica, como en los demás países sobre la línea del Ecuador se asume que no existe déficit de vitamina D en sus habitantes debido a su latitud.
Respecto a la deficiencia de vitamina D por bajo aporte alimentario, en países desarrollados es más raro que ocurra. Sin embargo, en países en vías de desarrollo como Colombia, donde todavía existe mortalidad por inanición y hambre oculta, no es raro que haya deficiencia de este micronutriente por baja ingesta alimentaria tanto en niños como en adultos (13).
Hasta ahora, en Colombia la deficiencia de vitamina D sólo se determina en niños con raquitismo en el vasto grupo de los afectados por desnutrición grave, enfermedades renales y del sistema endocrino. No obstante, llama la atención el aumento en el número de mujeres afectadas por osteopenia, osteoporosis y fracturas óseas (6).
El objetivo del presente estudio fue evaluar los niveles sanguíneos de vitamina D en niñas colombianas, estudiando también la dieta y la actividad física como conductas que favorecen la salud ósea en niñas prepuberales.
1. Diseño del estudio: se realizó un estudio observacional descriptivo de corte trasversal. Se incluyeron 52 niñas sanas entre 7 y 10 años de edad, y en etapa pre-puberal según Tanner I (14). Se seleccionó al azar una institución educativa de primaria y secundaria pública de la ciudad de Pasto, en el sur de Colombia, que acoge estudiantes de bajos y medianos recursos económicos. Una vez seleccionadas, a los representantes legales se les proporcionó información escrita sobre el estudio. Se incluyeron las niñas de los que aceptaron y firmaron el consentimiento informado. El estudio ha sido autorizado por el comité de ética de la Universidad Católica de Murcia (UCAM). Criterios de exclusión: edad fuera del rango de 7-10 años; tener enfermedades crónicas como diabetes, enfermedades cardiovasculares, hepáticas o renales, tomar algún medicamento de forma crónica; actividad física vigorosa (más de 7 horas por semana); seguir un régimen de alimentación vegetariano.
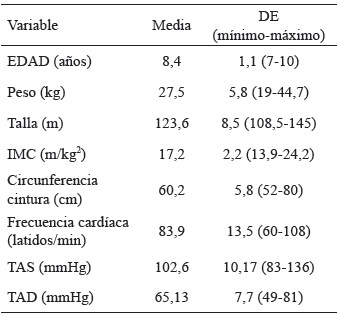
1.1 Historial médico y examen físico: se realizó la historia clínica valorando los antecedentes personales y familiares, así como la existencia de patología previa o tratamientos farmacológicos. Se realizó una exploración física exhaustiva para valorar la etapa de desarrollo puberal según Tanner, así como la posible existencia de patologías. Además, se determinaron la frecuencia cardíaca y tensión arterial (VS-600, Mindray, Bogotá, Colombia). En la valoración antropométrica y nutricional: se determinó la altura, el peso, el índice de masa corporal (IMC) (peso (kg) / [altura (m)]2) y la circunferencia de la cintura (cm). Para la medida del peso y talla se utilizó una báscula y tallímetro SECA (SECA, Hamburg, Germany). El perímetro de cintura se midió con una cinta métrica siguiendo un método estandarizado (SECA 201, Hamburg, Germany). El índice de masa corporal (IMC) se determinó dividiendo el peso en kilogramos (kg) entre la estatura en metros (m) elevada al cuadrado (kg/m2). Cada medición se repitió 3 veces para garantizar la precisión, y el promedio se usó para el análisis estadístico. El IMC y la talla fueron analizados con los Patrones de Referencia de crecimiento de la Organización Mundial de la Salud (OMS) (15) para niñas escolares de la siguiente manera IMC/E: Normal o Eutrófico (> -1DE y < +1DE), desnutrición (≤ -2DE), riesgo de bajo peso (≤ -1DE y > -2DE), sobrepeso (≥ +1DE y < +2DE), obesidad (≥ +2DE y < +3DE). Respecto a Talla/edad: riesgo de baja talla (entre -1 y -2 DE) y baja talla (entre -2 y -3 DE).
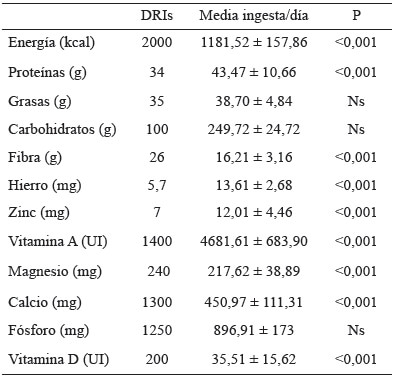
1.2 Evaluación de la ingesta de alimentos: se realizó a partir de una encuesta de frecuencia de consumo de alimentos (16). Se analizó el aporte nutricional estimado por día para: energía, macronutrientes, calcio, fósforo, magnesio y vitamina D, según el sistema de intercambios y el sistema equivalente de alimentos de Colombia (17). La encuesta se realizó por parte de las investigadoras en forma individual a cada niña participante. La ingesta media fue comparada con las de referencia internacionales (Dietary Reference Intakes: DRIs) (18) para niñas de 7 a 10 años. Se evaluó el consumo de café como variable independiente. Se registró el número de tazas de café (220 mL) que se ingerían al día.
1.3 Valoración del nivel de actividad física: Se aplicó a las participantes del estudio el cuestionario diseñado según la “Lista de Actividad Ayer” (19). Para conocer el nivel de práctica física que presenta cada niña fuera del horario escolar, se registró el horario, la duración, la vestimenta utilizada y el lugar (interior o exterior) en el que se realizaba la actividad física. Consideramos que una niña sí practicaba actividad física, sí realizaba una actividad: patinaje/ bicicleta/ Fútbol y/o baloncesto durante más de 1 hora, 3 días a la semana, independientemente de la practicada en horario escolar.
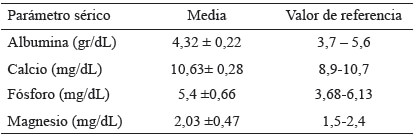
1.4 Parámetros bioquímicos y hematológicos: las muestras de sangre de la mañana fueron tomadas por venopunción entre las 7:00 a.m. y 8:30 a.m. después de un ayuno nocturno. La sangre se centrifugó (aproximadamente 3000 g durante 10 minutos) dentro de las 2 horas posteriores al muestreo. Las muestras de suero se identificaron mediante códigos y se almacenaron a 32°C en un congelador, hasta el momento de la medición. La hemoglobina se analizó mediante un método hematológico automático (analizador de hematología Mikon Kodhen 64J). Los niveles de albúmina sérica y demás metabolitos se determinaron mediante un ensayo colorimétrico enzimático (Technic on Instrument A-15 Bio System). Para determinar 1,25 (OH) 2 D y 25(OH) D se utilizó el método de determinación cuantitativa, basado en el principio de quimioluminiscencia (CLIA) (20). Los valores de referencia para la 25(OH)D se sitúan entre 30-100 ng/mLy los de 1,25 (OH)2D se sitúan entre 31-87 pg/mL.
1.5 Análisis estadístico: se utilizó el programa estadístico SPSS v21. Se estudió la normalidad mediante el test Shapiro-Wilk, y tras conocer que los resultados cumplían criterios de normalidad, se realizó la prueba T de Student de variables independientes para los datos de la muestra comparados con los valores de normalidad establecidos por organismos oficiales, para valorar si la ingesta de cada nutriente, así como sus niveles séricos cumplía o no las recomendaciones. Se aplicó la prueba "t" para muestras independientes para valorar las diferencias en los parámetros bioquímicos analizados.
Se realizó un estudio de correlación mediante un modelo de regresión lineal añadiendo los efectos aleatorios en el caso de mediciones repetidas, entre las variables antropométricas de las niñas preadolescentes, las variables nutricionales y los parámetros bioquímicos. Se considera que hay diferencias significativas estadísticamente cuando el valor de p < 0,05.
La edad media de las 52 niñas fue de 8,4 ± 1,1 años. Todas las niñas del estudio presentaron valores de tensión arterial en percentiles adecuados para su sexo y edad. Ninguna niña se encontraba en desnutrición u obesidad, el 10% se encontraba en riesgo de bajo peso (IMC ≤ -1DE y > -2DE), el 4 % presentaba sobrepeso (≥ +1DE y < +2DE), y el 34 % se encontraban en riesgo de talla baja (T/E: -1 y -2 DE) (Tabla 1). Se observó que la ingesta media estimada de calorías/día fue menor respecto a las DRIs. También se observó una ingesta inferior de vitamina D en la dieta. Respecto a la ingesta de calcio y magnesio se observa una ingesta significativamente baja de estos nutrientes (p > 0,05). De igual forma, para el consumo de fibra se encontró una ingesta deficiente con diferencia significativa (p > 0,05). La ingesta proteica, hierro, zinc y vitamina A fue significativamente más alta de las recomendaciones (Tabla 2). La ingesta media de café negro endulzado, fue de 3 tazas (220 mL) al día en el 70,6% en este grupo.
Todos los parámetros hematológicos que se determinaron estaban dentro de la normalidad, así como las proteínas totales, la albúmina y los niveles de fósforo, calcio y magnesio (Tabla 3).
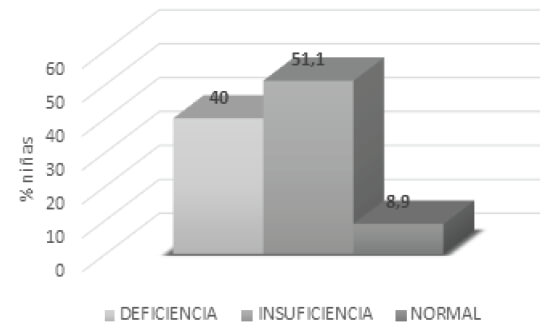
Respecto a los valores de vitamina D se obtuvieron los siguientes resultados: los niveles de 1,25-dihidroxicolecalciferol, fueron normales con una media de 89,5 pg/mL; los niveles de calcidiol (25-OH-VITD) se encontraron en una media de 22,5 ± 1 ng/mL, es decir, por debajo de los niveles recomendables (valor de referencia 30-100 ng/mL). En el 51,1% de las niñas evaluadas se encontró insuficiencia de 25 OH-VIT D con valores entre 20-30 ng/mL, el 40% presentó valores menores a 20 ng/mL lo que corresponde a deficiencia, solo el 8,9 % tuvo valores mayores a 30 ng/mL (Figura 1).
Respecto a la actividad física hay que destacar que el 50% de las niñas practicaba actividad física adicional a la establecida en el plan escolar. Sólo el 28% realizaba la actividad física en espacios al aire libre. Se correlacionaron los datos de actividad física y vitamina D, pero no se obtuvo ninguna relación.
Los resultados de este estudio muestran una clara hipovitaminosis D en las niñas colombianas evaluadas, ya que el 91,1% de las niñas evaluadas presentaron algún grado de deficiencia (51,1% insuficiencia y 40% deficiencia). Los niveles séricos deficientes de este metabolito, están asociados a una ingesta baja de vitamina D estimada en la dieta. Estos resultados coinciden con otros estudios publicados que indican déficit de vitamina D en la edad escolar, con prevalencias del 11% en Kerala (21) y del 86% en un grupo de niños coreanos (22). En un estudio con 56 niñas españolas, aunque se encontró ingesta inferior a las recomendaciones de las DRIs, ninguna niña presentó un nivel inferior a 20 ng/mL (23).
La determinación de la deficiencia de vitamina D en la infancia no es una tarea fácil. El metabolito 25(OH) D, es el que se utiliza para evaluar los niveles de vitamina D en sangre, ya que es más estable y su concentración es 100 veces mayor que la del metabolito 1,25 (OH) 2 D que corresponde a la forma activa (4,5,11).
El diagnóstico de raquitismo y osteomalacia se determina con concentraciones de 25-OH-VITD inferiores a 12 ng/mL (8). Sin embargo, en patologías extraesqueléticas asociadas a insuficiencia de vitamina D, los valores de referencia no están tan bien establecidos. Por ello, pasa desapercibida y la hipovitaminosis no es tratada, con las consiguientes consecuencias para la salud futura(5,24). La Academia Nacional de Medicina de EE.UU. recomienda concentraciones de 25 (OH) D superiores a 20 ng/mL (50 nmol / L) para una salud ósea óptima (25,26). La Sociedad Pediátrica de Endocrinología de EE.UU. recomienda una concentración superior a 30 ng/mL (75 nmol/L) para reducir el riesgo de varias enfermedades infecciosas y no transmisibles (28). En este trabajo se tomó como nivel de suficiencia 30 ng/mL por ser la referencia del laboratorio que procesó la vitamina D en las muestras evaluadas y, además, consideramos que este umbral es adecuado para la evaluación, como también se consideró en otros trabajos similares para este grupo de población (10,28,29). Es, por tanto, necesario que la comunidad científica llegue a un consenso para definir de forma clara el estado nutricional de la vitamina D en niños y adolescentes.
En el presente trabajo se ha podido comprobar la relación que hay entre la ingesta nutricional y los niveles séricos de vitamina D. No son pocos los estudios en grupos pediátricos que manifiestan deficiencia en la ingesta alimentaria de vitamina D (30,31). Las fuentes dietéticas de vitamina D se limitan principalmente a pescado azul, huevos y alimentos enriquecidos para este grupo de edad (3,21). No obstante, en Colombia el consumo de leche sin pasteurizar y por supuesto sin fortificar es importante y los pescados no son de acceso en la dieta de todos los colombianos, son el privilegio para las ciudades cercanas al río o mar (8). En países desarrollados la mayoría de las leches líquidas en el mercado sí están fortificadas con vitamina D, lo que se asocia positivamente con los mejores niveles de 25-OH-VITD de su población (32).
La Encuesta Nacional de la Situación Nutricional en Colombia (ENSIN) tiene como objetivo analizar la situación alimentaria y nutricional de la población colombiana entre 0 y 64 años de edad. En la última versión del 2015, por primera vez se incluye la vitamina D en la lista de los micronutrientes considerados de Salud Pública en Colombia junto con el hierro, vitamina A, zinc y yodo. En sus resultados reportaron la evaluación correspondiente a niñas escolares de 5 a 12 años donde encontraron un 46% de insuficiencia de vitamina D, y concluyeron que esta prevalencia es mayor que lo reportado para esta población en países de la región (13).
Respecto a otros micronutrientes que tienen mayor atención por parte de los programas de educación e intervención nutricional como lo son: hierro, zinc, y vitamina A, se encontró que la ingesta promedio era superior a la recomendación. Aunque respecto a lo reportado en la encuesta de ENSIN 2015, todavía en áreas rurales y comunidades indígenas se encuentran deficiencias de estos micronutrientes (13).
En este trabajo tanto para el calcio como para el magnesio se encontró ingesta deficiente. Los niveles adecuados de calcio y magnesio están directamente relacionados con la densidad ósea óptima. Las fuentes alimentarias de calcio y magnesio corresponden a vegetales, cereales integrales y lácteos principalmente (33,34).
El consumo de fibra y magnesio deficiente encontrado en este grupo de niñas estudiadas, corresponde a una tendencia generalizada en la edad escolar y adolescencia, donde se desplazan el consumo de frutas y verduras enteras por zumos y otras bebidas no nutritivas (30,31).
Respecto al consumo de café hay que destacar que en la región donde se realizó el estudio, el consumo de café se inicia desde la infancia muy temprana, desplazando la ingesta de productos lácteos. Esta ampliamente demostrado que algunas sustancias contenidas en el café disminuyen la absorción de micronutrientes esenciales como el calcio. Este hábito puede ser considerado un factor de riesgo en la salud ósea a largo plazo (35,36).
La afectación de la deficiencia de la vitamina D con mayor prevalencia en el género femenino desde la niñez, ya ha sido evidenciado (1). El grupo de investigación de Saad et al. (37), en el Líbano, informó que la media de 25-OH-VITD en suero fue significativamente mayor en los niños varones que en las niñas estudiadas. Sugiriendo que en las niñas la ropa conservadora, la exposición y el juego al aire libre limitados y sumados a la menor ingesta de calcio proveniente de los productos lácteos, fueron los determinantes de niveles bajos de vitamina D. Dado que la actividad física se asocia directamente con la concentración sérica de 25 (OH), es considerada un factor de desventaja en el género femenino (31). Así se corrobora en el estudio de Guthold et al (38) realizado en 2016,en donde se analizó la actividad física de adolescentes de 27 países, se observó una actividad física insuficiente superior al 90% para las niñas y reafirmó que los niños tienen mejor cumplimiento de la actividad física en comparación con las niñas.
La primera limitación de este estudio es su diseño transversal, que restringe la evaluación de la relación causal entre el estado de la vitamina D y las otras variables evaluadas. El tamaño de la muestra también se considera una limitante. Sin embargo, hasta donde sabemos es parte de los pocos estudios en Colombia y Latinoamérica en esta población específicamente (39,40). No obstante, este trabajo pretende exponer una problemática que pudiera ayudar a entender la carga costosa por las enfermedades crónicas no transmisibles potenciales y de enfermedad ósea en la edad adulta especialmente en mujeres (10, 11,29).
Los resultados de este trabajo manifiestan una clara hipovitaminosis D en el grupo de niñas colombianas evaluadas. Además, sugiere que hay un riesgo de ingestas deficientes en calcio y magnesio y vitamina D que expone directamente la salud ósea de estas futuras mujeres gestantes, lactantes y menopáusicas. Por lo tanto, recomendamos incluir en los programas de salud pública y de nutrición herramientas de vigilancia e intervención para asegurar unos adecuados hábitos alimentarios y de estilo de vida. Es necesario promover una alimentación variada con un consumo suficiente de alimentos ricos en vitamina D.
Al Hospital Infantil Los Ángeles (HILA) por el apoyo económico brindado durante este proyecto.
conocemos ningún conflicto de intereses.
Recibido: 05/03/2021
Aceptado: 15/04/2021