 ,
Nuria Giménez-Blasi1,2
,
Nuria Giménez-Blasi1,2  ,
José Antonio Latorre1,3
,
José Antonio Latorre1,3  ,
Manuel Martínez-Bebia1,3
,
Manuel Martínez-Bebia1,3  ,
Anna Bach-Faig4
,
Anna Bach-Faig4  ,
Miguel Mariscal-Arcas1,5
,
Miguel Mariscal-Arcas1,5 
Las infecciones de las vías respiratorios altas (IVRA), son debilitantes para el potencial deportivo de los atletas de élite. El ejercicio físico activa múltiples vías moleculares y bioquímicas relacionadas con el sistema inmune, sensibles a influencias nutricionales. Sobre este contexto, la inmunonutrición está adquiriendo una nueva dirección orientada a conseguir el equilibrio inmunológico, contraponiéndose con algunas de las teorías que han sentado las bases de la inmunología del ejercicio durante las últimas décadas. Objetivo. Investigar los aspectos nutricionales que puedan mejorar la respuesta inmunológica en deportistas de elite. Estudiar los posibles beneficios del equilibrio inmunológico para mejorar el rendimiento, analizar los factores nutricionales que contribuyan al equilibrio de la respuesta inmunológica y extrapolar la evidencia actual en recomendaciones prácticas de alimentación/suplementación para mejorar la homeostasis de la respuesta inmunológica en atletas de élite, teniendo en cuenta las limitaciones existentes.Resultados. La evidencia científica apunta que se puede potenciar el equilibrio inmunológico y la respuesta inmune a través de la modificación de factores nutricionales. Dentro de los cuales, la vitamina D, los probióticos, la vitamina C y el cinc son los que cuentan con mayor evidencia. Conclusión. Los avances científicos resultan prometedores y de interés para los atletas de élite, debido a que pueden disminuir la incidencia de IVRA, mejorando el éxito deportivo de los mismos. Se requieren más estudios para su validación y aplicación. Arch Latinoam Nutr 2021; 71(1): 61-78.
Palabras clave: Equilibrio inmunológico, tolerancia inmune, inmunonutrición, infecciones de vías respiratorias altas (IVRA), nutrición deportiva, atletas de élite.
Upper respiratory tract infections (URTI) are debilitating for the athletic potential of elite athletes. Physical exercise in elite athletes activates multiple molecular and biochemical pathways related to the immune system, which, at the same time, are sensitive to nutritional influences. Based on this context, immunonutrition is taking a new direction aimed at achieving the immunological balance. Objective. To investigate the nutritional aspects that can improve the immune response in elite athletes. To study the potential benefits of immune balance to improve performance, to analyse nutritional factors that contribute to the balance of the immune response and to extrapolate current evidence into practical dietary/supplementation recommendations to improve the homeostasis of the immune response in elite athletes, considering existing limitations. Results. Scientific evidence suggests that immune balance and immune response can be enhanced through the modification of nutritional factors. Among which, vitamin D, probiotics, vitamin C and zinc are the micronutrients with most evidence. Conclusion. Scientific advances in this field are promising and of great interest to elite athletes since it could decrease the incidence of URTI and, as a consequence, it could improve their sporting success. However, more studies are still required for its validation and application. Arch Latinoam Nutr 2021; 71(1): 61-78.
Key words: Immune equilibrium, immune tolerance, immunonutrition, upper respiratory infection (URI), sport nutrition, elite athlete.
https://doi.org/10.37527/2021.71.1.007
Autor para la correspondencia: Miguel Mariscal-Arcas, email: [email protected]
Las infecciones de vías respiratorios altas (IVRA), son problemáticas y debilitantes para el potencial deportivo de los atletas de élite. Concretamente, las IVRA son la segunda causa de atención médica que solicitan los deportistas de élite, tras las lesiones, considerándose una limitación para alcanzar el éxito profesional (1-3).
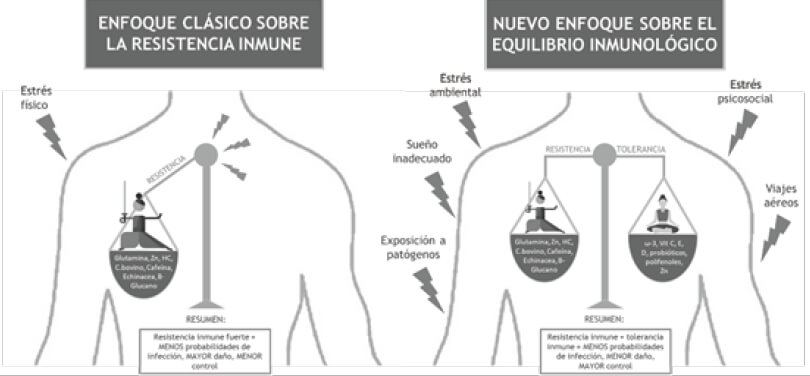
Gran parte de los estudios sobre el riesgo, prevención y tratamiento de infección en atletas han sentado sus bases sobre la hipótesis, como la conocida “curva en J” y la teoría de la “ventana abierta” que, de alguna manera, han puesto su foco en potenciar la resistencia inmune para reforzar el sistema inmunosuprimido de los atletas (4-6). No obstante, la visión de aportar suplementos para reforzar la inmunidad en atletas de élite sanos es simplista y se está quedando anticuada (7,8).
Es por ello que recientemente se ha propuesto un nuevo modelo de inmunidad basado en la homeostasis entre la resistencia y la tolerancia inmunológica (9,10). Esta nueva perspectiva pone en valor la tolerancia inmunológica para conseguir el equilibrio inmune y contrarrestar el protagonismo que ha tenido la resistencia inmunológica (11).
El ejercicio físico en atletas de élite activa múltiples vías moleculares y bioquímicas relacionadas con el sistema inmune que, a su vez, son sensibles a influencias nutricionales (12,13). Así, debido a la interconexión existente entre el sistema inmunitario, la nutrición y el ejercicio físico, exponer a los avances producidos genera un gran interés de cara a reducir la incidencia de infecciones en atletas de élite y, con ello, mejorar el rendimiento deportivo de estos. Una alimentación basada en un aumento del consumo de vegetales, antioxidantes, favorece esta respuesta inmunológica en el atleta, la refuerza o hace que el deportista tolere mejor la enfermedad modificando o aumentando la microbiota intestinal que, parece, actúa en positivo. Así, en la presente revisión se profundizará en este nuevo modelo de inmunidad, en su relación con la alimentación y en la capacidad de que sea aplicado en la actualidad de cara a mejorar el rendimiento deportivo.
Se plantea como objetivo de este estudio, investigar los aspectos nutricionales que puedan mejorar la respuesta inmunológica en deportistas de élite, a través de la mejora del equilibrio entre la resistencia y la tolerancia inmune, profundizando en los mecanismos de resistencia y tolerancia inmune en esta población, valorando los aspectos positivos y negativos de cada uno. Se pretende estudiar los posibles beneficios del equilibrio inmunológico para mejorar el rendimiento en deportistas de élite, analizar los factores nutricionales que contribuyan al equilibrio de la respuesta inmunológica, investigar y extrapolar la evidencia actual en recomendaciones prácticas de alimentación/suplementación para mejorar la homeostasis de la respuesta inmunológica en atletas de élite.
Para el desarrollo del trabajo de revisión expuesto se ha llevado a cabo una búsqueda bibliográfica exhaustiva a partir de las bases de datos Pubmed del NCBI (National Center for Biotechnology information). El número final de trabajos utilizados en la revisión fueron de 99, desde el comienzo de la búsqueda (Figura 1).
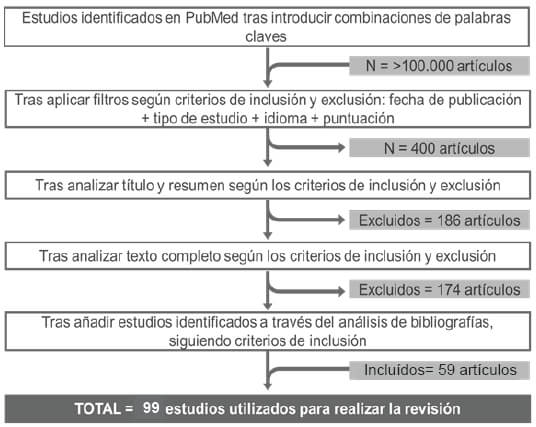
Las palabras claves se han introducido en los motores de búsqueda siguiendo las 4 combinaciones siguientes:
((((((((nutrition) OR (immunonutrition)) OR (feeding)) OR (dietary intake)) OR (Diet)) OR (supplementation)) OR (vitamin inadequacy)) OR (vitamin)) AND (((((((((sport) OR (physical activity)) OR (well trained athletes)) OR (athlete)) OR (exercise training)) OR (high-performance athletes)) OR (élite athlete)) OR (exercise performance)) OR (exercise)).
((((((((nutrition) OR (immunonutrition)) OR (feeding)) OR (dietary intake)) OR (Diet)) OR (supplementation)) OR (vitamin inadequacy)) OR (vitamin)) AND (((((((((Immunity) OR (immune system)) OR (immune health)) OR (upper respiratory infection)) OR (immune function)) OR (gastrointestinal infection)) OR (immune regulation)) OR (immune resistance)) OR (immune tolerance)) (respiratory tract infection) (infection) (physiological response) (cold).
(((((((((sport) OR (physical activity)) OR (well trained athletes)) OR (athlete)) OR (exercise training)) OR (high-performance athletes)) OR (élite athlete)) OR (exercise performance)) OR (exercise)) AND (((((((((Immunity) OR (immune system)) OR (immune health)) OR (upper respiratory infection)) OR (immune function)) OR (gastrointestinal infection)) OR (immune regulation)) OR (immune resistance)) OR (immune tolerance)) (respiratory tract infection) (infection) (physiological response) (cold).
((((immune system) OR (immune system)) OR (immune resistance)) OR (infections)) AND ((((equilibrium) OR (homeostasis)) OR (Disease tolerance)) OR (immune tolerance)).
Combinan términos de la siguiente manera; la primera, relaciona el sistema inmune o las infecciones con la actividad física o el deporte de élite; la segunda, el sistema inmune o las infecciones con la alimentación; la tercera, trata de buscar relación entre la alimentación con la actividad física o deporte de élite; la cuarta, relaciona términos sobre sistema inmune y equilibrio inmunológico, para profundizar en este punto.
Para la selección de estudios, se han contemplado los siguientes criterios de inclusión:
a) Publicaciones escritas en lengua española o inglesa, b) Artículos publicados en los últimos 10 años. Solo se permitirán artículos con mayor antigüedad si se identificaron en el análisis bibliográfico como un antecedente de importancia. Al menos el 75% se publicaron en los últimos 10 años. c) Los artículos serán meta-análisis, revisiones o revisiones sistemáticas. Se permitirán otro tipo de artículos en un porcentaje menor al 50% y solo si estos se hubiesen identificado a partir del análisis de bibliografías. d) Los artículos se encuentran entre los 100 primeros artículos con mejor puntuación para cada una de las 4 combinaciones de palabras introducidas. e) Abarcan información sobre el sistema inmunológico en su relación con factores nutricionales y/o el rendimiento deportivo (principalmente en el alto rendimiento).
La práctica de ejercicio físico a intensidades moderadas y de corta duración tiene efectos positivos sobre la función inmunológica (14,15). Las infecciones en el deporte son debilitantes y sus síntomas producen efectos perjudiciales en el rendimiento como la disminución en la capacidad aeróbica (3). Destacan las Infecciones de Vías Respiratorias Altas (IVRA) como el resfriado común. Su incidencia puede aumentar en periodos con altas cargas de entrenamiento o competición (13). Entre el 2-16% de los atletas que sufren algún problema de salud en eventos deportivos, las IVRA son la segunda causa de atención médica, tras las lesiones, entre 35-65% de las consultas médicas (1,2,16-21).
Para dar respuesta a la incidencia de infecciones en los deportistas de alto rendimiento, se ha puesto el foco durante las últimas cuatro décadas en uno de los grandes clásicos de la Inmunología del Ejercicio: la Teoría de la Ventana Abierta (4,6,16), propuesta por el Dr. Nieman, quien sostiene que el ejercicio provocará una inmunodepresión del sistema inmune y un aumento de la susceptibilidad a infecciones, particularmente IVRAS (6). En deportes con duración mayor a 90 minutos se produce una curva bifásica en la respuesta inmunológica. La curva encontraría un aumento de linfocitos, principal marcador durante el ejercicio, seguida de una caída de esos linfocitos por debajo de los niveles basales. Esta caída es lo que marcaría el estado de “ventana abierta” y se estima que es del 15-70% con una duración de 2 h aproximadamente (21).
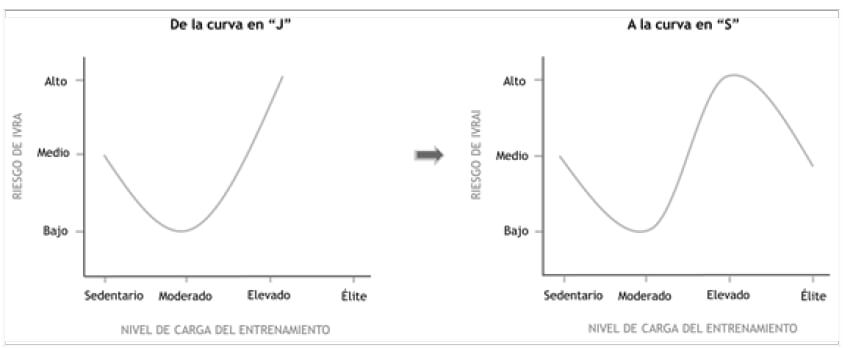
La teoría ha sido soportada por diferentes estudios, como el de La maratón de los Ángeles en 1987 (44) y la de Los dos océanos en 1982 (28). Durante años ha habido controversia en cuanto a que el ejercicio en si mismo deprime la inmunidad y aumenta el riesgo de infección (20). Tal es así que actualmente existen dos posiciones contrapuestas sobre esta teoría (1,8,21). Entre los argumentos que la cuestionan resaltan: a) La causa del aumento de IVRA tras las carreras no se debe al propio ejercicio, sino al hecho de poseer sintomatología de infecciones de forma previa a la carrera (22), b) el deporte de élite es incompatible con una frecuencia alta de infecciones, tal y como soporta un estudio liderado por Mårtensson (23), c) la curva bifásica que se produce tiene un sentido diferente. Hay estudios que explican que la disminución de linfocitos que se da lugar en sangre tras el ejercicio no se produce por una apoptosis masiva de estos, sino en el hecho de que éstos migran a otros tejidos, como los pulmones, la medula ósea o la piel, para realizar funciones de vigilancia inmunológica relacionados con los efectos positivos que tiene el ejercicio (14). La famosa hipótesis de la “curva en J” (1994) muestra como los sujetos sedentarios tienen riesgo medio de infección, los moderados tienen riesgo bajo y los atletas tienen mayor riesgo (6). La presencia de enfermedades supone la disminución de los entrenamientos o competiciones (23,24). Por el contrario, cuanto menos enfermo esté un deportista, más podrá entrenar, por ello, se observa que los ganadores de medallas deportivas en grandes campeonatos mundiales y olimpiadas experimentan menos IVRAS o de menor duración que los que compiten a nivel nacional (25). El entrenamiento de élite internacional se asocia con una menor susceptibilidad frente a infecciones (1,8,21). Este nuevo panorama, ha dado lugar a la transición de la curva en J a la Curva en S (26,27), la cual se puede apreciar en la Figura 2. Los autores que han contribuido en este avance son Glesson, Bishop y Walsh (27). Un deportista de élite internacional requiere un sistema inmune capaz de funcionar bajo altos niveles de estrés psicológico y fisiológico. Tal es así que poseer un sistema inmune de estas características se convierte casi en una condición para poder ser un atleta de élite exitoso (23). Por tanto, la práctica de ejercicio regular a una intensidad tanto moderada como alta puede ser beneficioso para la función inmunitaria y posiblemente reduzca el riesgo de infección. Asimismo, la curva en “S” ofrece argumentos para explicar que la aparición de infecciones se debe a múltiples factores.
Para que ocurra una infección, es necesario que el sistema inmune esté comprometido y expuesto a un patógeno. En este sentido, se encuentran varios factores que influyen en el riesgo de que un atleta sufra una infección siendo fundamental la modulación de dichos factores para prevenirla. Los principales se recogen en la Figura 3 y son los siguientes:
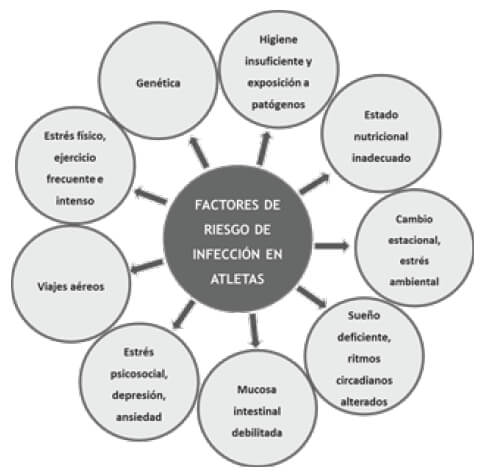
Estrés físico, entrenamientos recurrentes y de alta intensidad. El estrés físico derivado de periodos de entrenamiento con cargas altas y repetidas se puede acompañar de respuestas como la inflamación transitoria, estrés oxidativo, disminuciones del rendimiento, fatiga persistente o peor sueño (14,28). Existe un efecto de "supervivencia" para los atletas de élite cuyo sistema inmunitario puede ser entrenado para adaptar y atenuar las respuestas a mayores cargas de trabajo que el público en general (14,28). Además, realizar esfuerzos intensos una vez se cursa una infección, puede prolongar su duración promoviendo una complicación médica más grave (29).
Genética. La presencia de determinadas variantes genéticas puede mostrar tanto predisposición a respuestas inmunes más eficaces como una tendencia aumentada a sufrir IVRA en población atlética (25,30). Algunos de los polimorfismos estudiados se encuentran en el gen de la lectina (31) o la interleucina 6 (32) y 10 (33).
Estrés crónico, la depresión y la ansiedad. El estrés crónico puede suprimir las respuestas protectoras del estrés agudo, interrumpir la capacidad de regular la actividad inflamatoria y reducir la función de células inmunoprotectoras (34,35). Se sugiere que el estrés crónico, los síntomas de depresión o la ansiedad pueden comprometer la función inmune en atletas (15,36,37). Aunque es necesario más investigación, el estado previo de ansiedad (por exceso o por defecto), puede disminuir los mecanismos de defensa frente a un patógeno (38).
Estrés ambiental y cambio estacional. Ambientes extremos (Ej. temperaturas de -10ºC o 40ºC), se vinculan con una reducción de células encargadas de mediar la inmunidad (39). También el enfriamiento agudo de los pies (40) y el hecho de respirar aire frío y seco (41). Así, se aprecia un ligero aumento en la tasa de IVRA en las estaciones de invierno y otoño (42).
Viajes aéreos. Hay estudios que demuestran cómo los viajes aéreos aumentan el riesgo de IVRA hasta 5 veces (43). No solo generan mayor estrés y disrupción circadiana, sino que también aumentan la exposición a patógenos y se ha sugerido que afectan a la cantidad de sueño y a un aumento de la fatiga durante los 2 días posteriores al viaje (42).
Pobre higiene y/o exposición con personas enfermas. Tener buenas prácticas de higiene es fundamental para evitar el contacto con el patógeno y, por tanto, la infección (44).
Mucosa intestinal debilitada. El ejercicio intenso y prolongado aumenta la permeabilidad intestinal (45) y la disbiosis del microbioma intestinal, lo que promueve la inflamación (46,47).
Pobre calidad o cantidad de sueño. El sueño y el sistema circadiano tienen una fuerte sinergia e influencia en los procesos inmunes (26,48,49). Asimismo, hay estudios que asocian una menor duración del sueño (<6 horas) con mayor duración del resfriado común (50,51).
Estos factores se consideran disruptores inmunológicos (12) y no actúan de forma independiente, sino que sus efectos están interconectados (5,34).
El estado nutricional como factor de riesgo de infección en deportistas, es un parámetro que influye tanto en su susceptibilidad a la infección como en su respuesta a la infección en término de resultados clínicos (12,21,44,52). Los principales aspectos nutricionales para considerar sobre el riesgo de IVRA son los siguientes:
Hidratación. La saliva contiene proteínas como la lisozima o la α-amilasa que tienen cierto carácter antimicrobiano. Ante un estado de deshidratación moderada (pérdida de ≈3% de peso) producido por el ejercicio, puede disminuir la secreción de α-amilasa en un 44% y de lisozima en un 46% (53). Por tanto, una hidratación adecuada servirá para soportar un flujo adecuado de saliva y reforzar así a la saliva como primera barrera de defensa contra patógenos externos.
Ingesta energética. Un aporte energético deficiente puede afectar negativamente a la inmunidad y así se ha demostrado en casos de marasmo, o en la restricción energética proteica (52,54-56). No obstante, la puesta en marcha de estrategias de baja disponibilidad energéticas de forma puntual, controlada y con buen aporte proteico para optimizar ciertas adaptaciones metabólicas, no aumenta el riesgo de infección en deportistas (57).
Ingesta adecuada de macronutrientes. Para evitar alguna perturbación inmunológica, se recomienda un aporte de hidratos de carbono > 50% de la ingesta energética. Algunos estudios apuntan a que los hidratos de carbono tienen un impacto positivo sobre los niveles de hormonas del estrés como el cortisol (4,12). Por otra parte, la ingesta de proteínas es necesaria para soportar la división celular y la producción de proteínas con carácter inmunológico, como las inmunoglobulinas. Aunque se recomienda asegurar una ingesta de 1,2-1,6g/kg peso/día, hay estudios que apuntan a una ingesta de hasta 3g/kg de peso/día para obtener efectos positivos sobre la incidencia de IVRA inducida por el ejercicio de elevada intensidad (12,58).
Aporte de vitaminas y minerales. Las deficiencias de ciertos micronutrientes son causas potenciales de disfunción inmune y una ingesta adecuada de los mismos es importante para restaurar la función inmune (12,21,44,52). Lo que no está tan claro es si su suplementación por encima de las ingestas recomendadas en sujetos sanos sería recomendable (26).
Un huésped tiene dos métodos para defenderse contra los patógenos: eliminar los patógenos (resistencia inmunológica) o reducir su impacto en la salud (tolerancia inmunológica). Mientras el primer mecanismo está bien estudiado, el segundo está en su infancia (59, 60).
Los mecanismos que median la resistencia están bien descritos e implican la respuesta de defensa del sistema inmune y los eventos posteriores que conducen a la ejecución de la muerte microbiana (26). Tradicionalmente, se ha pensado que la supervivencia a enfermedades infecciosas depende completamente de la capacidad del huésped para matar a un patógeno invasor mediante la ejecución de mecanismos de resistencia (59).
Desde este enfoque, el sistema inmune protege, reconoce, ataca y destruye microorganismos y células extrañas al organismo. Está altamente organizado para proporcionar una defensa potente y de múltiples capas contra el ataque de microorganismos patógenos, incluidos virus, bacterias, hongos y protozoos (26).
Los diversos elementos que componen la actividad defensiva del sistema inmune se pueden dividir en dos subsistemas que están entrelazados (26): a) Sistema inmunitario innato. Es natural, no específico y constituye la primera línea de defensa del cuerpo. Comprende barreras físicas (Ej. La piel), barreras químicas y células fagocíticas (principalmente neutrófilos y macrófagos) que ingieren y matan microorganismos junto con otras células asesinas no específicas. b) Sistema inmune adquirido. Es adaptativo, específico y constituye la segunda línea de defensa. Se activa de forma más lenta una vez que el agente infeccioso ha superado la defensa innata. La respuesta se da produciendo anticuerpos específicos para cada tipo de antígeno y se caracteriza por la capacidad para aprender, adaptarse y recordar.
Los linfocitos cumplen diversas funciones esenciales como neutralizar los patógenos con anticuerpos, activar los macrófagos o evitar la destrucción de las células propias. Por un lado, la derivada de los linfocitos T se denomina inmunidad innata mediada por células. Los linfocitos T se subdividen en varios tipos: los citotóxicos, los colaboradores (células T-helper), los reguladores y los supresores. Por otro lado, la derivada de los linfocitos B se denomina inmunidad humoral, que secretan grandes cantidades de anticuerpos (o inmunoglobulinas) específicas para el antígeno que desencadenó la respuesta inmune.
Los procesos que dan lugar para proporcionar esta respuesta de resistencia suponen costes para el organismo, como el gasto energético o el daño tisular. Por ejemplo, las ROS juegan un papel importante en la defensa del huésped contra la infección, pero el aumento del estrés oxidativo durante una respuesta inmune puede provocar daños colaterales en el tejido, lo que aumenta la demanda de eliminación de antioxidantes durante la infección (13,21,61).
En las últimas tres décadas, la inmunología del ejercicio ha investigado activamente los suplementos nutricionales para mejorar la resistencia inmune en los atletas (62,63). Los más estudiados se muestran en la tabla 1.
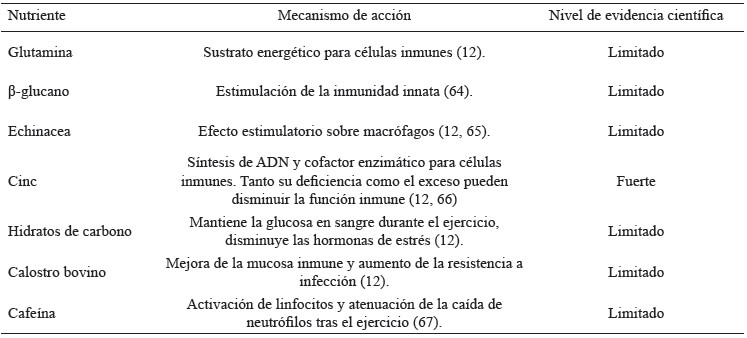
Pese a que la resistencia inmune ha sido ampliamente estudiada, los suplementos nutricionales dirigidos a mejorar la inmunodepresión (62,63), salvo excepciones como el zinc, muestran beneficios limitados (11,20). Probablemente estas limitaciones se deban a que el enfoque de mejorar la inmunodepresión derive de teorías que cada vez cuentan con menos respaldo científico. Por esta razón, los estudios clásicos enfocados a mejorar la resistencia inmunológica están adquiriendo ahora una nueva dirección que pone valor a los mecanismos de tolerancia inmunológica (68).
Aunque las respuestas inmunitarias se definen casi en términos de resistencia a los patógenos, en la última década, la tolerancia a la enfermedad se ha reconocido como un componente esencial de la respuesta de defensa a las infecciones (68).
El organismo también puede defenderse limitando el daño causado por la infección. Aunque la literatura científica hoy en día no es totalmente esclarecedora (20,60), los mecanismos tolerogénicos descritos se resumen en la Figura 4.
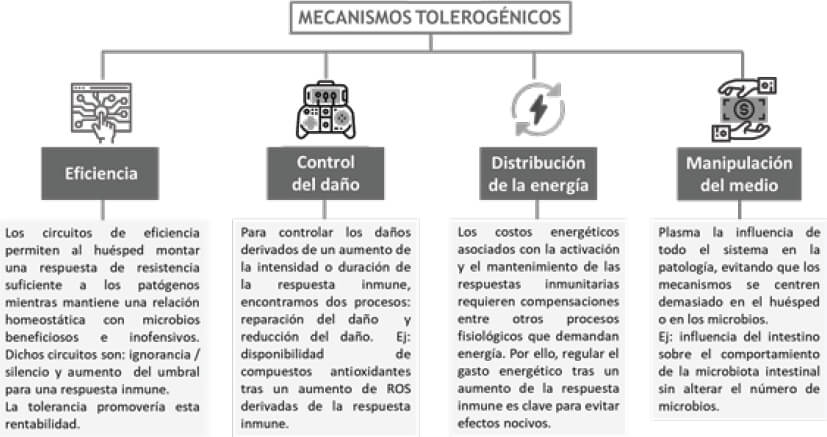
La tolerancia inmune amortigua la actividad de defensa controlando eficazmente la infección sin producir daños ni efectos secundarios negativos (20). Facilita la regulación homeostática de las comunidades microbianas intestinales beneficiosas. También es evidente, de acuerdo con la última revisión realizada por Chang H. Kim, que los metabolitos microbianos funcionan bidireccionalmente entre el sistema inmune y la tolerancia inmunológica para combatir eficazmente las infecciones sin desarrollar enfermedades inflamatorias (69).
Por otra parte, los factores nutricionales tolerogénicos han demostrado reducir la carga de infección de los atletas (68). Por ello, hay un interés creciente por agudizar el estudio de los compuestos tolerogénicos. Los más estudiados se muestran en la tabla 2.
El sistema inmune se percibe como un ejército de tejidos, células y moléculas que protegen de las infecciones. En ese contexto, el sistema inmune no es un asesino, sino más bien una fuerza que da forma a la homeostasis dentro del organismo en el que se encuentra (84). De acuerdo con la Ley III de Newton “a cada acción siempre se opone una reacción igual". Así, trasladando esta ley a una perspectiva inmunológica, la frase quedaría como algo así: "Para cada estímulo o respuesta proinflamatoria, hay uno o más elementos de control opuestos” (84,85).
Durante la última década, la investigación ha puesto mucho énfasis en las interconexiones orgánicas y los mecanismos de control (85). Por ello se ha propuesto un modelo de inmunidad basado en la homeostasis entre la resistencia y la tolerancia inmune, Figura 5. Mientras la resistencia se define como la capacidad de limitar la carga del patógeno, la tolerancia consiste en la capacidad de limitar el impacto en la salud causado por la carga de patógenos (9,11). La resistencia y la tolerancia inmunológica son sistemas antagonistas, pero que funcionan de forma complementaria (24). Además, se sugiere que las interacciones entre microbios pueden cambiar en función del huésped y adaptarse al tejido en el que se produce la respuesta (86).
El intestino tiene funciones vinculadas al metabolismo, la función endocrina, neuronal e inmune (45,87). Aproximadamente el 70% del sistema inmune se encuentra en el intestino (45). El sistema inmunitario de la mucosa actúa como interfaz entre el medio interno y el externo. Tiene mecanismos especializados en neutralizar, eliminar y promover la tolerancia a los antígenos sin inducir una respuesta inflamatoria (3). Los microbios comensales y el sistema inmune han evolucionado mediante una relación simbiótica para la regulación mutua (69).
La microbiota resulta fundamental para la correcta función inmunitaria (88). Mientras las células inmunes expresan receptores específicos de metabolitos, los microbios producen metabolitos que regulan el sistema inmunitario del huésped. Estos metabolitos fortalecen los tejidos de barrera y entrenan al sistema inmune para prevenir posibles infecciones por patógenos (69).
En conjunto, conforman un equilibrio dinámico que responde a cambios en la nutrición, la salud y el estado inmunológico a través de una amplia gama de señales (69). Como resultado, la alteración del entorno microbiano conduce al desequilibrio inmune que determina la tolerancia, la inmunidad protectora y la patología inflamatoria (68). Una regulación compleja que queda por explorar a través de enfoques ecológicos, genómicos, microbiológicos e inmunológicos (88).
El sistema inmune se puede potenciar a través de factores ambientales, como la alimentación. A continuación, se irá detallando el efecto de los factores nutricionales y alimentos que han mostrado influencia sobre el equilibrio inmunológico y/o la tolerancia inmune.
Sobre la base de que el sistema inmunológico se conforma por una red de procesos complejos, organizados y en constante dinamismo con otros sistemas, será importante no solo analizar el efecto de nutrientes o respuestas de forma aislada (12,89), sino también integrarlos en una visión interconectada que permita alcanzar el equilibrio inmunológico. Esta nueva perspectiva resalta la importancia de la tolerancia inmunológica para contrarrestar el protagonismo que ha tenido la resistencia inmunológica en los últimos años (9,11).
La vitamina D realiza funciones que repercuten al rendimiento deportivo, como la función musculo esquelética o regeneración muscular (89). Los alimentos con mayor aporte de esta vitamina se muestran en la tabla 3, aunque es la radiación Ultravioleta B del sol la que proporciona el 80-100% de los requerimientos (89).

Su síntesis sigue el siguiente proceso metabólico. A partir del 7-dehidrocoleterol de la dermis se sintetiza la pre-vitamina D3 y esta se transforma en vitamina D3 (en esta forma se absorbe directamente a través de los alimentos) (89). Posteriormente, la vitamina D3 necesita sufrir dos hidroxilaciones para transformarse en la forma activa (1.25 (OH) 2D3) y ejercer sus funciones. Las células inmunes expresan el receptor de vitamina D y la gran mayoría de los anticuerpos poseen la enzima 1-alfa hidroxilasa que se encarga de hacer la segunda hidroxilación (90).
El efecto de la vitamina D sobre la inmunidad se ejerce probablemente a través de la modulación de la expresión génica. De hecho, se estima que cerca del 5% del genoma humano está modulado por la vitamina D. Es ampliamente aceptado que la vitamina D juega un papel importante en la mejora de la inmunidad innata mediante la inducción de proteínas antimicrobianas. No obstante, muchas de las acciones de la vitamina D sobre la inmunidad adquirida son de naturaleza antiinflamatoria. Por ello, los efectos tolerogénicos de la vitamina D previenen respuestas inmunes excesivamente exuberantes después de la activación de las células T. Por ejemplo, la 1,25-hidroxi vitamina D induce el desarrollo de células T reguladoras.
Hasta un 56% de los atletas tienen niveles inadecuados de esta vitamina D, especialmente en invierno, lo que resulta en numerosas consecuencias perjudiciales para la competición (79,91). Además, lo que puede ser óptimo para un tejido, como el óseo, puede no ser óptimo para la función inmune. De hecho, la investigación está comenzando a indicar que el sistema inmunitario puede requerir mayores concentraciones de vitamina D (> 75 nmol/l) que lo que previamente se ha definido como "adecuado" para la salud ósea (> 50 nmol/l) (90).
Es importante para los atletas controlar su concentración de vitamina D y apuntar a una concentración objetivo > 75 nmol/l sin superar nunca > 180 nmol/l. En caso de no tener los niveles de la vitamina dentro de rango, sería recomendable restaurar dicho nivel a través del estilo de vida, pautas de alimentación y, si fuese necesario, suplementación (hasta 4000 UI de vit. D3 por día durante los meses de invierno) (12,21,92).
El Zinc (Zn) es un cofactor importante de varias enzimas y factores de transcripción (89). Se conoce que la suplementación con Zn además de actuar reduciendo la carga del patógeno (resistencia inmune) también lo hace a través de sus propiedades antioxidantes y antiinflamatorias (tolerancia inmune) (12,66,89). Se ha demostrado que induce el desarrollo de la población de células T-reg y amortigua la diferenciación proinflamatoria de las células Th17 y Th9, entre otros mecanismos (12,89).
Durante el ejercicio hay una movilización considerable de Zn en la sangre que se redistribuye al finalizar el ejercicio. Varios estudios informaron deficiencia de Zn (niveles séricos < 70 μg/dl) en atletas de élite, especialmente de resistencia (12,89). Su deficiencia afecta negativamente el desarrollo y las funciones inmunes innata y adaptativa, siendo importante asegurar una correcta ingesta de alimentos como los presentes en la tabla 3.
Asimismo, la corrección de la deficiencia de Zn puede revertir el deterioro del sistema inmunitario. Tal es así que un meta-análisis establece que la suplementación de 75 mg de acetato de Zn, puede reducir al 42 % la duración del resfriado. Para conseguir dicho efecto habría que realizar la toma en las 24 horas posteriores al inicio de los síntomas y solo durante la duración de la enfermedad. Es importante esclarecer las dosis y composición de las tabletas de Zn, puesto que muchas pastillas contienen poco Zn o sustancias que limitan su absorción (66). Debido a la heterogeneidad de respuestas al Zn y dado que tanto su sobrecarga como su déficit afectan a la función inmune, se necesitan más estudios para determinar una ingesta óptima de Zn que tenga en cuenta la variabilidad genética, el estado nutricional y de salud.
La vitamina E es un antioxidante liposoluble presente en la membrana de todas las células (89). Algunas de las fuentes alimentarias más ricas en vitamina E se pueden observar en la tabla 3 y su absorción será mejor si se acompaña de comidas grasas (93).
Las células inmunes contienen niveles particularmente altos de PUFA y vitamina E. Estos niveles las protege del daño oxidativo relacionado con una alta actividad metabólica (actividad tolerogénica) (89). Se propone que la vitamina E puede mejorar la función mediada por las células T al promover directamente la integridad de la membrana y modular positivamente los eventos de señalización en las células T. También a la actividad indirecta sobre las células T al reducir la producción de factores supresores de las células T (Ej. PGE2 de los macrófagos).
La mayoría de los estudios que muestran el mecanismo de acción de esta vitamina se han realizado en animales (89). Asimismo, la relación entre la vitamina E, la actividad inmune y el riesgo de infección muestra resultados contradictorios, probablemente debido a la falta de estandarización de los estudios. Asimismo, un exceso de α-tocoferol en suero puede dar lugar a efectos pro-inflamatorios (89). En definitiva, aunque los estudios apuntan a un papel importante de la vitamina E en el equilibrio inmunológico, las conclusiones de cara al rendimiento aún deben ser aclaradas.
La vitamina C es un cofactor esencial en reacciones enzimáticas. También es un potente antioxidante hidrosoluble eficaz como eliminador de ROS (74). Se encuentra en altas concentraciones en los leucocitos, pero el nivel cae drásticamente durante un resfriado, cuando aumenta el estrés oxidativo. Se sugiere la suplementación con vitamina C para mejorar la tolerancia al mitigar el daño excesivo a los tejidos durante la infección (73).
Los mecanismo por los que la vitamina C interviene son varios y actuan tanto en la inmunidad innata como en la adquirida. Algunos de estos procesos serían: mejora de la función fagocítica, reparación de tejidos, resolución de la inflamación o mejora en la fagocitosis de los microbios (73,74).
Una revisión muestra que una disminución de la incidencia del 50 % cuando se toma entre 0,25-1 g/día de vitamina C (21,74). Es decir, actúa sobre la prevención y síntomas del resfriado, aunque no sobre la duración de este. No obstante, se desconocen las dosis óptimas eficaces de vitamina C, por lo que se necesita más investigación (74).
Las principales fuentes alimentarias de vitamina C se muestran en la tabla 3 y su consumo es seguro. No obstante, dosis elevadas de suplementación con antioxidantes podrían bloquear las adaptaciones derivadas del entrenamiento. Asimismo, hay estudios que apoyan la valoración previa del estatus de antioxidantes en los deportistas para valorar la influencia sobre sus adaptaciones deportivas (74).
Los PUFA omega 3 (PUFAS n-3), principalmente el eicosapentaenoico (EPA) y el docosahexaenoico (DHA) tienen un gran impacto en las funciones de las células inmunes. Las fuentes alimentarias principales de PUFA n-3 se muestran en la tabla 3, siendo la más utilizada, el aceite de pescado (89).
La combinación de EPA y DHA contrarrestan el efecto de estímulos inflamatorios clásicos como la endotoxina y los PUFA n-6. Son sustratos para la síntesis de mediadores encargados de resolver la inflamación, como las resolvinas y las maresinas. Por ello, se trata de un nutriente útil para mantener el equilibrio inmunológico a través de sus mecanismos tolerogénicos. Los efectos dependen de la dosis y pueden requerir ingestas de 2 g/día (12,89).
Entre sus principales mecanismos encontramos la reducción de la transcripción genética de mediadores pro-inflamatorios como NFκB. También, tienen capacidad de inhibir la producción de mediadores inflamatorios, como los eicosanoides, las citocinas proinflamatorias (IL-1β, TNF-α, IL-6), quimiocinas (IL-8, MCP-1), moléculas de adhesión (ICAM-1, VCAM-1, selectinas), factor de activación de plaquetas, ROS y nitrógeno. Asimismo, los PUFA n-3 pueden aumentar recíprocamente la producción de citocinas antiinflamatorias como la IL-10 (12,89).
Hay muchos estudios sobre la actividad inmunitaria de EPA y DHA en el contexto del ejercicio. No obstante, debido a las diferencias de protocolo y dosificación, resulta complicado llegar a conclusiones sobre marcadores y respuestas inmunes e inflamatorias reportadas (12,89).
Las conclusiones apuntan a que los PUFA n-3 parecen disminuir la inflamación inducida por el ejercicio, el daño muscular y el dolor en personas sin entrenamiento, y se sugiere que pueden tener influencia en sujetos entrenados, aunque los resultados no son contundentes hasta el momento (81,82). Por ello, se requieren más estudios científicos y más estandarizados de cara a una aplicación práctica de PUFA n-3 en la mejora del equilibrio inmunológico de los atletas.
Ciertas cepas de probióticos pueden aumentar la absorción de nutrientes, así como afectar a la farmacología y las propiedades fisiológicas de múltiples componentes de los alimentos (45). La Sociedad Internacional de Nutrición Deportiva sobre probióticos, demostró que su suplementación promueve una respuesta inmune saludable (45,94).
El ejercicio intenso y prolongado aumenta la permeabilidad intestinal. No obstante, cepas probióticas específicas pueden mejorar la integridad
de la barrera intestinal, lo que reduciría la cantidad de episodios de IVRA, su gravedad y su duración. Se ha relacionado con una mejor recuperación del ejercicio (45,70,89) y un metaanálisis muestra como el uso de probióticos acorta la incidencia de infecciones de vías respiratorias en un 50 % en población general y también la duración de esas infecciones en aproximadamente en 2 días. Aunque se requieren más investigaciones, la literatura marca un camino muy interesante ante los probióticos (72).
Se han postulado diferentes mecanismos frente a IVRAS, entre los que destaca el mantenimiento de los niveles de inmunoglobulina A durante periodos de entrenamiento intenso. Asimismo, los probióticos pueden inducir citocinas proinflamatorias para facilitar la respuesta inmune contra la infección, y también pueden inducir citocinas antiinflamatorias para mitigar la reacción inflamatoria excesiva, lo cual conduce a una homeostasis equilibrada (45).
Dado que las investigaciones se han realizado en cepas muy específicas, aún queda mucho camino hasta determinar que alimentos pueden ser relevantes para el equilibrio inmunológico (95). La tabla 3 contiene alimentos con mayor efecto probiótico.
Los flavonoides constituyen aproximadamente el 50 % de todos los polifenoles (12,96). En la tabla 3 se aprecian las principales fuentes alimentarias que lo aportan. Muchos flavonoides poseen propiedades antioxidantes y ejercen efectos antivirales. Modulan las actividades de las células NK, las propiedades reguladoras de las células T (Treg) e influyen en la respuesta inflamatoria de los macrófagos. Una revisión sistemática y metaanálisis mostraron que su suplementación (0.2-1.2 g/día) disminuyó la incidencia de URTI un 33% (96).
Los datos en general respaldan que los extractos de plantas ricos en polifenoles y mezclas únicas de polifenoles y nutrientes tienen efectos pequeños pero significativos sobre la capacidad antioxidante, con efectos inconsistentes a corto plazo para mitigar el estrés oxidativo inducido por el ejercicio, la inflamación y la disfunción inmune (12). Se necesita investigación para estandarizar protocolos y definir regímenes de dosificación óptimos, así como para valorar si el aumento de la ingesta de alimentos ricos en polifenoles produce efectos bioactivos significativos sin la necesidad de altas dosis de mezclas únicas de flavonoides (12,96).
Catequinas y té verde. La catequina es un antioxidante polifenólico que aparece como metabolito secundario en algunas plantas. El té verde contiene un alto contenido de catequinas. Concretamente, la epigalocatequina-3-galato (EGCG) es el metabolito más abundante y el principal responsable de los beneficios del té verde.
El té verde y el EGCG son efectivos en la modulación de múltiples aspectos de la inmunidad innata y adaptativa (89). La propiedad antiinflamatoria de EGCG deriva principalmente de su efecto inhibitorio sobre la producción de moléculas proinflamatorias como los macrófagos, aunque también sobre la supresión y modulación de células T (89).
El efecto inmunomodulador y antiinflamatorio de las EGCG del té verde parece tener un beneficio potencial para prevenir y potenciar el equilibrio de células inmunitarias ante un aumento de la respuesta inmune. Sin embargo, los resultados no están exentos de controversia. Algunos investigadores han reportado resultados variables y las discrepancias pueden estar relacionadas con los variados protocolos y escenarios experimentales. Además, hay que tener en cuenta que la mayoría de los estudios son in vitro (89).
En la tabla 3, se aprecian los principales nutrientes tolerogénicos y los alimentos en los que se encuentran más presentes.
La vitamina D, los probióticos, la vitamina C y el Zn son suplementos con un buen grado de evidencia. Todos ellos tienen funciones con capacidad de promover el equilibrio inmunológico. Para el resto de los suplementos estudiados la evidencia es limitada (11,12).
El objeto de esta revisión bibliografía fue investigar los aspectos nutricionales que pueden mejorar la respuesta inmunológica en deportistas de élite. La inmunonutrición y la fisiología del ejercicio son áreas de investigación que han experimentado grandes avances recientemente (68). Existen muchos factores vinculados al ejercicio físico que, por su efecto sobre el sistema inmune, pueden repercutir positiva o negativamente sobre la salud y rendimiento de los atletas (60).
Aunque la literatura científica hoy en día no aporta una comprensión totalmente esclarecedora sobre cómo el cuerpo regula el daño producido durante una infección (20,39), la hipótesis de que se puede mejorar la respuesta inmune en deportistas de élite a través del equilibrio entre la resistencia y la tolerancia inmune va ganando fuerza. Concretamente, hay un interés creciente por agudizar el estudio de los compuestos tolerogénicos (20) ya que podrían revelar nuevos mecanismos inmunes y, por consiguiente, nuevos métodos de tratamiento y prevención de infecciones. Asimismo, debido a que el estudio de la tolerancia inmunológica es relativamente reciente, no se pueden descartar posibles efectos negativos, aún desconocidos (60,68).
Gran parte de los estudios en inmunonutrición se centran en el análisis de nutrientes o compuestos concretos. No obstante, el protagonismo en el ámbito práctico no debería ser acaparado por los suplementos, sino por los alimentos. Por ejemplo, las fibras de avena o cebada suavizan el índice glucémico y, como consecuencia, la producción de óxido nítrico, superóxido y peroxinitrito, que son potentes moléculas prooxidantes y proinflamatorias. Si la dieta es inapropiada (Ej. Exceso de calorías) el sistema inmune innato reaccionará con respuesta inflamatoria, incluso a largo plazo (12).
Los hábitos o patrones de alimentación saludable también son clave. Hay evidencia suficiente para concluir que muchos de los patrones de alimentación disponibles en la sociedad moderna parecen tener impactos dañinos en la homeostasis intestinal, en el equilibrio inmunológico y, en general, en la salud humana (97,98). Por ejemplo, una alimentación con bajo aporte de verduras y hortalizas conducirá a un menor aporte de vitaminas, fibra y minerales importantes para la salud intestinal. Además, los hábitos alimenticios tienen capacidad de modular la función de las células T CD4 + e inducir ambientes regulatorios que promuevan la homeostasis inmunitaria a través de una mayor matriz de microbios intestinales (98,99).
Las principales recomendaciones nutricionales para mantener la salud inmune en los atletas serían: relacionar la ingesta de energía con el gasto, evitar dietas de choque, mantener una alimentación bien equilibrada, consumir > 50 % de la ingesta energética como hidratos de carbono y asegurar una ingesta adecuada de proteínas (21). Tampoco hay que olvidar que, para mejorar el potencial inmunológico a través de la alimentación, es necesario realizar las adaptaciones dietéticas atendiendo a los requerimientos individuales y al contexto de cada atleta. También es importante valorar el escenario en el que se encuentra el deportista (12). De acuerdo con las declaraciones de consenso en inmunonutrición y ejercicio (12), existen nutrientes/suplementos con apoyo moderado sobre el resfriado común y la inmunidad en diferentes situaciones. Así, la vitamina D3, C y los probióticos operan en un escenario invernal; el Zn y la vitamina C disminuyen el riego de IVRA y los probióticos son aconsejables en viajes aéreos.
Por otra parte, es importante situar a la prevención como la primera línea de acción. Teniendo en cuenta los factores de riesgo asociados a infecciones, las acciones preventivas deben ser integrales y tener en cuenta diversos ámbitos de actuación. Las pautas preventivas según varios autores incluirían recomendaciones sobre hábitos de estilo de vida, carga y planificación del entrenamiento, factores psicológicos, higiene del sueño y recomendaciones nutricionales, entre otras (16,21).
A través de estudios de intervención se podría dar luz a algunas preguntas por investigar que aún quedan sin resolver. Por ejemplo, la aplicabilidad de los resultados. La población diana serían deportistas de élite por tres razones: los factores de riesgo de infección aumentan; se dificulta la prevención de estos, debido al contexto que gira en torno a los deportistas (Ej. Viajes aéreos, ejercicio frecuente e intenso, etc.); la aparición, dureza y duración de infección tiene repercusiones directas sobre el éxito deportivo y profesional de los sujetos. La principal podría hacerse a través de cambios en la alimentación y/o suplementación y se encontrarían diferentes variables de estudios. Por un lado, el estudio de marcadores del sistema inmunológico en diferentes momentos vinculados a situaciones de riesgo de infección (Ej. En competiciones, tras viajes, etc.). Por otro lado, la repercusión de las variables analizadas en la presencia, dureza y duración de las infecciones producidas.
En definitiva, explorar un nuevo modelo sobre inmunidad, basado en la homeostasis entre la resistencia y la tolerancia inmune, podría tanto aportar valor en el avance científico de esta área de investigación como contribuir a esclarecer de forma contextualizada las necesidades nutricionales y recomendaciones de alimentación de los deportistas de élite (9-11,60,68).
La inmunología del ejercicio y la inmunonutrición están adquiriendo una nueva dirección orientada a conseguir el equilibrio inmunológico para mejorar la respuesta inmune. Este enfoque destaca la importancia de la tolerancia inmunológica para mejorar los mecanismos de control, reducir los daños derivados de una posible infección y, con ello, contribuir a la eficacia y homeostasis del sistema inmune. Pretende conseguir la sinergia, conexión y complementariedad entre la resistencia y la tolerancia inmunológica y, en este entramado, la microbiota desempeña un papel fundamental. Los avances sobre este nuevo modelo de inmunidad resultan de gran interés para los atletas de élite ya que podría disminuir la incidencia de IVRA y, con ello, mejorar el éxito deportivo de los mismos. La evidencia científica apunta que se puede potenciar el equilibrio inmunológico y la respuesta inmune a través de la modificación de factores nutricionales. Dentro de los cuales, la vitamina D, los probióticos, la vitamina C y el Zn son los que cuentan con mayor evidencia. No obstante, debido a que la mayoría de los estudios se centran en compuestos o nutrientes en lugar de alimentos o patrones de alimentación, resulta complicado extrapolar la evidencia actual a recomendaciones de alimentación prácticas e individuales para atletas de élite. No se encontraron limitaciones del estudio mas que los criterios de inclusión y exclusión descritos en la metodología, aunque se trata de un área de investigación reciente y prometedora que requiere más estudios para su validación y aplicación.
Este estudio ha sido financiado por la Junta de Andalucía (Nutrición, Dieta y Evaluación de Riesgos. AGR255) y Fondos FEDER ISCIII PI14/0104
Este estudio forma parte de trabajos de investigación de Master de la UOC.
Todos los autores han revisado y aprobado el texto del artículo. Ninguno de los autores tiene conflictos de interés.
Recibido: 21/09/2020
Aceptado: 21/03/2021