 Beatriz Eugenia Guzmán Mendez2,
Beatriz Eugenia Guzmán Mendez2,  María Eugenia Jaramillo Flores2,
María Eugenia Jaramillo Flores2,  Luis Chel Guerreo1,
Luis Chel Guerreo1,  David Betancur Ancona1
David Betancur Ancona1 
Introducción. Las proteínas y polisacáridos con frecuencia son utilizados simultáneamente en la industria de alimentos. Las interacciones entre ambos biopolímeros juegan un papel importante en la estructura y estabilidad de muchos alimentos procesados ya que pueden resultar en un sistema con propiedades bioactivas diferentes como ocurre en el caso de las funcionales. Objetivo. Evaluar los cambios en la capacidad antioxidante de un sistema hidrocoloide mixto formado por un hidrolizado enzimático proteico de frijol endurecido (P. vulgaris) y goma modificada de flamboyán (Delonix regia) (SHM). Materiales y métodos. El estudio se hizo entre febrero-octubre, 2014, en Mérida, México. Se modificó enzimáticamente el concentrado proteico de P. vulgaris con Pepsina-Pancreatina® y la goma extraída del flamboyán mediante carboximetilación, preparando dispersiones al 1% de cada uno de los biopolímeros, determinado la fluorescencia intrínseca de Trp (FIT) como indicador de la interacción entre ambos biopolímeros y la actividad antioxidante y quelante del sistema resultante. Resultados. Se obtuvo un hidrolizado proteico extensivo con 28,8% de grado de hidrólisis y una goma de flamboyán con grado de sustitución de 0,91. La mayor interacción entre ambos biopolímeros, se obtuvo empleando una relación 5:1 del SHM a pH 4 de acuerdo con el valor de FIT. Conclusiones. Los sistemas hidrocoloides mixtos preparados con hidrolizado extensivo de las proteínas Phaseolus vulgaris y goma modificada de flamboyán presentaron un incremento en la actividad antioxidante, respecto del hidrolizado dependiendo del mecanismo de oxidación, así como de las condiciones de pH en que se encuentra el sistema y la interacción entre ambos componentes. Arch Latinoam Nutr 2021; 71(3): 208-217.
Palabras clave: goma de flamboyán, frijol endurecido, hidrolizado enzimático, actividad antioxidante, sistemas hidrocoloides mixtos.
Introduction. Proteins and polysaccharides are frequently used simultaneously in the food industry. The interactions between both biopolymers play an important role in the structure and stability of many processed foods since they can result in a system with different bioactive properties as in the case of functional ones. Objective. Evaluate the changes in the antioxidant capacity of mixed hydrocolloid system formed by a hard to cook bean (P. vulgaris) protein enzymatic hydrolyzate and modified flamboyant gum (Delonix regia) (SHM). Materials and methods. The study was conducted from February to October 2014 in Merida, Mexico. For this, the protein concentrate of P. vulgaris was treated with Pepsin-Pancreatin® and the gum extracted from the flamboyant were modified enzymatically by carboxymethylation, preparing 1% dispersions of each of the biopolymers, determining the intrinsic Trp fluorescence (FIT) as an indicator of the interaction between both biopolymers and the antioxidant and chelating activity of the resulting system. Results. The main results indicated that an extensive protein hydrolyzate with 28.8% degree of hydrolysis and a flamboyant gum with a substitution degree of 0.91 were obtained. The greatest interaction between both biopolymers was obtained using a 5:1 ratio of SHM to pH 4 according to the FIT value. Conclusions. The mixed hydrocolloid systems prepared with extensive hydrolyzate of the hard to cook P. vulgaris and modified flamboyant gum proteins showed an increase in antioxidant activity, compared to the hydrolyzate depending on the oxidation mechanism, as well as the pH conditions used and interaction between both components. Arch Latinoam Nutr 2021; 71(3): 208-217.
Key words: flamboyant gum, hard to cook bean, enzymatic hydrolyzate, antioxidant activity, mixed hydrocolloid system.
https://doi.org/10.37527/2021.71.3.005
Autor para la correspondencia: David Betancur Ancona, E-mail: [email protected]
Muchas de las enfermedades crónicas como cáncer, obesidad, hipertensión, enfermedades cardiovasculares que afectan a gran parte de la población están directamente relacionadas con la dieta alimenticia.
Esto ha contribuido a la búsqueda y al desarrollo de alimentos que además de su aporte nutrimental resulten útiles para la prevención de enfermedades e incluso funcionen como terapéuticos. Durante los últimos años las proteínas se han estudiado como materia prima para la obtención de péptidos biológicamente activos dependiendo de su grado de hidrólisis. Actualmente las proteínas de origen vegetal despiertan gran interés por ser una alternativa con alto potencial debido al contenido proteico, disponibilidad y accesibilidad económica que poseen. Por otra parte, las interacciones que ocurren entre las proteínas o hidrolizados de éstas y los polisacáridos son un factor clave en el desarrollo y procesado de productos novedosos, ya que ellas influyen en las propiedades funcionales de los alimentos y por consiguiente en la bioactividad de los complejos. Desde el siglo pasado (1) se han reportado los posibles mecanismos de interacción de mezclas de proteínas y polisacáridos en sistemas acuosos resultantes en el complejamiento y la incompatibilidad que resultan en cuatro tipos de sistemas: dos que contienen complejos solubles (en una sola fase) y otros dos insolubles (en dos fases). En el sistema monofásico, los dos biopolímeros pueden existir como moléculas individuales o como complejos solubles que se distribuyen uniformemente por todo el sistema. En un sistema de dos fases, la solución se separa en dos fases distintas que tienen diferentes composiciones de biopolímeros. La separación de fase puede ocurrir a través de dos mecanismos fisicoquímicos diferentes: separación asociativa y segregativa. En la separación asociativa, hay una atracción relativamente fuerte entre los dos tipos diferentes de biopolímeros que hace que se asocien entre sí (2). Estudios realizados con hidrolizados proteicos (3-5), para modificar las propiedades funcionales de las proteínas se ha recurrido a la hidrólisis enzimática, la cual si es menor de 10% de grado de hidrólisis (GH) mejora esas propiedades funcionales y si es mayor a 10% se obtienen hidrolizados que proveen de actividad bioactiva, entre éstas la capacidad de inhibir la actividad de la enzima convertidora de la angiotensina, antioxidante, antimicrobiana, entre otras. Ambos tipos de propiedades, funcionales y bioactivas, se ven modificadas por diversos factores, como son el pH, temperatura, concentración de las biomoléculas, entre otras, además del grado de hidrólisis. Esto por ejemplo evidenciado en el estudio del comportamiento de los polisacáridos como estabilizadores de espumas de proteínas hidrolizadas de girasol. En éste se encontró que el comportamiento de los polisacáridos dependió del nivel de hidrólisis, hasta un 10 % de GH, además de la estructura del polisacárido y su concentración en el líquido utilizado para hacer la espuma. Los resultados además sugirieron que, como resultado de la hidrólisis proteica, una interacción antagónica entre los polisacáridos y la proteína hidrolizada debe tener lugar en la interfaz (4). Debido a la influencia que se ha demostrado en modificar las propiedades funcionales, es de esperarse por consiguiente una influencia importante de los polisacáridos sobre la bioactividad de las proteínas nativas o hidrolizadas. Se ha encontrado que existe poca o nula investigación realizada en el caso de las propiedades bioactivas de los complejos sintéticos aunque algunos trabajos realizados con compuestos nativos formados por polisacáridos polipéptidos o proteínas, dependiendo de la estructura de ambos componentes pueden proporcionar diferentes tipos de propiedades bioactivas por ejemplo un complejo proteína-polisacárido aislado del hongo Coriolus versicolor han presentado ciertas bioactividades, de tipo anticancerígena e inmuno moduladora (6). También se ha reportado la actividad anticancerígena de un complejo polisacárido-péptido extraído del micelio de Grifola fondosa sobre la línea celular del carcinoma gástrico por medio de la apoptosis celular (7). Una de las leguminosas de gran importancia en la dieta de la población latinoamericana debido al contenido nutrimental que ésta aporta, es el frijol común (Phaseolus vulgaris L.); sin embargo, al estar expuesto a inadecuadas condiciones de almacenamiento, éste puede llegar a endurecerse disminuyendo la calidad que posee, lo cual lo convierte en un desperdicio alimentario con los consiguientes perjuicios económicos y ambientales que representa. Por tal motivo se ha planteado la opción de recurrir a granos subutilizados como Phaseolus vulgaris endurecido para la obtención de hidrolizados proteicos que posiblemente presenten actividad biológica, así como la obtención de goma modificada de Delonix regia para la formación de sistemas hidrocoloides mixtos que estabilicen o mejoren algunas de las propiedades bioactivas de los hidrolizados. El objetivo del trabajo fue caracterizar los sistemas hidrocoloides mixtos formados por hidrolizados proteicos de Phaseolus vulgaris endurecido y goma modificada de la semilla de flamboyán (Delonix regia), así como evaluar su actividad antioxidante y quelante.
El estudio se llevó a cabo de febrero a octubre de 2014, en la ciudad de Mérida, México. Se obtuvieron 15 kg de frijol común (P. vulgaris) provenientes de la central de abastos de la ciudad de Mérida. Los granos presentaron una dureza de 15N y un tiempo de cocción de 70 min superior a lo establecido por la norma mexicana (8). Los granos se trituraron empleando un molino Cyclotec 1093, para obtener una harina con tamaño de partícula de 250 mm.
Se recolectaron aleatoriamente vainas enteras y secas de árboles procedentes de la ciudad de Mérida. Se obtuvieron 10 kg de semillas. La obtención de la harina de endospermo se realizó por una adaptación del método de Pacheco et al (9).
Se utilizó el método reportado por Betancur et al (10) con algunas modificaciones. Se procesaron lotes de 1 kg de harina mediante una dispersión en agua destilada en una relación 1:10 (p/v) y el pH fue ajustado a 11 con NaOH 1N, para la obtención del concentrado proteico (CPv), se ajustó el pH a 4,5 (punto isoeléctrico) empleando HCl 1M, posteriormente la dispersión se centrifugó, el precipitado se recuperó y liofilizó. Para la obtención de los hidrolizados de P. vulgaris endurecido se siguió el método de Megías et al (11) con algunas modificaciones. Se empleó un sistema enzimático secuencial de Pepsina®-Pancreatina® para obtener un hidrolizado extensivo (HEv). El grado de hidrólisis (G.H.) se determinó siguiendo la técnica del ortoftaldehído (OPA) (12).
La extracción de la goma nativa de flamboyán se realizó por medio de una adaptación del método de Pacheco et al (9). La goma se modificó químicamente por carboximetilación (GMF) (13). El grado de sustitución, que se determinó de acuerdo con el método propuesto por Pacheco et al (9), está dado por la cantidad de ácido consumido por los grupos carboximetilos sustituidos.
Se llevó a cabo a partir de adaptaciones realizadas a los métodos reportados por Espinosa et al (14) Se prepararon dispersiones al 1% (p/p) del hidrolizado proteico y goma carboximetilada en agua desionizada. El pH se ajustó a pH 3, 3,5 y 4 para favorecer la formación de complejos electrostáticos (15).
Se realizó de acuerdo con el método reportado por Pérez et al (16) en un espectrofluorómetro. A dispersiones de los diferentes SHM se les agregó la sonda fluorescente hidrofóbica ácido 1-anilino-8-naftalen sulfónico (ANS). Se utilizó una longitud de onda de excitación de 295 nm para evitar la excitación de los residuos de Tyr. El espectro de emisión se corrió desde 310 hasta 450 nm. Para la excitación y la emisión se fijó un slit de 10,0 nm.
Al hidrolizado extensivo (HEv) y a los sistemas hidrocoloides mixtos se les determinaron las propiedades bioactivas que se describen a continuación:
Para la determinación de esta prueba se emplearon los siguientes métodos: oxidación de β-caroteno (17) oxidación de mezcla de ácidos linoleico/oleico/linolénico y captación de radicales libres con DPPH (18).
Oxidación de β-caroteno: Se preparó una solución de β-caroteno (4 mg/mL) en cloroformo y se le añadió 1 mL de tween 20. Se tomaron alícuotas (600 μL) de esta solución, se les añadió CuSO4 1 mM y 60 μL de la muestra. Se utilizaron dos tipos de controles, uno en el que se determinó la oxidación del β-caroteno en presencia de la muestra, pero en ausencia de cobre (control positivo) y otro en el que se determinó la oxidación del β-caroteno en presencia de cobre, pero en ausencia de muestra (control negativo). La degradación del β-caroteno se evaluó midiendo en un espectrofotómetro (Jenway modelo 6305) la disminución de la absorbancia a 470 nm a distintos tiempos durante 120 min.
Oxidación de lípidos: Se preparó una solución compuesta por una mezcla de ácidos grasos linolénico: linoleico: oleico en una relación 70:25:5. Se preparó un control para cada prueba y se tomaron alícuotas de 800 μL, se les añadió 50μL de CuSO4 1 mM y se incubaron en presencia de la muestra a 37°C durante 24 h. Las lecturas se realizaron por triplicado a las 0, 4, 8 y 24 h a 532 nm.
Captación de radicales libres (DPPH): La actividad de captación de radicales libres fue medida de acuerdo con la metodología propuesta por Shimada et al (18) con algunas modificaciones. Se preparó una solución de DPPH (Sigma D9132) 0,1 mM en metanol a la cual se le añadió la muestra, se agitó en un vórtex y finalmente se realizó la lectura después de 30 min a temperatura ambiente. El control se preparó con 0,5 mL de radical y 0,5 mL de metanol. El porcentaje de captación de radicales libres fue calculado mediante la siguiente fórmula:

Actividad quelante de Cu+2: Se efectuó de acuerdo con el método propuesto por Saiga, Tanabe y Nishimura (19) con pequeñas modificaciones. Se utilizó buffer de acetato sódico pH 6 (1 mL, 50 mM), una solución control de CuSO4.5H2O (10 μg de Cu) y 25 μL de Pirocatecol violeta 4 mM (PV) (Sigma P7884). Después de 5 min a temperatura ambiente se le añadió la muestra (100 μL) y se leyó a una absorbancia de 632 nm. Para el cálculo se utilizó la siguiente fórmula:
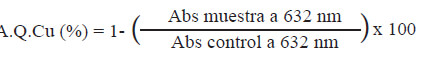
Actividad quelante de Fe+2: Se llevó a cabo siguiendo el método de Carter (20). Se utilizó buffer acetato sódico 100 mM pH 4,9; una solución de FeCl2.4H2O (1μg de Fe/μL de agua) y ferrozina (PDT disulfonato, Sigma P5338) 40 mM. El control estuvo compuesto por 1 mL de buffer, 100 μL de FeCl2, 100 μL de agua y 50 μL de ferrozina. Para evaluar las muestras se utilizó 1 mL de buffer, 100 μL de FeCl2 y 100 μL de muestra, se mantuvo a temperatura ambiente durante 5 min y por último se le añadió 50 μL de ferrozina. Para el cálculo se empleó la siguiente fórmula:
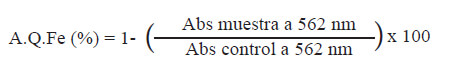
Los resultados de los análisis se expresaron como valores promedio. Los datos obtenidos fueron estadísticamente analizados mediante un análisis de varianza de una vía (ANOVA). Las diferencias entre las medias se identificaron aplicando el método de rangos múltiples de Duncan por medio del paquete computacional Statgraphics Plus 5.1.
Con respecto a los hidrolizados de P. vulgaris se alcanzaron valores de 28,78% para la hidrólisis extensiva con el sistema secuencial Pepsina®-Pancreatina®.
En cuanto a la goma nativa se obtuvo un rendimiento de extracción del 20%, El contenido de E.L.N. fue de 94,27%. Al ser sometida la goma nativa de flamboyán a la modificación química mediante carboximetilación se alcanzó un grado de sustitución de 0,91 cuyo valor corresponde a un 30% de sustitución carboximetílica.
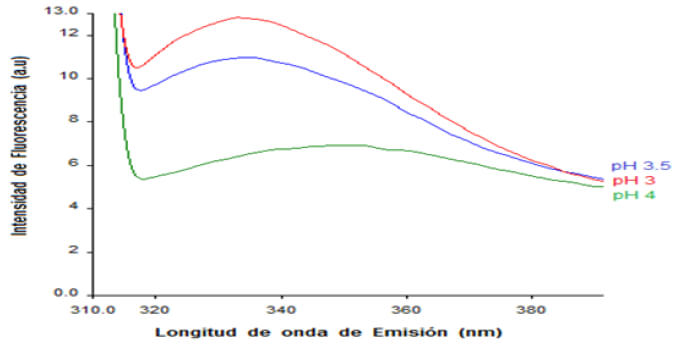
El triptófano (Trp) es el fluoróforo intrínseco más estudiado entre las proteínas, la fluorescencia de este aminoácido es altamente sensible a las condiciones locales del medio ambiente de las mismas (16). En la figura 1 se pueden apreciar las intensidades alcanzadas por el SHM (Hev: GMF) a los 3 diferentes pH’s a los que se llevó a cabo la interacción.
Al HEv y al SHM (HEv:GMF) se les determinó la actividad antioxidante y la actividad quelante de metales (Tabla 1) encontrándose diferencias significativas entre ellos para cada bioactividad analizada (p<0,05). En general, se observó que la hidrólisis extensiva favoreció las bioactividades evaluadas, sin embargo, hubo una disminución de las mismas en los SHM (HEv:GMF) formados a pH 3, 3,5 y 4, excepto en la oxidación del β-caroteno en la cual el SHM 4 fue el que presentó la mayor actividad antioxidante.
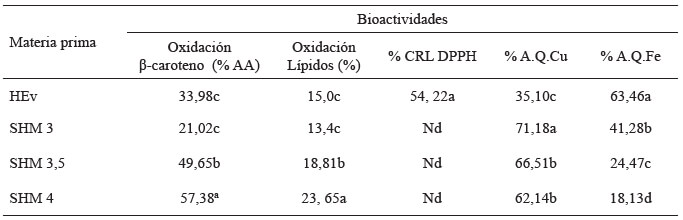
El porcentaje de actividad antioxidante fue mayor en los SHM (HEv:GMF) formados a pH 4 y 3,5 en comparación al Hev.
La inhibición de la peroxidación del ácido linoleico fue mayor en el SHM 4 en comparación con el HEv el cual tuvo un porcentaje de inhibición de 15%. Se observó que los porcentajes de inhibición en SHM disminuyeron conforme al pH en el cual se llevó a cabo la interacción, presentándose diferencias estadísticas significativas (p<0,05). Por medio de este análisis se pudo observar la habilidad que tuvo la interacción para inhibir la oxidación lipídica.
La CRL DPPH para HEv fue de 54,22% a una concentración de 500 μg/ml, mientras que el concentrado proteico a esta misma concentración presentó un valor menor (10,78%) (p<0,05). Al evaluar la CRL DPPH de los SHM (HEv:GMF) no se registró actividad alguna, lo que sugiere que los sitios específicos que actuaban en la captación de estos radicales libres los cuales se encontraban expuestos en HEv se ligaron al polisacárido ocasionando una pérdida en esta bioactividad.
La hidrólisis extensiva a la que estuvo sometido el CPv, así como la interacción entre HEv y GMF, favoreció la formación de péptidos que incrementaron esta bioactividad resultando diferencias significativas entre ellos (p<0,05).
En cuanto al porcentaje de quelación del hierro en CPv (60,05%) fue muy similar al valor presentado por HEv (63,46%), sin embargo, estos resultaron mayores a los porcentajes obtenidos por el SHM (HEv: GMF).
Se ha reportado para las proteínas de frijol endurecido sometidas a hidrolisis secuencial con Pepsina-Pancreatina, valores que oscilan entre 13,62 a los 28,58% (10). El valor obtenido en este estudio fue menor al reportado por Ciau, Acevedo y Betancur (21) utilizando este mismo sistema secuencial, ya que obtuvieron hidrolizados de Vigna unguiculata con valores de 33,71 y 47,69% de G.H. Estas diferencias en los grados de hidrólisis obtenidos pudieron deberse a la especificidad que presentó cada enzima por el sustrato, así como a los diversos factores que posiblemente influyeron en la reacción como la concentración del sustrato, concentración de la enzima, variaciones en el pH y/o temperatura, así como a la composición de aminoácidos presentes en cada concentrado (22).
El rendimiento de extracción obtenido coincide con lo reportado por Morochi y Shiomi (23), mientras que, este porcentaje resultó mayor al 90,43% reportado por estos autores (23). El grado de sustitución obtenido en el presente trabajo es mayor que el reportado por Pacheco et al (9) y Corzo et al. (24) con 0,33 (11%) y 0,47 (14%) respectivamente, quienes trabajaron con goma de esta misma especie. El valor obtenido en este estudio fue similar a los reportados para la carboximetilación de celulosa y goma de Sesbania (Sesbania bispinosa) cuyo grado de sustitución fue de 0,95 (31,60%) (25). En gomas modificadas de Pachyman (Poria cocos Wolf), bajo este mismo método se alcanzaron grados de sustitución de 0,44 hasta 0,88 (26) Estudios realizados con almidón y celulosa han demostrado que la temperatura es un factor que influye en el incremento del grado de sustitución, de igual manera, se observó que mientras mayor sea el tiempo de reacción, mayor es el grado de sustitución que se logra.
La menor intensidad de fluorescencia para las interacciones formadas entre el HEv y GMF a partir de una relación de biopolímeros de 5:1 (p/p) se presentó a pH 4. Esto indica una mayor interacción de los polímeros a este pH. Weinbreck et al (15) reportan que los cambios en el pH alteran la ionización de los grupos cargados del hidrolizado, permitiendo que los biopolímeros sean atraídos debido a las cargas opuestas presentes cuando el hidrolizado se encuentra muy cercano al punto isoeléctrico y cuando el pH es mayor que el pKa de los sitios cargados en el polisacárido. Atracciones electrostáticas entre los biopolímeros ocurren cuando estos poseen cargas netas opuestas. Así mismo, la formación de complejos solubles entre proteína-polisacárido se lleva a cabo a valores de pH por arriba del pI (27). Además, la presencia de micro iones de Na+ y Cl– a bajas concentraciones (10 mM) favoreció la afinidad electrostática entre los hidrolizados y la GMF dando como resultado la formación de complejos en ambos sistemas.
Las interacciones electrostáticas juegan un papel muy importante durante la formación de complejos entre los biopolímeros. Weinbreck et al (15) sugieren que la cantidad de moléculas de proteínas que se encuentren disponibles por cadena de polisacárido serán importantes en la formación de complejos electrostáticos, y existirán condiciones específicas de pH, relación proteína-polisacárido y fuerza iónica para poder alcanzar la electroneutralidad del complejo. El SHM (HEv:GMF), a una relación de 5:1, requirió de una mayor cantidad de péptidos con menor peso molecular (3,70-30,44 kDa) en comparación con la del polisacárido aniónico de flamboyán que es más grande y ramificado, ya que al existir un mayor número de parches con carga neta positiva en la molécula de proteína, se formaron complejos electrostáticos a pH cercanos al pI de la proteína (28). Pérez et al (16) realizaron estudios a sistemas mixtos a base de suero de leche y polisacáridos midiendo la fluorescencia del triptófano y observaron que la intensidad del fluoróforo disminuyó notablemente. La disminución en la intensidad de fluorescencia en este estudio demostró la existencia de importantes interacciones entre los biopolímeros en fase acuosa a pH 3, 3,5 y 4.
El mayor porcentaje alcanzado por SHM 4 pudiera ser debido a la existencia de aminoácidos en la secuencia de los péptidos ligados al polisacárido, ya que la presencia de residuos carboxilo de aminoácidos ácidos, Asp y Glu, según lo reportado por Saiga, Tanabe, Nishimura (19) contribuyen en la actividad antioxidante. El porcentaje observado en HEv pudo deberse a la hidrólisis extensiva, lo que dio como resultados péptidos con diferente tamaño (3,70 a 30,4 kDa) y secuencia de aminoácidos con diferentes propiedades químicas y funcionales (29). Tal como indican Megías et al (30), la duración del tratamiento hidrolítico influyó en el efecto inhibitorio de los péptidos resultantes de la oxidación del β-caroteno. Así mismo, Guo, Kouzuma y Yonekura (31) observaron que la presencia de péptidos con residuos de aminoácidos hidrofóbicos como Val, Leu, Ile o Ala en la posición N- terminal contribuyeron a una fuerte actividad antioxidante. Por lo que es probable que estos residuos de aminoácidos desempeñen un papel importante en la actividad antioxidante.
La actividad antioxidante del hidrolizado proteico dependió de la especificidad de la enzima, las condiciones usadas durante proteólisis y el grado de hidrólisis, ya que la modificación enzimática con Pepsina®-Pancreatina® provocó la ruptura de la estructura proteica, lo que dio como resultado la formación de péptidos con residuos aminoacídicos capaces de actuar en la prevención de la oxidación de los ácidos grasos insaturados. Los péptidos formados en la hidrólisis podrían servir como una barrera física para formar una membrana alrededor de las gotas de lípidos y así prevenir la oxidación. Además, la peroxidación lipídica puede ser influenciada por las propiedades surfactantes de los péptidos mediante su habilidad para alterar las propiedades de la membrana interfacial de las gotas de la emulsión (32). Guo Kouzuma y Yonekura (31) sugieren que la presencia de Phe en el N- terminal es importante para inhibir la peroxidación lipídica debido a la naturaleza antioxidante de este aminoácido. El incremento de esta bioactividad por parte del SHM (HEv:GMF) a pH 4 pudiera ser debido a las cargas electrostáticas de los residuos aminoacídicos de los péptidos presentes en la interacción influyendo en la habilidad para estabilizar los radicales formados durante la oxidación. La actividad antioxidante en los SHM dependerá de la composición aminoacídica y de la conformación que presenten los péptidos una vez ligados al polisacárido. Algunos di y tripéptidos que contengan Tirosina (Tyr), Triptófano (Trp), Histidina (His), Metionina (Met) o Lisina (Lys) poseen una fuerte actividad antioxidante a diferencia de sus aminoácidos constituyentes en sistemas acuosos de autooxidación del ácido linoleico. Casi todos los péptidos que contengan residuos de Lys en el N- terminal y residuos de Tyr en su secuencia mostraron una fuerte actividad antioxidante contra la peroxidación del ácido linoleico (31).
El incremento en la actividad antioxidante por parte de HEv puede estar relacionado con el grado de hidrólisis obtenido (28,78%), puesto que se ha reportado que porcentajes con grado de hidrólisis superiores al 10% presentan mayor actividad antioxidante al generarse péptidos de bajo peso molecular (<20kDa) durante la hidrólisis extensiva, debido al incremento de la hidrofilicidad de los mismos, lo que permite una mayor interacción entre estos y los sustratos sobre los que actúan (33). De acuerdo con lo reportado por Saito et al. (34), la actividad antioxidante por parte de aminoácidos aromáticos (Trp, Tyr y Fenilalanina (Phe)) así como aminoácidos básicos (His, Arginina (Arg)) en la secuencia de los péptidos formados después de la hidrólisis pueden haber contribuido a un mayor incremento en esta bioactividad, debido a la capacidad que tienen los grupos fenólico, indólico e imidazol de actuar como donadores de hidrógeno y mantener la estabilidad molecular de los radicales. Resultados similares a los encontrados en este estudio fueron reportados por Gallegos et al (35), al evaluar hidrolizados de J. curcas reporta porcentajes ligeramente superiores al 40% de CRL DPPH. Así mismo, encontraron que estos últimos mostraron una mayor actividad de CRL DPPH en comparación con la proteína nativa. La capacidad reductora del hidrolizado puede servir como un indicativo de su potencial como antioxidante. La captación de CRL DPPH en los SHM no fue detectada probablemente por el medio en el que se desarrolló la prueba (metanol), el cual influyó en la precipitación de la goma presente en la interacción lo que originó turbidez e impidió la lectura en el espectrofotómetro.
El incremento de esta bioactividad en el hidrolizado se encuentra directamente relacionado con el G.H., ya que comportamientos similares han sido reportados por Megías et al. (11) en hidrolizados procedentes de girasol. La especificidad de las enzimas Pepsina®-Pancreatina® utilizadas en este estudio favoreció la formación de péptidos con aminoácidos como His, Arg, Met y Cisteína (Cys), cuya presencia podría estar relacionada con esta bioactividad, ya que se ha reportado que estos aminoácidos pueden unirse al cobre fácilmente, en particular la His debido a la habilidad que posee su grupo imidazol para donar protones como indican Megías et al. (11). Así mismo, la presencia de aminoácidos hidrofóbicos como la Valina (Val), Leucina (Leu), Triptófano (Trp) y Tyr en el hidrolizado podría sugerir la presencia de potencial antioxidante debido a la capacidad que tienen de actuar como donadores de hidrógeno (34). Los valores obtenidos en el presente estudio resultaron superiores a los reportados por Gallegos et al (35) quienes al trabajar con hidrolizados proteicos de Jatropha curcas obtienen como máximo una capacidad quelante del cobre de 60% a los 50 min de hidrólisis con la enzima Alcalase®. Los más altos porcentajes de A.Q.Cu alcanzados por el SHM pudieron deberse a un adecuado reacomodo por parte de los péptidos presentes en HEv al enlazarse al polisacárido, lo que pudo haber favorecido la exposición de sitios con grupos de aminoácidos que contribuyen a la quelación de este metal.
Los más altos valores observados en esta bioactividad pudieran estar relacionados con la secuencia de aminoácidos en los péptidos formados por las proteasas empleadas durante la hidrólisis, ya que dependiendo de la especificidad de cada enzima una amplia variedad de pequeños péptidos o incluso aminoácidos libres son generados. Torres et al (36) reportaron actividad quelante del hierro en péptidos de hidrolizados proteicos de garbanzo y observaron que esta actividad fue dependiente del tamaño, así como de la composición y secuencia del péptido obtenido. Gallegos et al (35) al trabajar con péptidos de hidrolizados procedentes de Jatropha curcas reportaron que fracciones con bajo peso molecular presentaron una alta actividad quelante del hierro. En el SHM conforme el pH incrementó, esta bioactividad fue disminuyendo notablemente. Este comportamiento pudiera ser debido a que la interacción electrostática entre los biopolímeros se hizo más fuerte a pH 4 de acuerdo con los resultados observados en la hidrofobicidad intrínseca, lo que pudo haber contribuido a que esta actividad fuera menor en comparación con la quelación del cobre. Estas pequeñas variaciones en la actividad quelante del hierro y cobre por parte de los péptidos quelantes pueden ser atribuidos a las ligeras diferencias químicas y físicas entre estos dos metales como reporta Torres et al (36). Además, el efecto estérico así como la secuencia de aminoácidos expuestos en el SHM (HEv:GMF) pudo haber contribuido a esta reducción de la actividad. Sin embargo, estudios realizados por Megías et al (11) indican que la presencia del aminoácido His así como también la presencia de aminoácidos polares, contribuyen a la actividad quelante. De igual manera se ha visto que la presencia de aminoácidos como Glu+Gln, Asp+Asn y Cys, podrían contribuir en esta bioactividad por parte del HEv.
Los sistemas hidrocoloides mixtos preparados con el hidrolizado proteico extensivo del frijol endurecido y goma modificada de flamboyán, presentaron un incremento en la actividad antioxidante empleando sustratos como β-caroteno y lípidos. La actividad de captación del radical DPPH, incrementó cuando la proteína fue hidrolizada, sin embargo, ésta se perdió al interactuar con la goma modificada. En los sistemas generados se observó un incremento en la actividad quelante del Cu+2, sin embargo, para la actividad quelante de Fe+2 se detectó una disminución en comparación con el HEv. Estos resultados demostraron que los hidrolizados proteicos provenientes de frijol endurecido son una buena fuente de péptidos con bioactividad y funcionalidad, cuya interacción con la goma modificada de flamboyán, forman sistemas hidrocoloides mixtos que mejoran estas propiedades y que podrían ser incorporados potencialmente en la elaboración de alimentos funcionales.
Recibido: 03/03/2021
Aceptado: 12/08/2021