 Diana Laura Hernández de los Ríos1,
Diana Laura Hernández de los Ríos1,  Carmen Alejandrina Virgen-Carrillo2,
Carmen Alejandrina Virgen-Carrillo2,  Jessica Elizabeth Pineda-Lozano2,
Jessica Elizabeth Pineda-Lozano2,  Alma Gabriela Martínez Moreno2.
Alma Gabriela Martínez Moreno2. 
Introducción. La administración crónica de cafeína evita la alteración de la glucosa postprandial en ratas. El aumento en el consumo de la cafeína alrededor del mundo no es discutible, es así como su investigación se ha vuelto extensa en sus diferentes campos. Objetivo. Analizar los efectos de la administración crónica de cafeína en ratas alimentadas con dieta de cafetería, a través de evaluar índices de consumo, antropométricos y bioquímicos. Materiales y métodos. La dieta de cafetería es un modelo dietético equivalente a las características de la dieta occidental típica que origina síndrome metabólico en humanos. En esta investigación se realizó la administración crónica vía intraperitoneal de cafeína por ocho semanas a ratas adultas macho Wistar alimentadas con dieta de cafetería. Dada la poca evidencia acerca de los efectos biológicos y comportamentales de la administración crónica de dicha sustancia frente a un modelo de dieta de cafetería se evaluaron parámetros de consumo, antropométricos y bioquímicos. Resultados. La dieta de cafetería ocasionó anomalías asociadas al síndrome metabólico; no obstante, la administración de cafeína en las ratas alimentadas con esa dieta resultó ser un factor protector en la glucosa postprandial, más no en la alteración de la tolerancia a la glucosa o perfil lipídico. Conclusiones. La cafeína permitió proteger los niveles de glucosa postprandial al término del experimento y un descenso en el peso corporal y consumo de alimento solo en la primera semana. Sin embargo, no se observaron mejoras significativas en el perfil de lípidos, adiposidad, tolerancia a la glucosa y glucosa plasmática. Arch Latinoam Nutr 2021; 71(4): 300-309.
Palabras clave: cafeína, dieta de cafetería, síndrome metabólico, glucosa postprandial, ratas.
Introduction: Chronic caffeine administration prevents postprandial glucose disturbance in rats. The increase in caffeine consumption is not debatable, this is how his research has become extensive in his different fields. Objective. To analyze the effects of chronic administration of caffeine in rats fed a cafeteria diet, by evaluating consumption, anthropometric and biochemical indices. Previous studies refer to administering caffeine in diets high in carbohydrates and / or in fat that induce obesity or symptoms of metabolic syndrome. Material and methods. The cafeteria diet is a dietary model equivalent to the characteristics of the typical western diet that causes metabolic syndrome in humans. In this research, chronic intraperitoneal administration of caffeine was performed for 8 weeks to adult male Wistar rats fed a cafeteria diet. Given the little evidence about the biological and behavioral effects of the chronic administration of this substance against a cafeteria diet model, consumption, anthropometric and biochemical parameters were evaluated. Results. After eight weeks it was found that the cafeteria diet given to the controls caused abnormalities associated with the metabolic syndrome; regarding the administration of caffeine in the rats fed this diet, the treatment turned out to be a protective factor in postprandial glucose, but not in the alteration of glucose tolerance or lipid profile. Conclusions. Caffeine allowed to protect postprandial glucose levels at the end of the experiment and a decrease in body weight and food consumption only in the first week. However, no significant improvements were seen in lipid profile, adiposity, glucose tolerance, and plasma glucose. Arch Latinoam Nutr 2021; 71(4): 300-309.
Key words: caffeine, cafeteria diet, metabolic syndrome, postprandial glucose, rats.
https://doi.org/10.37527/2021.71.4.007
Autor para la correspondencia: Alma Gabriela Martínez Moreno, E-mail: [email protected]
La cafeína es el psicoestimulante más consumido en todo el mundo y se admite como segura a determinadas dosis o concentraciones a través de los vehículos en lo que más se consume; café (71%), refrescos (16%) y té (12%) (1). El estudio de la cafeína es extenso debido a los múltiples mecanismos bajo los que actúa, teniendo efectos a diferentes niveles; metabólicos, conductuales, cognitivos y psicomotores (2). Esta sustancia es un estimulante del sistema nervioso central, con efectos adicionales que incluyen aumentos en el gasto de energía en reposo, resistencia, rendimiento físico, función cognitiva y mejoras en las funciones de comportamiento como el estado de ánimo (3,4).
Tanto en animales como en humanos, la cafeína se absorbe rápida y completamente en el tracto gastrointestinal. En humanos, el 99% de la cafeína ingerida se absorbe dentro de los primeros 45 minutos, 20% a nivel del estómago y la mayor parte en el intestino delgado. La cafeína entra al compartimento de agua del tejido y se distribuye uniformemente en todos los fluidos corporales y órganos. Las concentraciones más altas de cafeína en plasma persisten entre 1-2 horas posteriores a la ingesta, con una vida media de 2,5 a 5,5 horas, alcanzando hasta 9,9 horas, dependiendo de las diferencias interindividuales (5-6).
La cafeína es un antagonista no selectivo del receptor de adenosina. Al atravesar fácilmente la barrera hematoencefálica, bloquea los receptores de adenosina, especialmente los receptores de adenosina A1 y A2A, y en menor medida también bloquea a la fosfodiesterasa. El bloqueo de los receptores de adenosina influye en la liberación de neurotransmisores (7). Los receptores de adenosina se encuentran en todo el cuerpo, principalmente en el cerebro, corazón, vasos sanguíneos, tracto respiratorio, riñones, tejido adiposo y tracto gastrointestinal, sin embargo, la mayor densidad de receptores se localiza en el tejido adiposo (8).
El receptor A1 (A1R) es dominante en los adipocitos donde media muchas acciones que incluyen la inhibición de la lipólisis, la estimulación de la secreción de leptina y la protección contra la resistencia a la insulina relacionada con la obesidad. Por ello estos receptores son un objetivo para el control de la obesidad y la diabetes (9).
Por otro lado, existe una marcada necesidad de encontrar alternativas que contribuyan a mejorar los tratamientos para los signos y síntomas de enfermedades crónicas degenerativas (10). Con respecto a la obesidad (OB), diabetes mellitus tipo 2 (DM2) y síndrome metabólico (SM) son tres enfermedades no transmisibles (ENT) que comparten mecanismos de aparición y evolución que con frecuencia se van combinando sucesivamente y ocasionan complicaciones cardiovasculares (11). Las enfermedades cardiovasculares constituyen la mayoría de las muertes por ENT (17,9 millones cada año), seguidas del cáncer (9,0 millones), las enfermedades respiratorias (3,9 millones) y la diabetes (1,6 millones), a nivel mundial (12).En este sentido, vale la pena indagar más sobre los efectos terapéuticos de sustancias como la cafeína, la cual ha demostrado tener un impacto positivo en condiciones metabólicas derivadas de hábitos alimenticios inadecuados (13). Por ejemplo, un estudio realizado en 2012 sobre dos modelos distintos de obesidad inducida por la dieta (DIO) en ratas, consistió en proporcionar dieta alta en grasa a través de cebo de res y sacarosa. Se concluyó que la ingesta de cafeína a largo plazo previno el desarrollo de resistencia a la insulina y la hipertensión. De forma específica, la cafeína disminuyó el aumento del peso corporal y adiposidad visceral observada en ratas alimentadas con una dieta alta en grasas (14). De manera similar, en otro estudio se abordó el consumo crónico de cafeína frente a un modelo de dieta alta en grasa y alta en carbohidratos que indujo síntomas de SM. Se reportó una mejora en la tolerancia a la glucosa y sensibilidad a la insulina, anormalidades cardiovasculares y hepáticas atenuadas, así como una diminución del peso corporal y grasa abdominal (15).
Los modelos DIO, dietas altas en grasas y en carbohidratos, ocasionan variedad de alteraciones metabólicas a través del tiempo, que predisponen al desarrollo de enfermedades cardiovasculares y diabetes. Una de las características de la dieta occidental actual es el fácil acceso a toda variedad de alimentos entre ellos los ultra-procesados, altos en grasas saturadas y altos en azúcares refinados, es decir, la dieta actual se distingue por ser sabrosa y densa en calorías. La dieta de cafetería es una dieta reconocida como modelo inductor de síntomas de SM y OB en ratas, esta dieta es el modelo más cercano adaptado a la dieta occidental en humanos dotando de las mismas características y consecuencias de su consumo a los roedores (16,17). La dieta de cafetería permite a los roedores consumir alimentos con diversos sabores, texturas y diferente composición nutricional, en esencia, alimentos altamente palatables e hipercalóricos que provocan hiperfagia, tal como ocurre en humanos (18).
Esta investigación se propuso analizar los efectos de la administración crónica de cafeína en ratas alimentadas con dieta de cafetería, debido a la poca evidencia encontrada de tal sustancia respecto a una dieta con características propias de la dieta occidental. De forma específica, se buscó evaluar índices de consumo, antropométricos y bioquímicos.
Se utilizaron veinticuatro ratas macho adultas experimentalmente ingenuas de la cepa Wistar (8-9 semanas de edad) con un peso promedio de 300-320 g al inicio del experimento, provenientes del Bioterio del Instituto de Investigaciones en Comportamiento Alimentario y Nutrición (IICAN). El proyecto fue avalado por el Comité de Ética del Centro de Estudios e Investigaciones en Comportamiento, de la Universidad de Guadalajara (CUCBA/CEIC/CE/004/2020).
37.5 mg/kg de peso corporal de cafeína fue la dosis utilizada (19). La sustancia se utilizó de grado alimenticio (SHQ Suministros Herbolarios y Químicos, Estado de México) y se administró en un volumen de vehículo de 1ml, disuelta en solución salina (Solución Ht pisa®), al 9% por vía IP cada 24 hrs (19). Cinco días previos al experimento se manipuló a los roedores simulando la técnica de sujeción para la administración de cafeína, con el finde habituarlos al procedimiento y reducir el estrés (20).
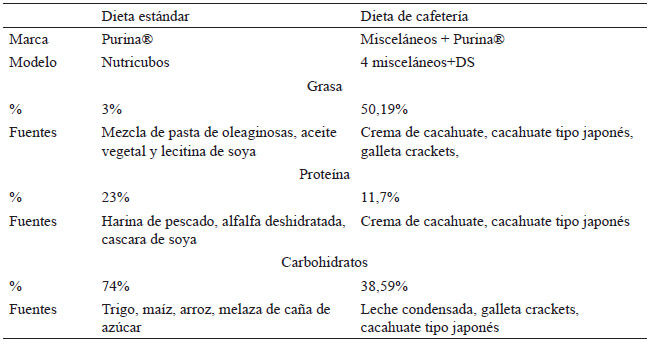
Modelo Nutricubos, fórmula diseñada para minimizar las variaciones de los estudios en roedores a largo plazo, proporcionando los nutrientes necesarios para el mantenimiento de los roedores (21). Composición: grasa (combinación de pasta de oleaginosas, aceite vegetal y lecitina de soya) 3%, proteínas (harina de pescado, alfalfa deshidratada, cascara de soya) 23% y carbohidratos (trigo, maíz, arroz, melaza de caña de azúcar) 74%. Aporte energético: 3,36 kcal/g.
La dieta se componía de dos partes, la primera; mezcla de cuatro alimentos misceláneos, es decir, productos encontrados en los supermercados con características de ultra-procesados, segunda; en menor proporción Nutricubos para roedores. Los alimentos misceláneos seleccionados para la dieta se adaptaron a los utilizados previamente en un estudio con ajustes en las proporciones (22). Alimentos misceláneos: crema de cacahuate, leche condensada, cacahuate estilo japonés y galletas sabor mantequilla. Composición de la dieta: grasa 50,19%, proteínas 11,7% y carbohidratos 38,59%. Aporte energético: 4,65 kcal/g. En la tabla 1 se desglosa la composición nutricional de los componentes de la dieta de cafetería.
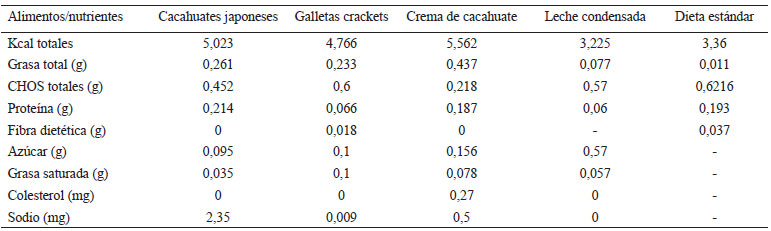
Preparación de dieta de cafetería. 100 g de mezcla de misceláneos: 30 g de crema de cacahuate, 26 g de leche condensada, 24 g de cacahuates estilo japonés y 20 g de galletas sabor mantequilla (23). Dichos alimentos se pesaron en báscula digital con pantalla LCD para cocina (acero inoxidable, EK3211, Amazon Basics), los ingredientes sólidos se procesaron por separado y posteriormente se homogenizaron junto con los ingredientes semilíquidos hasta formar una masa (24). Finalmente, la masa se pasó a moldes de silicón con espacios rectangulares para formar gránulos o croquetas de aproximadamente 18 g, se cubrió con plástico el molde y se refrigeraron 6 horas o hasta proveerla al roedor. En la tabla 2 se realiza una comparación nutricional de los componentes de la dieta estándar vs la dieta de cafetería.
La muestra de 24 machos Wistar se distribuyó bajo el método matched group design de acuerdo con el peso corporal en cuatro grupos de seis ratas cada uno. Las ratas estaban alojadas en jaulas de plástico a una temperatura (24 ± 2 ° C), con 55% de humedad, en ciclo de luz de 12 h/oscuridad 12 h (luces encendidas a las 08:00 h). A todas las ratas se les permitió el libre acceso a la dieta y agua antes de comenzar la fase experimental.
Caff/DC: Grupo experimental, 37,5 mg/kg cafeína vía IP + dieta de cafetería ad libitum
Caff/DS: Grupo experimental, 37,5 mg/kg cafeína vía IP + dieta estándar ad libitum
DC: Grupo control, solución salina al 0,9% vía IP + dieta de cafetería ad libitum
DS: Grupo control, solución salina al 0,9% vía IP + dieta estándar ad libitum
Transcurridas ocho semanas de exposición a la suplementación de cafeína y dieta respectiva, los roedores fueron sacrificados tras 12 horas de ayuno. Las ratas fueron sacrificadas rápidamente por decapitación bajo una breve narcosis de CO2 (Grupo INFRA®; Estado de México, México); inmediatamente se tomó la muestra de sangre mediante gravedad. Enseguida los sujetos fueron colocados en una mesa de disección para la extracción y pesaje del tejido adiposo.
Determinación de la ingesta de alimento (IA), porcentaje de ganancia de peso corporal (% GPC) y relación de eficiencia alimenticia (REA).
La ingesta de alimento, así como el consumo de agua se registró cada 24 horas por la mañana. El alimento restante se midió con una báscula de precisión, la dieta de cafetería cada vez se reemplazó por la mezcla de alimentos frescos.
La determinación del porcentaje de ganancia de peso corporal (% GPC) se calculó al final del período experimental, así como el índice de eficiencia alimentaria (REA), según el método de Chapman (23). Utilizando las siguientes ecuaciones:

El índice de eficiencia alimenticia se calculó de la siguiente manera:

Semanalmente, adicional al peso corporal, se midió la circunferencia abdominal y la longitud cráneo caudal con apoyo de una cinta métrica con precisión de 0.1 cm.
El índice de masa corporal se calculó con la siguiente fórmula (25):
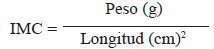
El tejido adiposo total se calculó con la suma de los pesos del tejido adiposo subcutáneo, visceral y epidimal tras su disección y extracción.
El índice de adiposidad (%) se calculó con la fórmula:
(tejido adiposo total/peso corporal final) x 100
Glucosa capilar y prueba de tolerancia a la glucosa (GTT)
La glucosa capilar se midió una vez a la semana luego de dos horas de ayuno (26), para ello se empleó un Glucómetro digital One Touch Ultra®(Provincia de Buenos Aires. Argentina), tiras reactivas y lancetas. La prueba de tolerancia a la glucosa se realizó al finalizar las ocho semanas de exposición. Las ratas fueron privadas de alimento por 12 hrs, permitiendo solamente el acceso a agua purificada. De la cola se tomó la glucosa basal y enseguida se administró una dosis de glucosa IP de 1 g/kg de peso corporal, mediante una solución preparada al 45% de glucosa (27). Las mediciones de glucosa en sangre se hicieron a los 30, 60, 90 y 120 minutos después de la administración de glucosa. El área bajo la curva se calculó tomando el eje x como base.
Durante el sacrificio se recolectó la muestra sanguínea en tubos de vacío KIMA Vacutest® y se incubó a 37°C durante 30 min. Posteriormente fue centrifugada por 10 min a 2500 rpm en un equipo Science Med modelo DM0412S. Enseguida se llevaron a cabo los análisis a través de la técnica de química seca (VITROS® 250 Ortho-Clinical Diagnostics) con apoyo de un equipo analizador automático y kits Micro Slides (VITROS®) específicos para cada parámetro (colesterol total, triglicéridos y fracciones de lipoproteínas); los mismos se realizaron en un laboratorio de análisis especializado.
El índice de riesgo aterogénico (%) se calculó a partir de los niveles de colesterol total y la fracción HDL, de acuerdo con la siguiente fórmula: IRA (%) = CT- HDL/ HDL.
Los resultados se expresan como la media ± desviación estándar (DE) y se evaluaron estadísticamente por análisis de varianza unidireccional (ANOVA) y la prueba post hoc de Tukey-B. Las diferencias se consideraron significativas con un valor de p <0,05. El análisis estadístico se realizó con el paquete de datos estadísticos SPSS 23,0 (IBM, Estados Unidos).
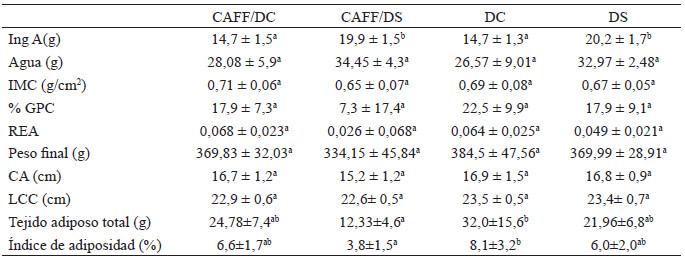
La ingesta de alimento promedio medido en gramos mostró diferencias significativas de acuerdo a la prueba post hoc, entre los sujetos experimentales Caff/DC (media 14,6496) y Caff/DS (media 19,9361), así como entre los grupos controles DC (media 14,7594) y DS (media 20,1405) (tabla 3). No obstante, en la figura 1(a) se ilustra el consumo en calorías donde en la semana uno la prueba Tukey-B arrojó diferencias significativas entre el grupo DC (media 88,7541) y el resto de los grupos con valores de medias inferiores. En cuanto al consumo de agua, en las semanas 4 (p<0,015), 6 (p<0,013) y 8 (p<0,05) se reportaron diferencias estadísticas, con un consumo menor en el grupo control alimentado con dieta de cafetería frente a los grupos experimental Caff/DS y control DS.
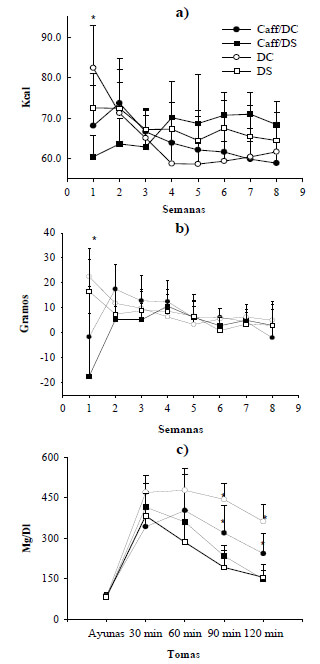
No se encontró significancia entre los resultados de los grupos para el índice de masa corporal, porcentaje de ganancia de peso y la eficiencia alimentaria, sin embargo, en la tabla 3 se observa que los grupos con tratamiento de cafeína reflejaron menor porcentaje de ganancia de peso final respecto a los grupos controles. Debido al peso corporal y la circunferencia abdominal semanal, la prueba ANOVA sugirió diferencias significativas entre los grupos en la semana tres (p<0,046 en el peso corporal y p<0,033 en la circunferencia abdominal). Al analizar el peso corporal final, el grupo CAFF/DS resultó ser estadísticamente inferior al resto de los grupos. Con relación a la evaluación de la longitud cráneo-caudal tras las ocho semanas del experimento también hubo diferencia estadística entre los grupos p<0,028.
El análisis semanal de ganancia de peso reflejó que los grupos experimentales Caff/DC y Caff/DS tuvieron un descenso de peso corporal luego de una semana de haber iniciado el experimento tal como se observa en la figura 1(b), sin embargo, a lo largo de la segunda semana se observó una recuperación, superando el peso corporal inicial. De forma contraria, los sujetos controles DC y DS en el transcurso de la primera semana aumentaron de peso y durante la segunda disminuyeron. A partir de la semana cinco ninguno de los grupos reportó importantes cambios en el peso corporal.
La glucosa postprandial promedio fue estadísticamente distinta entre el grupo control DC y los dos grupos experimentales Caff/DC y Caff/DS, los cuales reportaron este parámetro en niveles inferiores (tabla 4). Sin embargo, no se alcanzaron diferencias significativas entre los grupos respecto a la glucosa basal y glucosa a los 30 y 60 minutos en la prueba de tolerancia a la glucosa figura 1(c). Alusivo a las mediciones hechas a los 90 y 120 minutos es posible observar una diferencia estadística entre los roedores del grupo DC respecto a los grupos DS y CAFF/DS.

Entre los niveles de colesterol total, sus fracciones y los niveles de triglicéridos no existieron diferencias significativas entre grupos; no obstante, los grupos expuestos a dieta de cafetería presentaron los niveles más altos. El índice aterogénico fue significativamente menor (p<0,05) en los grupos sin exposición a la dieta de cafetería.
Respecto el tejido adiposo total e índice de adiposidad, se identificaron diferencias significativas (p<0,05) entre las medias de los sujetos de los grupos DC y Caff/DS.
La cafeína es una sustancia que se encuentra al alcance de todos en diferentes bebidas y es altamente consumida alrededor del mundo(28). En esta investigación fue de interés indagar en los efectos de la cafeína combinados con un modelo dietético específico, el cual, a grandes rasgos causa síntomas de SM relacionados con DM2, OB y enfermedad cardiovascular, padecimientos que comprometen cada vez más los sistemas de salud a nivel mundial (29). El objetivo fue evaluar parámetros biológicos y conductuales en roedores alimentados con un modelo de dieta de cafetería mientras se les administraba de forma crónica cafeína.
Al finalizar los dos meses de experimentación, los roedores intervenidos con cafeína, independientemente de la dieta, mostraron una longitud menor en comparación con sus controles. Respecto a la dieta de cafetería elaborada con alimentos misceláneos para los sujetos controles, esta tuvo consecuencias a nivel bioquímico con alteración en la glucosa postprandial, intolerancia a la glucosa a los 90 y 120 minutos de acuerdo al área bajo la curva de la prueba, así como cifras elevadas en las lipoproteínas VLDL y triglicéridos. Los síntomas asociados al SM causados al grupo control DC confirman la efectividad de la implementación del modelo DIO tras un periodo de ocho semanas. Otros estudios refieren adicionalmente anomalías en la glucosa plasmática, presión arterial sistólica, respuesta disminuida a la insulina y enfermedad hepática no alcohólica, luego de 13 semanas o más de implementar dietas altas en grasas y/o carbohidratos (27). Será necesario investigar los resultados de incluir la dieta de cafetería utilizada en este experimento durante un tiempo más prolongado, además de evaluar otras variables tales como presión arterial, resistencia a la insulina y daño hepático. Los grupos DC y Caff/DC también consumieron una menor cantidad de agua a partir de la segunda mitad del experimento, situación ya observada en modelos dietéticos alterados en grasas y carbohidratos (15). Los grupos Caff/DS y Caff/DC no mostraron diferencias en el promedio de ingesta energética a lo largo del experimento, de manera similar a lo observado en los antecedentes (30-31), por esa razón, se concluye que la cafeína no modificó los patrones de consumo y probablemente por ello no se reflejaron cambios antropométricos importantes (IMC, ganancia de peso, peso final y eficiencia alimentaria). Los efectos de la cafeína sobre la dieta de cafetería en este caso se observaron a nivel metabólico con glucosas postprandiales inferiores en los grupos Caff/DC y Caff/DS, de esta manera suponemos que los roedores Caff/DC no alteraron sus niveles de glucosa gracias a la administración de cafeína a pesar de llevar una dieta inadecuada, coincidiendo con resultados anteriores (15).
Al analizar semanalmente los resultados del experimento, se observó que a los siete días la cafeína generó un descenso del peso corporal en los sujetos con dicho tratamiento. No obstante, es interesante señalar que tal patrón se modificó tras unos días, puesto que la principal ganancia de peso corporal ocurrió durante la segunda semana en especial para el grupo Caff/DC, posteriormente se mantuvo poca variabilidad en el peso de los grupos hasta finalizar el experimento. El mismo comportamiento se observó en la ingestión energética. Las circunstancias anteriores demuestran que la administración de cafeína “aguda”, es decir al cabo de siete días, sin importar el tipo de dieta, ocasiona un descenso en el peso corporal y en el consumo de alimento, tal como se evidencia en otros estudios(30).En el presente trabajo, la administración crónica de cafeína a la par de una dieta de cafetería no manifestó modificaciones relevantes en el peso y la ingesta luego de dos meses. En algunos estudios se menciona que la autorregulación ejercida en la rata que le permite permanecer constante en el consumo de alimentos subsecuente a las primeras semanas de cambiar la dieta, hace parte de los complejos mecanismos de control homeostáticos propios de los roedores (32-33). Por otro lado, existen autores cuyos trabajos dieron como resultado que el efecto de la cafeína previno el aumento de peso corporal, mejoró los parámetros de las lipoproteínas así como removió almohadillas de grasa, en los roedores alimentados con dietas no adecuadas en macronutrimentos, sin embargo, en estos casos será necesario considerar las dosis, vías y modos de administración, así como el periodo de intervención con la sustancia (20, 34).
La dosis de cafeína utilizada en este trabajo se eligió a partir de evidencia publicada que demostró ser la dosis media efectiva en roedores con alteraciones en indicadores de la glucosa. 37,5 mg de cafeína/kg de peso corporal en ratas, que equivale a un consumo de 6mg de cafeína por kg de peso en humanos, es decir, un consumo de ~ 400 mg de cafeína por día o aproximadamente de 3 o 4 tazas de café al día (19). Un tema relevante de tomar en cuenta es la posible resistencia a la cafeína, por lo que se debe buscar conocer profundamente los mecanismos de acción para alargar los posibles efectos benéficos en condiciones como el síndrome metabólico.
En este estudio se trabajó con un modelo de dieta diseñado a partir de alimentos procesados y densamente calóricos, consumidos por la población occidental que tienen consecuencias negativas a la salud. Dicha dieta de cafetería se combinó con la administración crónica de cafeína. Se concluye que la cafeína permitió proteger los niveles de glucosa postprandial al término del experimento y un descenso en el peso corporal y consumo de alimento solo en la primera semana. Sin embargo, no se observaron mejoras significativas en el perfil de lípidos, adiposidad, tolerancia a la glucosa y glucosa plasmática.
Esta investigación fue apoyada por el Instituto de Investigaciones en Comportamiento Alimentario y Nutrición, Centro Universitario de Sur, Universidad de Guadalajara.
Todos los autores declaran que no existe conflicto de intereses.
Recibido: 14/06/2021
Aceptado: 10/12/2021