 ,
Lourdes Montserrat Hernández-Cortés1
,
Lourdes Montserrat Hernández-Cortés1  ,
Francisco Arenas-Huertero2
,
Francisco Arenas-Huertero2 
Las catequinas del té verde (Camellia sinensis) (CTV) presentan efectos benéficos para la salud asociados a su potencial antioxidante. Por otra parte, el estrés oxidante es una de las vías de inducción de daño genotóxico. De ahí que, en la presente revisión se realizó un análisis de los efectos antigenotóxicos y genotóxicos de las CTV, haciendo énfasis en las vías implicadas en estos procesos y sus efectos en la salud. Se realizó una revisión de artículos indexados en las bases de datos de PubMed® y Science Direct® (2021) con las palabras clave “green tea” y “green tea catechins”. Se delimitaron los estudios utilizando los operadores booleanos “AND”, “OR” y “NOT” (“antigenotoxic”, “genotoxic”, “antioxidant” y “prooxidant”). En su mayoría se consideraron las publicaciones del 2016 al 2021. Se observó que los efectos benéficos en la salud de las CTV están relacionados con: a) su actividad antioxidante mediante la captura, inhibición y prevención de la formación de las especies reactivas de oxígeno; b) la regulación del sistema antioxidante endógeno; c) la activación de los mecanismos de reparación al contribuir en la eliminación del aducto 8-hidroxi-2'-desoxiguanosina; d) la inducción de apoptosis en células con daño al ADN; y e) la inhibición de la inflamación relacionada con su actividad antiapoptótica. Si bien, en algunos de los estudios se reportaron efectos genotóxicos, estos a su vez contribuyeron en la eliminación de células con daño genético, por lo que, no se puede considerar del todo a la actividad genotóxica de las CTV como perjudiciales para la salud. Arch Latinoam Nutr 2022; 72(3): 205-217.
Palabras clave: catequinas, Té verde, Antioxidantes, Genotóxico, Antigenotóxico.
The green tea catechins (Camellia sinensis) (CTV) have beneficial effects for health associated with their antioxidant potential. Moreover, oxidative stress is one of the pathways for inducing genotoxic damage. Hence, in this review, an analysis of the antigenotoxic and genotoxic effects of CTV was carried out, emphasizing the pathways involved in these processes and their effects on health. A review of articles indexed in the PubMed® and ScienceDirect® (2021) databases with the keywords “green tea” and “green tea catechins” was carried out. Studies were delimited using the Boolean operators “AND”, “OR” and “NOT” (“antigenotoxic”, “genotoxic”, “antioxidant” and “prooxidant”). For the most part, publications from 2016 to 2021 were considered. It was observed that the beneficial health effects of CTVs are related to: a) their antioxidant activity through the capture, inhibition and prevention of the formation of reactive oxygen species; b) the regulation of the endogenous antioxidant system; c) the activation of the repair mechanisms by contributing to the elimination of the 8-hydroxy-2'-deoxyguanosine adduct; d) the induction of apoptosis in cells with DNA damage; and e) the inhibition of inflammation related to its antiapoptotic activity. Although some of the studies reported genotoxic effects, these in turn contributed to the elimination of cells with genetic damage. Therefore, the genotoxic activity of CTV cannot be considered as harmful to health. Arch Latinoam Nutr 2022; 72(3): 205-217.
Key words: cathechin, Green tea, Antioxidants, Genotoxic, Antigenotoxic.
https://doi.org/10.37527/2022.72.3.006
Autor para la correspondencia: María del Carmen García-Rodríguez, E-mail: [email protected]
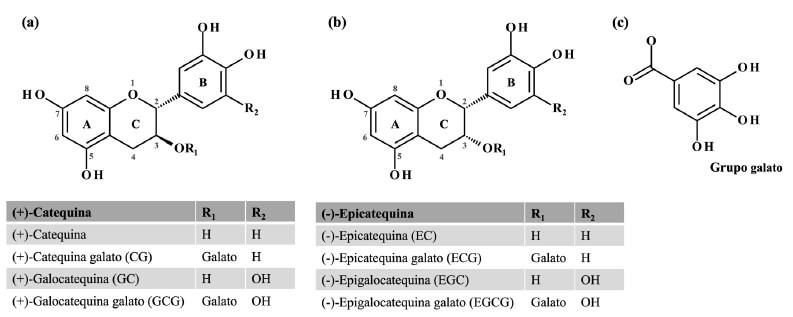
Al consumo del té verde (Camellia sinensis) se le ha asociado con efectos benéficos en la salud (1,2), mismos que, han sido atribuidos principalmente al potencial antioxidante de las catequinas (3). Las catequinas del té verde (CTV) han mostrado propiedades antinflamatorias, termogénicas, cardioprotectoras, hepatoprotectoras, entre otras (4). Se ha observado que estas, son capaces de interactuar directamente con las especies reactivas de oxígeno (ERO), además de actuar como agentes quelantes y tener efectos indirectos a través de su capacidad para modular niveles de factores de transcripción y enzimas (5). Los efectos benéficos de las CTV también se han observado en el contexto de la profilaxis y la terapia del cáncer mediante la respuesta antioxidante citoprotectora y su acción proapoptótica (6). Las catequinas que se encuentran de forma abundante en el té verde son la epicatequina (EC), epigalocatequina (EGC), epicatequina galato (ECG) y epigalocatequina galato (EGCG). Mientras que, la (+)-catequina, catequina galato, galatocatequina y galocatequina galato están en menor concentración (7,8) (Figura 1). El daño genotóxico es definido como la capacidad de un agente para interaccionar con el ADN o los componentes celulares que regulan la fidelidad del genoma (9). Se ha observado que patologías como el cáncer pueden ser iniciadas y promovidas por el daño genotóxico, por lo que es de interés estudiar agentes que inducen o protegen de este tipo de daño. Si bien, se ha observado en estudios in vitro e in vivo que las CTV pueden disminuir el daño genotóxico inducido por metales pesados, compuestos del tabaco o radiación (10), en otros estudios, también se ha observado que estas inducen efectos genotóxicos (11). De ahí que, en esta revisión se presenta un análisis tanto de los efectos antigenotóxicos, como de los genotóxicos de las CTV, haciendo énfasis en las vías implicadas en estos procesos y sus posibles efectos en la salud.
Se realizó una revisión sistemática siguiendo la metodología de PRISMA (12). La búsqueda de los artículos indexados se realizó en las bases de datos de PubMed® y Science Direct® (febrero a mayo del año 2021). Se utilizaron como palabras claves “green tea” y “green tea catechins”. Se obtuvieron 3,184 estudios sobre las CTV, a los que se les aplicó la combinación de la palabra clave “green tea catechins”, con las palabras clave “antigenotoxic”, “genotoxic”, “antioxidant” y “prooxidant”. Se redujeron a 2,173 artículos, que se les adicionaron las palabras clave “oxidative stress”, “DNA damage repair”, “apoptosis”, “endogenous antioxidant system” y “disease treatment”. Se realizó la misma búsqueda por separado añadiendo como palabras clave cada una de las catequinas (“catechin gallate”, “epicatechin”, “epicatechin gallate”, “epigallocatechin”, “epigallocatechin gallate”, “gallocatechin”, “gallocatechin gallate”). Se emplearon los operadores booleanos “AND”, “OR” y “NOT”, y se descartaron los artículos duplicados. Se seleccionaron 33 estudios potencialmente relevantes para la revisión. Finalmente, se aplicó un filtro de elegibilidad mediante la revisión del título, el resumen, la metodología y los criterios tanto de inclusión como de exclusión, obteniéndose 17 artículos para su análisis (Figura 2).
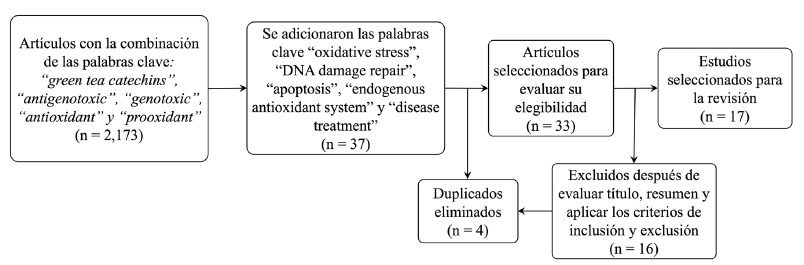
Los criterios de inclusión para los artículos fueron: a) publicaciones de los últimos 5 años (2016-2021), b) publicaciones originales (que utilizaron modelos in vivo e in vitro), y c) publicaciones sobre el té verde y sus catequinas, extractos de té verde o alguna de las catequinas que lo componen. Mientras que, en los criterios de exclusión, no se consideraron artículos de revisión, tesis, protocolos, resúmenes, libros y capítulos de libro. En la revisión final, en su mayoría se analizaron artículos originales de los últimos 5 años (2016-2021). Además de los 17 artículos seleccionados para su análisis, también se consideraron otros 13 artículos que complementaron el análisis y discusión del tema (9 anteriores y 4 posteriores al 2016). De estos 10 fueron referidos en los artículos seleccionados para el análisis (7 artículos de revisión y 3 artículos originales), y los otros 3 se incluyeron porque presentaban fundamentos e hipótesis que permitieron ampliar la discusión y complementar el análisis. Otros 11 artículos fueron incluidos en los fundamentos de la introducción.
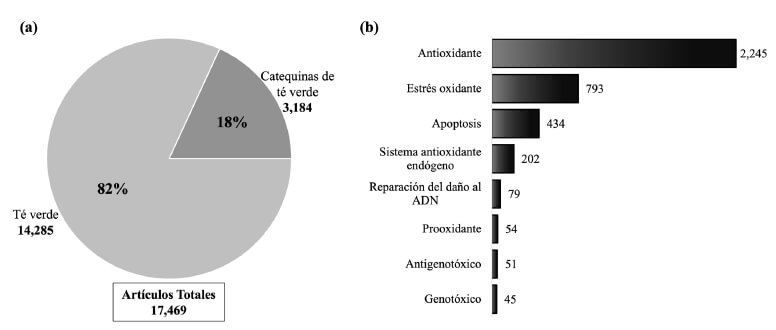
En la Figura 3a se muestra el número de artículos originales publicados en los últimos 5 años (2016-2021) en los que se consideró al té verde y sus catequinas. De los 17,469 estudios encontrados, el 82% correspondió a artículos originales sobre el té verde, mientras que el 18% correspondió a artículos originales sobre el estudio específico de las propiedades de las CTV: antioxidante, estrés oxidante, apoptosis, sistema antioxidante endógeno, reparación del daño al ADN, prooxidante, antigenotoxicidad y genotoxicidad de las CTV (Figura 3b). Se encontró que en algunos de los artículos se evaluaron varias de estas propiedades simultáneamente. En la Tabla 1 se muestra una síntesis de los 17 estudios seleccionados para la revisión. Se organizaron con respecto al tratamiento, tipo de estudio, modelo experimental, evaluaciones (parámetros cuantificados), resultados y actividad biológica. Los estudios correspondieron a tratamientos con EGCG, EGC, EC y (+)-catequina, así como con extractos de catequinas o infusión de té verde enriquecido con catequinas. En cuanto a los tipos de estudios el 83% fue in vivo y el 17% in vitro. En 13 trabajos se usaron roedores como modelo experimental, mientras que, en 3 estudios se emplearon células tumorales.
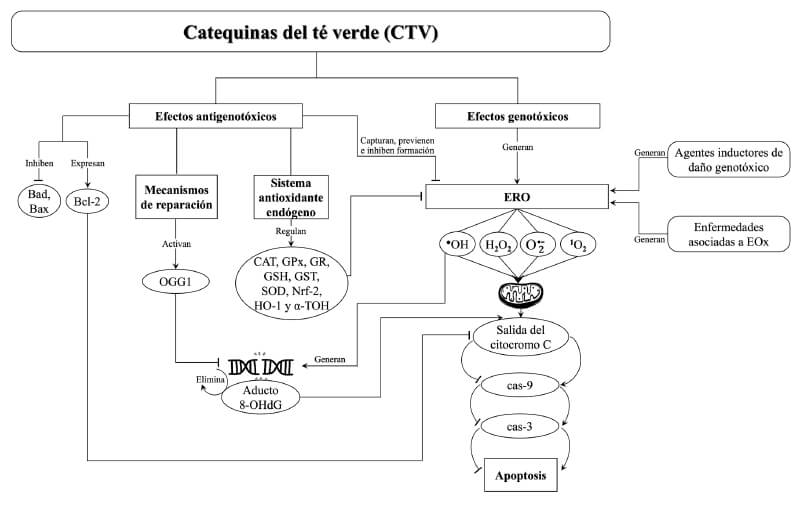
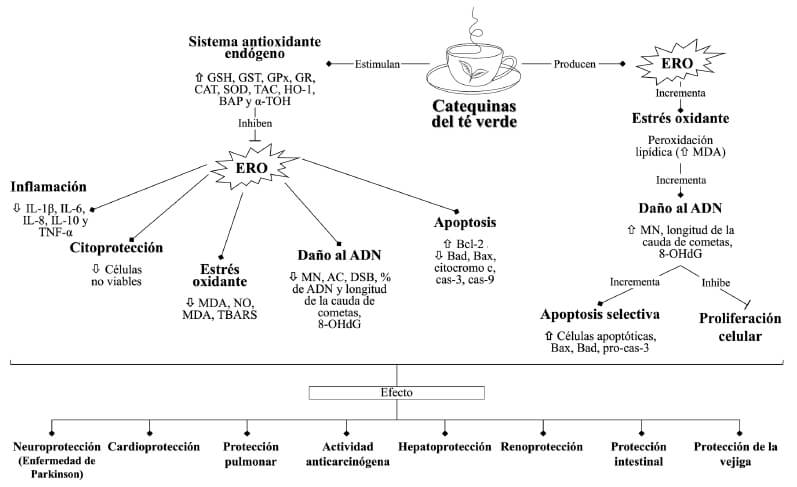
Las evaluaciones para determinar las diferentes actividades biológicas de las catequinas consistieron en: a) Efectos sobre el ADN (antigenotoxicidad y genotoxicidad); micronúcleos (MN), rompimientos de ADN mediante electroforesis unicelular alcalina (ensayo cometa) o cuantificación de células con rotura de cadena doble, contenido de ADN, escisión de ADN, aberraciones cromosómicas (AC) o fragmentación de ADN genómico realizado mediante electroforesis en gel de agarosa, así como los niveles del aducto 8-hidroxi-2'- desoxiguanosina (8-OHdG). b) Efecto sobre el estrés oxidante (EOx) (actividad antioxidante o prooxidante); niveles de malondialdehído (MDA), sustancias reactivas al ácido tiobarbitúrico (TBARS), mieloperoxidasa (MPO) y especies reactivas del oxígeno (ERO) [peróxido de hidrógeno (H2O2), radical superóxido (O2) o hidroxilo(OH)], óxido nítrico (NO), así como los niveles o la actividad de antioxidantes enzimáticos y no enzimáticos [glutatión reducido (GSH), glutatión oxidado (GSSG), glutatión peroxidasa (GPx), glutatión reductasa (GR), superóxido dismutasa (SOD), catalasa (CAT)], alfa-tocoferol (α-TOH), capacidad antioxidante total (TAC), niveles de hemoxigenasa (HO-1) y el factor de transcripción NRF-2 (regulador de genes de enzimas antioxidantes). c) Efecto sobre la apoptosis; cuantificación de células apoptóticas con fluorocromos, TUNEL, función mitocondrial, el contenido de ADN o la expresión de caspasa-3 (cas-3), caspasa-9 (cas-9), Bcl-2, Bax, Bad o citocromo c. d) Efecto sobre la actividad antinflamatoria; niveles de citocinas como el factor de necrosis tumoral alfa (TNF-α) e interleucinas (IL-1β, IL- 6, IL-8 e IL-10). Con base en el análisis de los procesos antigenotóxicos y genotóxicas de las CTV, así como de sus posibles interacciones, en la Figura 4 se presenta un resumen de las vías de inducción de antigenotoxicidad y genotoxicidad de las CTV.
Para el análisis y la discusión también se consideraron 8 artículos que contribuyeron en entendimiento de los mecanismos antioxidantes y prooxidantes de las CTV, así como su importancia y beneficios en la salud. Con otros 3 artículos se ampliaron los fundamentos del papel de los antioxidantes en el proceso de EOx y sus mecanismos antioxidantes. También se consideró un artículo para explicar los mecanismos genotóxicos de metales pesados como el arsénico (As) y cromo (Cr), y otro para explicar la formación e inhibición del aducto 8-OHdG. De estos artículos complementarios, 9 fueron artículos de revisión y 4 artículos originales.
Las CTV han mostrado efectos preventivos y terapéuticos en enfermedades relacionadas con el EOx, así como en algunos tipos de cáncer. Estos efectos benéficos en la salud han sido atribuidos principalmente a sus propiedades antioxidantes (29). La acción antioxidante no solo comprende la captura de las ERO, sino también previene su formación, inhibe su propagación y estimula los procesos de reparación celular. Las CTV también pueden actuar como agentes quelantes e inhibir o participar como cofactores de enzimas antioxidantes (30). Estos hallazgos han generado interés en el estudio de las CTV en la prevención y tratamiento (coadyuvante) de enfermedades crónico-degenerativas relacionadas con el EOx. Si bien las CTV presentan actividad antioxidante, también se ha reportado actividad prooxidante, y dado que al EOx se le ha relacionado con el daño genotóxico (31), en esta revisión se analizan los efectos antigenotóxicos y genotóxicos de las CTV, y se presenta una aproximación de las posibles vías implicadas en estos procesos (Figura 4).
La disminución del daño genotóxico de las CTV se ha observado en estudios tanto in vivo como in vitro. El tratamiento con los extractos o infusiones de té verde disminuye el daño genotóxico, ya que inhibe la fragmentación y el contenido de ADN, en ratas que presentan fibrogénesis hepática o nefropatía diabética inducidas por sobrecarga de hierro (13,14). Por su parte, tratamientos agudos y a corto plazo con EGCG disminuyen el daño genotóxico inducido por la exposición a metales pesados como los compuestos de arsénico (As) o del cromo (Cr) al disminuir los rompimientos de cadena doble en el ADN (8,15). Particularmente, Kaushal et al. (8) concluyeron que hay un efecto dosis-respuesta, y que los pretratamientos de EGCG muestran una mayor eficacia que los postratamientos, al observar en ratones expuestos a As una mayor disminución en las frecuencias de MN, AC, porcentaje de ADN y longitud de la cauda, estos últimos evaluados en cometas mediante electroforesis unicelular alcalina. Xie et al. (16) también han observado efectos antigenotóxicos tanto en estudios in vivo como in vitro, al disminuir las roturas de doble cadena y los niveles del aducto 8-OHdG en ratones y células epiteliales intestinales humanas (HIEC) expuestas a EGCG y radiación ionizante.
La protección contra el daño genotóxico que presentan las CTV podría estar relacionada con sus propiedades antioxidantes conferidas por la presencia de grupos hidroxilo (OH) que se encuentran en los anillos fenólicos de su estructura química (Figura 1). Los OH pueden neutralizar los RL al donarles un hidrógeno y terminar su reacción en cadena (8). Shi et al. (32) demostraron que la EGCG elimina eficazmente los radicales OH con una velocidad de reacción de 4,62 × 1011 M-1s- 1, que es un orden de magnitud mayor a la de varios antioxidantes reconocidos como el ascorbato, el GSH y la cisteína. Hakim et al. (33) observaron una reducción en los niveles del aducto 8-OHdG en estudios con fumadores que bebieron 4 tazas (960 ml) de té verde descafeinado al día durante 4 meses, atribuyendo este efecto a las catequinas. Estos hallazgos son importantes ya que sugieren una neutralización del OH que inhibe el daño genotóxico en estos fumadores. Los OH al interaccionar con la guanina (2-desoxiguanosina) producen la formación de los aductos 8-OHdG. Inicialmente, la reacción del OH con la guanina conduce a la generación del radical/ aducto C8-OH-desoxiguanosina, el cual forma al 8-OHdG por una abstracción de un electrón. El 8-OHdG sufre el tautomerismo “ceto-enol”, que favorece el producto oxidado 8-oxo-7,8-dihidro-2-desoxiguanosina (8-oxodG). La formación del aducto 8-OHdG es de particular importancia, ya que indica daño oxidativo al ADN y es un marcador de EOx en carcinogénesis (34,35). De ahí que, la estructura de las CTV puede jugar un papel muy importante en la protección del daño genotóxico.
Otra vía de protección de daño genotóxico puede estar relacionada con la regulación del sistema antioxidante endógeno. Cuando hay un desbalance en el sistema redox por efecto de las ERO, el sistema antioxidante endógeno permite la transformación de las especies reactivas en moléculas estables o las elimina. El mantenimiento de la homeostasis redox celular solo es posible mediante un equilibrio entre la intensidad de generación y la intensidad de eliminación de las ERO. Los tratamientos con extractos de té verde y EGCG en roedores han mostrado un efecto en general sobre el sistema antioxidante endógeno al elevar los niveles de TAC. Mientras que, los tratamientos con las CTV (catequinas y EGCG) pueden regular los niveles y actividades del GSH, CAT, GPx, GR, GST y SOD en roedores expuestos a diferentes xenobióticos (8,21,23). En esto estudios se ha observado que la regulación del sistema antioxidante endógeno está acompañada con la disminución del H2O2 y O2 (21). Estos hallazgos también se han observado en cardiomiocitos ventriculares humanos tratados con EGCG (25). La SOD puede catalizar una reacción de dismutación donde una molécula de O2 se oxida hasta O2, mientras que la otra se reduce a H2O2. Por su parte, la CAT y la GPx pueden catalizar la reducción del H2O2 a H2O y O2. En el caso de la GPx la reacción se lleva a cabo con ayuda del GSH, que es oxidado (GSSG) y posteriormente regresado a su estado original por la GR (30,35). La regulación de la respuesta antioxidante celular también se puede llevar a cabo mediante la activación de Nrf-2 que está implicado en la respuesta al EOx. Nrf2 tiene muchos genes diana, que regulan proteínas intracelulares implicadas en el equilibrio redox, como la glutamatocisteína ligasa y la GPx y la HO-1 (16,19). Los tratamientos tanto in vivo como in vitro con EGCG han mostrado incrementos en los niveles de Nrf-2 en tejido de vejiga y pulmón de ratas y en células HIEC (16,19,21). También, se ha observado que las CTV son capaces de suprimir la peroxidación lipídica, por medio de la disminución de los niveles de MDA o TBARS, protegiendo de esta manera a las membranas celulares (8,17,21).
La captura, prevención, formación e inhibición de las ERO son vías preventivas de daño oxidativo. Sin embargo, cuando estas primeras líneas de defensa no son suficientes y se produce daño oxidativo al ADN, interviene otra vía antigenotóxica; los mecanismos de reparación del ADN. En estudios in vitro se ha observado que polifenoles como el resveratrol incrementan la actividad de la 8-oxoguanina ADN glicosilasa 1 (OGG1) y de endonucleasas involucradas en los mecanismos de reparación por escisión de bases del daño oxidativo del ADN (36). Ho et al. (37) mostraron que la activación molecular de las adaptaciones citoprotectoras sensibles a redox y los cambios postraduccionales que afectan a OGG1 también pueden ocurrir in vivo como respuesta desde una dosis única hasta la ingesta regular de té verde, contribuyendo así con los efectos genoprotectores las CTV (29). La disminución de los aductos de 8-OHdG directamente en los tejidos y su incremento en los fluidos, puede ser indicativo de una activación de los mecanismos de reparación para la eliminación de esta lesión mutagénica en el ADN inducida por la acción del •OH.
Por otra parte, al ser la apoptosis una muerte celular programada que las células emplean como último recurso cuando se presenta una acumulación de daño en los organelos o en el ADN, esta vía también puede jugar un papel importante en la eliminación de células con daño genético. Se ha observado en líneas celulares de cáncer de mama, que los tratamientos con EC y ECG inducen apoptosis al aumentar la actividad de proteínas pro-apoptóticas Bad y Bax, las cuales inducen la salida del citocromo c y pro-cas-3. Un hallazgo interesante en estos estudios es que estas catequinas discriminan entre las células tumorales y las no tumorales, promoviendo la generación de ERO por encima del umbral crítico como vía de activación de la apoptosis (26,27). De ahí que, se ha planteado que la actividad prooxidante de las CTV puede ser un mecanismo importante implicado en sus propiedades anticarcinógenas mediante la apoptosis. De acuerdo con Farhan et al. (27), tanto la EC como la ECG presentan actividad prooxidante al incrementar los niveles de TBARS y la producción de ERO en células de cáncer de mama en las que se indujo la apoptosis. La actividad prooxidante de las CTV puede deberse a su autooxidación en condiciones fisiológicas normales de pH 7,4 y temperatura de 37 °C. También, en estudios in vitro se ha observado que, bajo estas condiciones, las catequinas no reaccionan con el H2O2, por el contrario, lo generan formando aductos covalentes con tioles proteicos y no proteicos (38,39). Catequinas como la EGCG se pueden convertir en o-quinona mediante la deshidrogenación no enzimática de los grupos hidroxilo fenólicos del anillo B (Figura 1b). Durante este proceso, se generan ERO como el oxígeno singulete (1O2), OH, O2 y H2O2 (40). La actividad prooxidante de las CTV también conlleva a efectos genotóxicos. En estudios in vitro se ha observado que las CTV pueden incrementar los rompimientos de ADN (ensayo cometa) y MN, así como incrementar la inducción de puentes nucleoplasmáticos de forma dosis-dependiente y que el tipo celular juega un papel importante (26–28). En particular, se comprobó que los rompimientos de ADN fueron el resultado de la generación de ERO, ya que la longitud de la cauda de los cometas disminuyó al tratar las células con SOD, CAT y tiourea, los cuales funcionaron como captadores selectivos de ERO, dado que SOD elimina el O2, CAT elimina el H2O2 y la tiourea elimina el OH (27). En un estudio in vivo, se observó que el tratamiento solo con EGCG aumenta los niveles del aducto 8-OHdG en comparación con el grupo testigo, sugiriendo que el aducto pudo producirse por la autooxidación de la EGCG. Sin embargo, cuando se administró la EGCG previamente al tratamiento con compuestos metálicos inductores de EOx, se disminuyeron los MN en comparación con el grupo tratado solo con el metal cancerígeno (15), lo cual podría estar relacionado con la selectividad celular que presentan estas catequinas.
En varios de los estudios se observó que los tratamientos de las CTV están asociados con procesos antinflamatorios, y dado que la inflamación es un factor que puede producir ERO (41), de forma indirecta se puede prevenir el daño oxidativo del ADN. Las CTV no solo reducen los procesos inflamatorios implicados en alteraciones médicas como la lesión miocárdica (20) y la reperfusión por isquemia hepática (22), también pueden reducir la inflamación por daño hepático crónico inducido por alcohol (23) y por el ácido perfluorodecanoico (PFDA) (17). En cardiomiocitos ventriculares humanos AC (17) suprime la inflamación inducida por el humo del cigarro (25), así como la generada por la rotenona en ratas con síntomas similares a la enfermedad de Parkinson (24). También se observó que disminuyen la inflamación causada por metales como el cadmio en ratas con daño renal (18). En estos estudios se midieron los niveles de citocinas proinflamatorias como la IL-1β, IL-6, IL-8, IL-10 y TNF-α, las cuales disminuyeron con los tratamientos de las CTV. En los estudios tanto in vivo como in vitro en células no tumorales, se mostró que las CTV además de disminuir los niveles de citocinas proinflamatorias también se disminuyen marcadores de EOx, se activan las vías antiapoptótica (aumento de la expresión de la proteína Bcl-2 y disminución de las proteínas Bad, Bax, cas-3, cas-9 y citocromo c) y se estimula el sistema antioxidante endógeno (17,18,20,22,25). De ahí que, la detención o disminución del proceso inflamatorio, puede ser clave en la inhibición del EOx y la apoptosis, que a su vez están implicados en el daño oxidativo del ADN.
De los estudios analizados un 71% fueron sobre la EGCG, la cual se ha descrito como la catequina de mayor potencial antioxidante. Su presencia en el té verde es de aproximadamente un 10% y el consumo (5-6 tazas de té verde al día) representa alrededor de 200 a 300 mg de EGCG. Esta dosis puede ser benéfica para mantener un buen estado de salud, incluso se ha observado que el consumo de 20 tazas de té verde por día no produce efectos secundarios evidentes (19,21). En los estudios analizados in vivo se emplearon dosis variadas entre 5 a 300 mg/ kg, mientras que in vitro las concentraciones empleadas oscilaron entre 2,2 a 350 μM. A pesar de estos estudios, aún no se ha establecido la dosis óptima terapéutica, por lo que aún faltan más estudios que incluyan su farmacocinética y farmacodinamia.
Como se pudo observar en esta revisión, el empleo de las CTV es de interés en la salud pública ya que pueden actuar como agentes preventivos y coadyuvantes en el tratamiento de enfermedades relacionadas con el EOx y el daño al ADN (7,10). Los hallazgos analizados en la presente revisión son de gran importancia, ya que una consecuencia de las lesiones persistentes en el ADN son las mutaciones, las cuales están implicadas en la etiopatogenia de enfermedades como algunos tipos de cáncer. En los estudios analizados, las CTV mostraron protección del daño al ADN inducido por la exposición a metales pesados como el cromo y el arsénico, así como a los efectos de la radiación ionizante (8,15,16). También se observó protección genotóxica en alteraciones médicas como la fibrogénesis hepática y la nefropatía diabética (13,14). Las CTV presentaron efectos terapéuticos en el tratamiento de enfermedades cardiovasculares (20,25), hepáticas (13,22,23), nefropatías (14,18), lesión intestinal (16), disfunción de la vejiga (19), enfermedad de Parkinson (24), cáncer de mama (26,27) y toxicidad pulmonar (21), mostrando además efectos sobre los procesos inflamatorios. En la Figura 5 se muestra la relación de los efectos genotóxicos y antigenotóxicos de las CTV con los beneficios en la salud con base en las posibles vías implicadas en estos procesos.
Los estudios que se están generando sobre las CTV son alentadores, ya que muestran una aproximación de las posibles vías implicadas en estos procesos. Sin embargo, aún es necesario ampliar los estudios encaminados a establecer las dosis óptimas. Con estos estudios, se podría obtener el conocimiento necesario para poder iniciar con intervenciones en grupos de pacientes y población en general. De manera similar, se podría confirmar la actividad antigenotóxica de las CTV en el tratamiento terapéutico de alteraciones relacionadas con el EOx y daño genético, así como en la quimioprevención de algunos tipos de cáncer.
Aunque las CTV tienen efectos antigenotóxicos, también pueden presentar efectos genotóxicos que contribuyen en la eliminación de células con daño genético. De ahí que, la actividad genotóxica de las CTV no se debe considerar del todo como perjudicial para la salud. Los efectos benéficos en la salud de las CTV están relacionados con: a) su actividad antioxidante mediante la captura, inhibición y prevención de formación de las ERO; b) la regulación del sistema antioxidante endógeno; c) la activación de los mecanismos de reparación al contribuir en la eliminación del aducto 8-OHdG; d) la inducción de apoptosis en células con daño al ADN; y e) la inhibición de la inflamación relacionada con su actividad antioxidante y antiapoptótica. De ahí que, el estudio de polifenoles como las CTV representa una opción en la prevención y como coadyuvante en el tratamiento de enfermedades crónico-degenerativas relacionadas con el EOx y con el daño genotóxico.
Este trabajo de revisión forma parte del proyecto PAPIIT-IN224719; IN216122 financiado por la Universidad Nacional Autónoma de México (UNAM), mediante la DGAPA-Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica.
Los autores no tienen conflictos de interés en el presente trabajo.
Recibido: 18/02/2022
Aceptado: 13/06/2022