 ,
Nataly D. Bernuy-Osorio1
,
Nataly D. Bernuy-Osorio1  ,
Otto Zea Mendoza1
,
Otto Zea Mendoza1  ,
Carlos Vílchez-Perales1
,
Carlos Vílchez-Perales1 
Introducción: La alimentación en la primera infancia influencia la instauración del tejido adiposo y el desarrollo de diversas patologías en la edad adulta. Objetivo: Evaluar la influencia del consumo de tres fuentes de ácidos grasos sobre parámetros sanguíneos y tejido adiposo en pollos recién eclosionados. Materiales y métodos: Se utilizaron 76 pollitos Cobb 500 distribuidos aleatoriamente en cuatro tratamientos, que fueron alimentados durante siete días con una de las cuatro dietas (T1: 97% Dieta basal (DB); T2: DB +3% de manteca vegetal parcialmente hidrogenada; T3: DB +3% de aceite de quinua y T4: DB +3% de aceite de pescado). Al finalizar, se evaluó en sangre glucosa, colesterol, triglicéridos y tamaño de adipocitos del tejido adiposo subcutáneo y visceral. Se aplicó ANOVA considerando 0,05 de significancia y en el caso de variables no distribuidas normalmente, se aplicó el test no paramétrico de Kruskal-Wallis mediante el programa R-Studio. Resultados: Se obtuvieron diferencias significativas con disminución de los niveles de glucosa y colesterol en animales suplementados con elevada proporción de aceites insaturados (T3 y T4) en comparación a T2. Los tratamientos T3 y T4 promovieron una formación hiperplásica de adipocitos, diferenciándose significativamente de T2, que promovió la hipertrofia en dichas células, esta respuesta fue similar en ambos depósitos subcutáneos. Conclusiones: El consumo de aceite de quinua y aceite de pescado promueve la formación de tejido adiposo saludable, y reducen los niveles de glucosa y colesterol. Contrariamente el consumo de manteca vegetal propicia la hipertrofia de adipocitos de gran tamaño e incrementa los parámetros bioquímicos evaluados. Arch Latinoam Nutr 2022; 72(4): 285-293.
Palabras clave: Aceite de quinua, aceite de pescado, ácidos grasos saturados, ácidos grasos poliinsaturados, adipocitos.
Introduction: Feeding in early childhood influences the establishment of adipose tissue, and therefore also in the development of various pathologies in adulthood. Objective: To evaluate the influence of the consumption of three sources of fatty acids on blood parameters and adipose tissue at an early age. Materials and methods: 76 Cobb 500 chicks randomly distributed in four treatments were used, who were fed for seven days with one of the four diets (T1: Basal diet; T2: DB +1.0% vegetable shortening partially hydrogenated; T3: DB +1.0% quinoa oil and DB +1.0% fish oil) until the seventh day of life. At the end, glucose, cholesterol, triglycerides and adipocyte size of the subcutaneous and visceral adipose tissue were evaluated. A completely randomized design with ANOVA considering 0.05 significance was applied and in the case of non-normally distributed variables, the non-parametric Kruskal-Wallis test was applied using the R-Studio program. Results: Significant differences were obtained with a decrease in glucose and cholesterol levels in animals supplemented with unsaturated oils (T3 and T4) compared to T2. Regarding the size of adipocytes, treatments T3 and T4 promoted a hyperplastic formation of adipocytes, differing significantly from T2, which promoted hypertrophy in these cells, this response was similar in both subcutaneous deposits. Conclusions: The consumption of quinoa oil and fish oil promote the formation of healthy adipose tissue, in addition to reducing glucose and cholesterol levels. In contrast, the consumption of vegetable shortening favors the hypertrophy of large adipocytes and increases the biochemical parameters evaluated. Arch Latinoam Nutr 2022; 72(4): 285-293.
Keywords: Quinoa oil, fish oils, saturated fatty acids, polyunsaturated fatty acids, adipocytes.
https://doi.org/10.37527/2022.72.4.006
Autor para la correspondencia: Ivonne M. Gutiérrez Zorrilla, E-mail: [email protected]
La obesidad es considerada un grave problema de salud pública a nivel mundial, que constituye junto con el sobrepeso, uno de los principales factores de riesgo metabólico que conllevarían al desarrollo de ECNT, cuyas siglas corresponden a enfermedades crónicas no transmisibles (1). Esta enfermedad no solo afecta a jóvenes y adultos, sino también a la población infantil, especialmente niños entre 5 y 9 años, en quienes se han evidenciado incrementos en la prevalencia de obesidad, que en el año 2014 alcanzó el 14,8%, habiendo para ese entonces duplicado su valor respecto al año 2008 (2). También se ha informado una prevalencia de obesidad en niños y adolescentes de hasta 20,0%; considerando la falta de actividad física y la adopción de una alimentación poco saludable, las causas principales para favorecer el desarrollo de la obesidad (3).
Se ha reportado que las regiones de mayor almacenamiento lipídico corresponden al tejido subcutáneo y al tejido adiposo visceral (4), e incluso se ha evidenciado que la adiposidad visceral está estrechamente relacionada con las anormalidades metabólicas e inflamatorias principalmente, incrementando así el riesgo de desarrollar ECNT (5,6). Además, diversas investigaciones demuestran la importancia de la formación saludable del tejido adiposo en los primeros años de vida, ya que de ello dependerá la cantidad de adipocitos formados en el organismo para la edad adulta y que repercutiría en el desarrollo de las patologías (7,8).
Por ello, es necesario la búsqueda de nuevos alimentos o la aplicación de componentes que favorezcan la instauración de un perfil lipídico saludable en el organismo; por lo que, se busca sustituir el tipo de ácido graso, es decir, los ácidos grasos saturados por insaturados, siendo los aceites una gran opción debido a su composición. Entre estos, el aceite de pescado es una fuente rica en ácidos grasos poliinsaturados y ampliamente usada como referente en estudios similares por su contenido de omega 3; sin embargo, es necesario conocer el efecto de otras fuentes alternativas de ácidos grasos insaturados como el aceite de quinua, que posee mayor contenido de omega 6 que omega 3, y de fuentes de consumo común como la manteca vegetal parcialmente hidrogenada como representante de fuente alta en ácidos grasos saturados. Por otro lado, los pollos de engorde Cobb 500 recién eclosionados constituyen el mejor modelo animal para esta investigación, puesto que estos animales depositan el exceso de grasa a nivel abdominal de modo similar al humano y poseen habilidad para ingerir alimento inmediatamente después de eclosionar.
En tanto, resulta interesante evaluar la influencia del consumo de tres fuentes de ácidos grasos (aceite de quinua, aceite de pescado y manteca vegetal parcialmente hidrogenada) sobre los niveles de glucosa y lípidos en sangre, y el tejido adiposo a temprana edad en un modelo animal.
El diseño de la investigación fue experimental, por lo que, en la investigación se utilizaron 76 pollitos machos de la Línea Cobb 500, recién eclosionados asignados al azar a los tratamientos y ubicados en una jaula especialmente acondicionada a 38 ºC y 75,0% HR durante el experimento.
Las fuentes utilizadas fueron Aceite de quinua, Aceite de pescado y Manteca vegetal parcialmente hidrogenada; debido a diferencias de ácidos grasos (AG) en su composición. Donde, el aceite de quinua fue extraído mediante fluidos supercríticos, utilizando 350 g de Quinua Pasankalla molida y tamizada, dióxido de carbono como disolvente, 250 bar de presión a 35°C/60 min; mientras que, el aceite de pescado proveniente del salmón y la manteca vegetal parcialmente hidrogenada fueron adquiridos del mercado local. Además, se determinó el perfil de AG de las fuentes estudiadas, mediante cromatografía de gases según lo recomendado por Michotte et al. (9); en tanto, se obtuvo una relación de AG saturados respecto a los insaturados (AGS/AGI) de 1:5, 1:4 y 1:1 para el aceite de quinua, aceite de pescado y manteca vegetal parcialmente hidrogenada; respectivamente (Tabla 1).
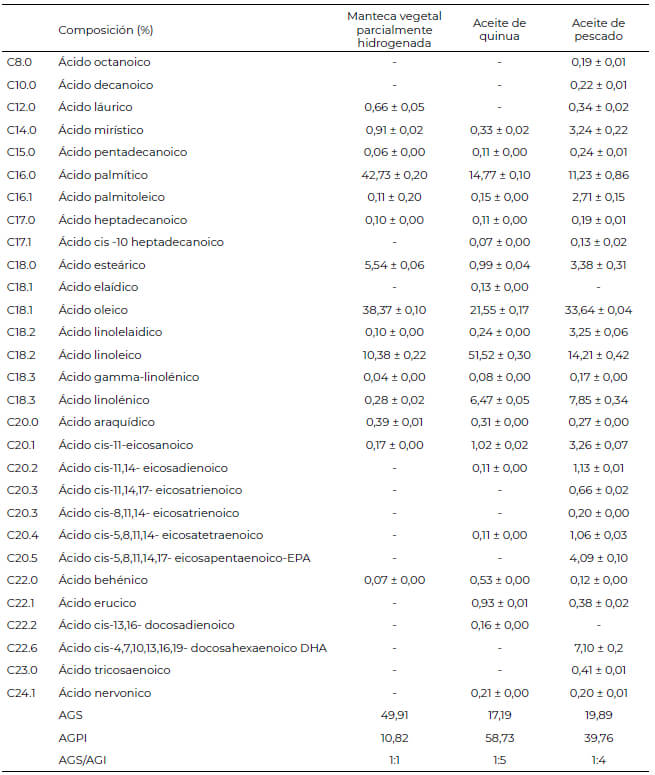
La dieta basal fue formulada según los requerimientos de la primera semana de vida de pollitos de la Línea Cobb 500 (2018), mediante el programa Space Animal Nutrition (Tabla 2). Mientras que, las dietas suplementadas con diferentes fuentes de AG fueron elaborados diariamente para reducir la oxidación y deterioro de los mismos.
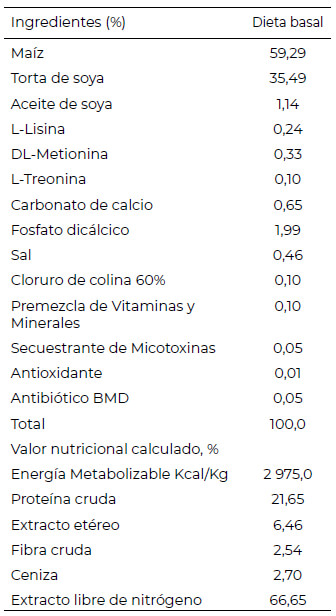
La duración de crianza de los animales fue de siete días y durante este tiempo, un grupo de 19 animales recibieron, ad libitum, una de las cuatro dietas experimentales (tratamientos, T) preparadas de la siguiente manera: T1, 97% de Dieta basal (DB) + 3% material inerte; T2, 97% de DB + 3% de manteca vegetal parcialmente hidrogenada; T3, 97% de DB + 3% de aceite de quinua, y T4, 97% de DB + 3% de aceite de pescado.
Culminado el periodo de experimentación, todos los animales fueron sometidos a aturdimiento para la extracción de muestras de sangre, y posteriormente sacrificados mediante dislocación cervical para la extracción de tejido adiposo, acciones que fueron realizadas por personal capacitado en dichas técnicas. Es necesario señalar que, el estudio fue aprobado por el Comité de Ética e Investigación de la Universidad Nacional Agraria La Molina, mediante el informe 002-2022-CEI-UNALM.
Durante el aturdimiento, el animal fue punzado en el cuello para obtener gotas de sangre que fue recogida mediante capilares, colocadas en las tiras reactivas y estas a su vez analizadas por el dispositivo On Call® Advanced para glucosa y Mission® Cholesterol Meter para determinar niveles de triglicéridos (TG) y colesterol total (10).
Constatada la muerte del animal, se procedió a abrir el abdomen con un bisturí para remover el tejido adiposo subcutáneo abdominal y el visceral (considerando la suma de grasa gonadal, mesentérica y retroperitoneal), ambos tejidos fueron lavados con suero fisiológico y secados con papel toalla.
Luego, ambas muestras fueron embebidas en formaldehído al 10,0% durante 24 horas, posterior a ello, cada tejido fue fijado y teñido con hematoxilina/ eosina según lo sugerido por Hollemans et al. (11), con algunas modificaciones. Obtenidas las láminas, se procedió a la lectura a través del software Leica Application Suite mediante el microscopio Leica modelo DM750 con cámara incorporada modelo ICC50W, utilizando el objetivo 20x y 40x para el deposito subcutáneo y visceral, respectivamente. De las vistas, los adipocitos fueron agrupados según su diámetro, como sigue: <25μm muy pequeño o escombros, 26-50μm pequeños, 51-90μm normales, 91-130μm grandes y >130μm muy grandes (12).
Se aplicaron separadamente pruebas de normalidad sobre las variables respuesta: glucosa, colesterol, triglicéridos y adipocitos. En el caso del colesterol y triglicéridos, cuyas distribuciones fueron aceptadas como normal, las comparaciones entre tratamientos se efectuaron aplicando un test de ANOVA; mientras que, para la glucosa y ambos depósitos subcutáneos, se aplicó el método no paramétrico de Kruskal-Wallis. En todos los casos se consideró un valor-P menor de 0,05 como estadísticamente significativo, mediante el programa estadístico R Studio 4.1.1 (2021).
No se observaron diferencias significativas entre los tratamientos en relación al consumo de alimentos, la ganancia de peso y la eficiencia alimentaria, lo cual evidencia que no hubo influencia sobre la palatabilidad de dieta, manteniéndose un adecuado crecimiento y desarrollo de animales.
Los niveles de glucosa, colesterol y triglicéridos fueron significativamente superiores para T2 respecto a los demás tratamientos, mientras que, las dietas T3 y T4 resultaron con valores similares al control (T1) en lo relativo a glucosa y colesterol. Se encontró además que, los niveles de triglicéridos de T3 y T4 fueron superiores al control (Tabla 3).
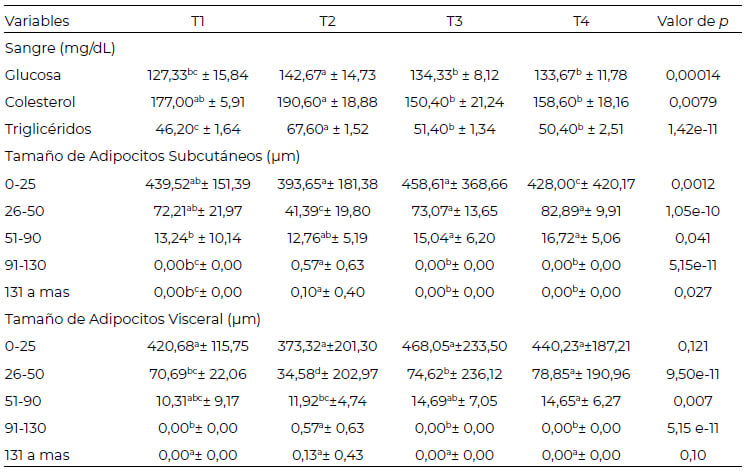
En referencia al depósito subcutáneo (Figura 1), tanto el consumo de T3 como de T4 promovieron un cambio en el tamaño de los adipocitos, dando lugar a la formación de mayor número de adipocitos pequeños y normales en comparación con T2. En contraste, los animales suplementados con T2 formaron mayor cantidad de adipocitos grandes y muy grandes en comparación a los demás tratamientos. Similar tendencia fue determinada en el tejido adiposo visceral (Figura 2), los valores obtenidos de ambos depósitos se muestran en la tabla 3.


La composición de AG presentes en la dieta influye sobre la formación de adipocitos en los depósitos subcutáneo y visceral, ya que los animales alimentados con dietas T3 y T4 evidenciaron hiperplasia, caracterizados por una mayor presencia de adipocitos de tamaños pequeños y normales; mientras que, el consumo de T2 produjo hipertrofia a favor de los adipocitos de tamaño grande y muy grande. Otras investigaciones realizadas en animales también obtuvieron similar respuesta en pollos alimentados con aceite de pescado y manteca (7), además de una menor deposición subcutánea y mesentérica demostrándose que los AG poliinsaturados y AG monoinsaturados (AGPI y AGM; respectivamente, tienen influencia sobre los depósitos de grasa (13- 15); esto podría deberse a cambios específicos en la expresión génica (16), donde los AGPI pueden promover la β-oxidación de los AG (17) e incrementar la actividad de las enzimas L-3-hidroxiacil-CoA deshidrogenasa (18) y la carnitina palmitoiltransferasa-I (19, 20). Además, los adipocitos pequeños (hasta 50μm) se relacionan con la posible presencia de adipocitos beige por su tamaño, presencia en el tejido adiposo blanco en el depósito subcutáneo, y formada probablemente a través de una transdiferenciación de adipocitos blancos existentes (21), lo que resultaría interesante ahondar en un próximo estudio.
En relación a humanos, la literatura ha reportado la correlación entre el consumo de dietas altas en AGS y el desarrollo de ECNT, ya que incrementan el almacenamiento de lípidos en el tejido adiposo desarrollando células de mayor tamaño y con mayor contenido de TG, esto promueve una mayor secreción de leptina y consecuentemente de macrófagos (IL-1β, IL-6 y TNF-α), generando la inflamación del tejido adiposo subcutáneo (22). Al respecto, se ha determinado que los AGPI omega-3 (EPA y DHA) derivados del aceite de pescado atenúan la actividad inflamatoria y reducen la lipogénesis en adipocitos humanos in vitro (23), además, se ha reportado que los AGM son capaces de reducir la adiposidad visceral (24),
El contenido de AGPI y AGM presentes en T3 y T4 redujeron los niveles sanguíneos de glucosa y colesterol. Esta respuesta favorable del consumo de aceite de quinua o aceite de pescado, estaría relacionado con su alto contenido de AGI respecto a los AGS, que han evidenciado ser capaces de reducir el contenido de colesterol total y la lipoproteína de baja densidad (LDL-C) en sangre, además de mejorar la sensibilidad de la insulina y la presión arterial (25, 26), incluso otros autores como Ibrahim et al. (27), sostienen que los AGPI reducen el colesterol en sangre siendo esto atribuible al perfil de ácidos grasos de la dieta.
Por el contrario, el consumo de AGS tiene una asociación positiva significativa con la resistencia a la insulina, la glicemia y niveles elevados de colesterol (28-31). Por otro lado, los niveles de triglicéridos superiores de animales alimentados con aceites (T3 y T4) en comparación al control, se debe a que la composición de AGI de los aceites, que promueven mayor liberación de AG libres de cadena media en el torrente sanguíneo incrementándose los valores de éste en sangre, lo que demuestra que el tipo de ácido graso consumidos influye sobre los lípidos plasmáticos (29).
La determinación de parámetros bioquímicos se realizó mediante dispositivos de prueba rápida utilizados en humanos, los cuales tienen rangos de medición específicos basados en fotometría de reflexión, debido a su bajo costo y fácil manejo. Asimismo, si bien el modelo animal utilizado acumula grasa en depósitos similares al humano, no es posible inferir dicha respuesta, pero si resulta necesario investigar más al respecto debido a los hallazgos obtenidos y su relación con la salud.
La ingesta de manteca vegetal parcialmente hidrogenada incrementa el perfil lipídico y promueve la hipertrofia en el tejido adiposo subcutáneo y visceral en pollos Cobb recién eclosionados, lo que generaría una alta predisposición a desarrollar obesidad u otras patologías en la edad adulta. Por el contrario, el consumo de aceite de quinua o aceite de pescado mantiene los niveles de glucosa, reduce el colesterol en sangre y promueve la hiperplasia de adipocitos en ambos depósitos; favoreciendo la instauración de un tejido adiposo saludable en la edad adulta.
Los autores agradecen al Programa Nacional de Investigación Científica y Estudios Avanzados por financiar la investigación a través del Contrato Nº 407-2019-PROCIENCIA.
Los autores expresan que no hay conflictos de intereses al redactar el manuscrito.
Recibido: 19/05/2022
Aceptado: 27/09/2022