 ,
Adriana Carolina Flores Gallegos1
,
Adriana Carolina Flores Gallegos1  ,
Rosa María Rodríguez Jasso1
,
Rosa María Rodríguez Jasso1  ,
Cristóbal Noe Aguilar González1
,
Cristóbal Noe Aguilar González1  ,
Liliana Serna Cock2
,
Liliana Serna Cock2 
Las barras de cereal (BC), se comercializan como un snack saludable, no obstante, su calidad nutricional es baja. Una alternativa para mejorar esto, es la incorporación de ingredientes como pseudocereales, germinados y subproductos de fruta. Objetivo. Evaluar el contenido nutricional y propiedades tecnofuncionales de una barra de cereal formulada a partir de pseudocereales, germinados de soya y subproductos del procesamiento de frutas. Materiales y Métodos. Se desarrollaron 6 formulaciones (F0-F5). Se determinó el contenido de proteína y fibra cruda, se seleccionó la formulación que presentó el mayor contenido de estos componentes. A la BC seleccionada se le determinó la digestibilidad in-vitro de la proteína, las propiedades tecnofuncionales potencial prebiótico y actividad inhibitoria de ECA-I. Resultados. La formulación seleccionada fue F1 (13,6 g/100 g p.s. proteína y 13,1 g/100 g p.s. fibra cruda). La digestibilidad de la proteína fue del 69 %, el cual es cercano a valores reportados para algunos componentes de la BC. La capacidad de hinchamiento y retención de agua fue 2,55 ml/g; 12,74 %, respectivamente. El crecimiento de L. brevis en medio MRS modificado con BC no presentó diferencias estadísticas con el medio control, indicando el potencial prebiótico presente en la BC. La barra de cereal tuvo un 39% de actividad inhibitoria de ECA-I, demostrando la acción de los compuestos bioactivos posiblemente liberados durante la digestión de la BC. Conclusión. La formulación desarrollada presenta propiedades funcionales importantes y podría generar beneficios para la salud. Arch Latinoam Nutr 2023; 73(1): 19-31.
Palabras clave: pseudocereal, barras, subproducto, alimento funcional, prebiótico, fibra.
Introduction. Cereal bars (CB) are marketed as a healthy snack; however, their nutritional quality is low. An alternative to improve this is the incorporation of ingredients such as soybean sprouts, which have a higher protein content than some seeds; as well as fruit by-products that contain important bioactive compounds. Objective. To evaluate the nutritional content and techno-functional properties of a cereal bar formulated from pseudocereals, soybean sprouts, and fruit processing by-products. Materials and Methods. 6 formulations (F0-F5) were developed. The content of protein and crude fiber was determined, the formulation that presented the highest content of these components was selected. The in-vitro digestibility of the protein, the technofunctional properties, potential prebiotic and inhibitory activity of ACE-I were determined for the selected BC. Results. The selected formulation was F1 (13.6g/100g p.s. protein and 13.1g/100 g p.s. crude fiber). Protein digestibility was 69%, which is close to reported values for some CB components. The swelling and water retention capacity was 2.55 ml/g; 12.74%, respectively. The growth of L. brevis in modified MRS medium with CB did not present statistical differences with the control medium, indicating the prebiotic potential present in CB. The cereal bar had 39% ACE-I inhibitory activity, demonstrating the action of bioactive compounds possibly released during CB digestion. Conclusion. The developed formulation has important functional properties and could generate health benefits. Arch Latinoam Nutr 2023; 73(1): 19-31.
Keywords: pseudo cereal, bars, by-product, functional food, prebiotic, fiber.
https://doi.org/10.37527/2023.73.1.003
Autor para la correspondencia: Cristóbal Noe Aguilar González, E-mail: [email protected]
Las barras de cereal son un alimento compuesto por múltiples ingredientes, principalmente cereales (trigo, maíz, avena, arroz), frutas, nueces y azúcar (sacarosa, glucosa y fructosa) (1,2). El mercado ofrece una amplia variedad de barras de cereal enfocadas en segmentos (3), algunas se comercializan como fuente de proteína, fibra o funcionales (4). Las BC formuladas con cereales como arroz, avena y maíz, tienen un bajo contenido proteico y carecen de un perfil de aminoácidos completo (5). Este contenido podría mejorarse con la incorporación de germinados de semillas o granos, así como otras fuentes con contenido de nutrientes superior (3,6).
La incorporación de ingredientes autóctonos, subproductos e ingredientes proteicos de bajo costo, ha mejorado a la calidad nutricional de las BC (3,7,8). A pesar de esto la industria se ha centrado en desarrollar productos teniendo más en cuenta las características organolépticas, técnicas y económicas, que nutricionales, y aquellas con calidad nutricional aceptable se comercializan a un precio muy elevado (9).
Los germinados considerados "súper alimentos" son el producto de la germinación de semillas o granos, estos presentan un mayor contenido de nutrientes (proteínas, lípidos, oligoelementos, vitaminas, minerales) y compuestos fenólicos; que los granos secos. Durante el proceso de germinación se multiplica el contenido de nutrientes y se favorece la digestibilidad (10); también se eliminan antinutrientes, como los inhibidores de enzimas en la semilla. De acuerdo con estudios realizados por Silva-Vega, M. et al., (2017) (11) el contenido de proteína en el germinado de las semillas es mayor (30,5 %) que el contenido en la harina de semilla (8,7 %), lo anterior establece la posibilidad de ser usado como materia prima en la alimentación humana y animal. La incorporación de germinados de soya (Glycine max. L) deshidratados en la BC podría contribuir con el contenido de proteína, mejorando así la calidad nutricional de la barra desarrolla. Por otra parte, la incorporación de subproductos de frutas es una alternativa para fortalecer la calidad nutricional de los alimentos, debido al contenido de compuestos bioactivos presentes en estos subproductos. El uso agrega valor a los subproductos, reduciendo así la contaminación ambiental y generando beneficios económicos (12).
La cáscara de granada (Punica granatum) representa el 40 % del peso de la fruta fresca, es considerada como un residuo, a pesar de que varios estudios han demostrado que es rica en polifenoles, especialmente elagitaninos, que son derivados del ácido elágico, ácidos hidroxibenzoicos y flavonoides, con notables actividades biológicas (13–16), por lo que podría usarse en el desarrollo de formulaciones alimentarias funcionales (17).
En la industrialización del mango (Mangifera caesia jack ex wall) se genera una importante cantidad de residuos. En el despulpado, los residuos equivalen entre el 36 - 60 % del peso del fruto fresco, tan solo la cáscara representa del 15 al 20 % del peso total de la fruta (18–20). Los principales compuestos bioactivos que se encuentran en la cáscara de mango son fibra dietética soluble (31 – 33 %), fibra dietética insoluble (32,1 – 34 %), polifenoles (93 – 96,2 mg/g de cáscara seca) y carotenoides (3092,2 μg / g de cáscara seca) (21–23).
La incorporación de pseudocereales como la quinua, amaranto y chía en BC, incrementa el contenido de proteína en comparación, con el uso de productos tradicionales como el arroz u otros cereales inflados (24,25), poseen un elevado índice de valor nutricional y biológico, superior al de los cereales con gluten (trigo, cebada, centeno, avena, y todas sus variedades e híbridos) tanto por su composición equilibrada de los aminoácidos que contienen sus proteínas (globulinas y albúminas), como por su biodisponibilidad o digestibilidad (26). Algunos estudios han revelado las propiedades funcionales de la quinua y el amaranto, incluidos sus efectos supresores sobre el aumento de la presión arterial (27–29).
Por lo anterior, el presente trabajo tiene como objetivo evaluar el contenido nutricional y propiedades tecnofuncionales de una barra de cereal formulada a partir de pseudocereales, germinados de soya y subproductos del procesamiento de frutas.
Todos los ingredientes fueron adquiridos en el mercado municipal de la ciudad de Saltillo, México. Los germinados de soya, fueron lavados y desinfectados (solución de hipoclorito de sodio (50 ppm) durante 5 min). Se escurrieron sobre toallas de papel; posteriormente fueron secadas a 37 °C durante 12 h en un deshidratador de alimentos eléctrico (Modelo 3926TCDB, Excalibur).
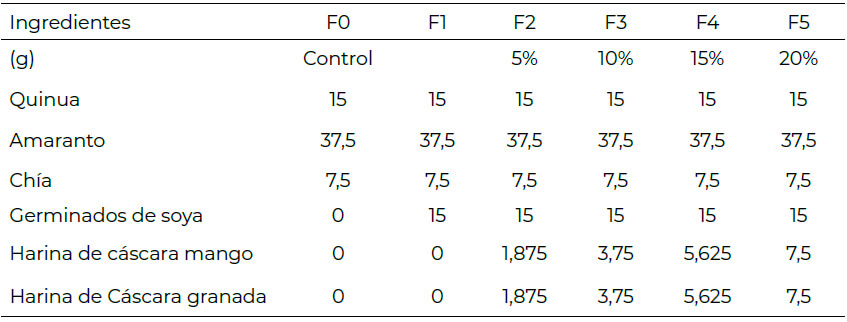
Las cáscaras de granada y mango fueron lavadas y desinfectadas, posteriormente secadas y pulverizadas (30). Se desarrollaron 6 formulaciones de barra de cereal, las cuales se indican en la Tabla 1. La proporción de ingredientes fue de 60 % para ingredientes secos y 40 % para aglutinantes (31). Se determinó el contenido de proteína y fibra cruda, se seleccionó la formulación que presentó el mayor contenido de estos componentes. A la BC seleccionada se le determinó la digestibilidad in vitro de la proteína, capacidad de retención de agua, capacidad de hinchamiento, potencial prebiótico y actividad inhibitoria de ECA-I.
La elaboración de las BC se realizó siguiendo la metodología descrita por Olivera et al., (2012) (31) con algunas modificaciones, en la figura 1 se puede observar el diagrama de flujo del proceso de elaboración de este producto.
Se realizó análisis bromatológico a todas las formulaciones de acuerdo con la metodología establecida por la AOAC (Humedad_ 925,09, cenizas 923,03, grasas 996,06, proteína 992, 23, fibra cruda 985, 29 (32–34).
Los carbohidratos se cuantificaron por diferencia, calculando la suma de gramos de agua, proteína, grasa, ceniza y energía (Kcal) con respecto a 100, esto puede observarse en la ecuación 1.
Ecuación 1.

La evaluación de la digestión de la proteína se realizó a la formulación que presentó el mayor contenido de proteína y fibra, siguiendo la metodología descrita por Minekus et al. (35).
El contenido de proteína total de la muestra digerida se determinó mediante el método del ácido bicinconínico (BCA), siguiendo las instrucciones del kit de proteínas (Sigma- Aldrich/BCA1 y B9643). Como estándar se utilizó albúmina de suero bovino, los resultados fueron expresados en mg/ml.
Se determinó de acuerdo con la metodología propuesta por Valencia et al. (2006) (36), con algunas modificaciones. La capacidad e hinchamiento (CH) (ml/g) se calculó mediante la ecuación 2. Donde V1 es volumen final de las muestras) y V0 es volumen inicial.
Ecuación 2.

Capacidad de retención de agua (CRA)
Se determinó de acuerdo con la metodología propuesta por Valencia et al., (2006) (36), con algunas modificaciones. La capacidad de retención de agua (CRA) se calculó mediante la ecuación 3. Donde P1 es peso final de la muestra y P0 es el peso inicial de la muestra.
Ecuación 3.
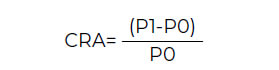
Determinación de la actividad inhibidora de la enzima convertidora de angiotensina-I (ECA)
Se usó como sustrato furanacriloil-Lfenilalanilglicilglicina (FAPGG). La cinética de la reacción se determinó en un tiempo de 30 min (37) y se usó placa de microtitulación de 96 pocillos.
Los ensayos para evaluar la inhibición de la ECA-I se realizaron a muestras de barra de cereal digerida. Se determinó usando N-[3-(2-furyl) acryloyl]-Phe-Gly-Gly (FAPGG) de acuerdo con el método descrito por Gonzalez-Gonzalez et al. (38) con algunas modificaciones. Como control positivo se usó una solución tampón A1 (Tris buffer 50 mM * HCl (pH 7,5) con 300 mM de NaCl). El control negativo (sin inhibidor) se usó HCl 6 M (39). El porcentaje de ECAI se calculó en relación con la pendiente generada cuando no estaba presente ningún inhibidor en la reacción (pendiente en blanco) de acuerdo con la siguiente ecuación 4.
Ecuación 4.
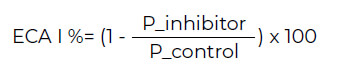
ECA-I % = Porcentaje de inhibición ECA, P inhibidor = pendiente del inhibidor, P control = pendiente del control
Para la evaluación del potencial prebiótico se seleccionó la formulación con mayor contenido de fibra y proteína. En este experimento se usó la bacteria probiótica Lactobacillus brevis WLP672. La cepa pertenece a la colección de cultivos del Departamento de Investigación en Alimentos de la Universidad Autónoma de Coahuila (Saltillo, México). El microorganismo se mantuvo conservado en medio MRS-glicerol a -80 °C.
Medio de cultivo y condiciones de crecimiento de Lactobacillus brevis
Los experimentos se realizaron en medio Man Rogosa Sharpe (MRS), el cual contenía (g/L): 4 g L-1 extracto de levadura, 10 g L-1 peptona, 8 g L-1 extracto de carne, 2 g L-1 de citrato de trimonio, 0,2 g L-1 sulfato de magnesio, 0, 005 g L-1 sulfato de manganeso, 2 g L-1 sulfato de potasio, 5 g L-1 acetato sodio, 1 ml/L de Tween 80 al 10%, pH 6, 5 (40). A este medio se le adicionó como fuente de carbono 20 g L-1 de glucosa y, 20 g L-1 de muestra de barra de cereal, como ensayos independientes. La glucosa corresponde al control positivo (mcMRS) y la muestra al tratamiento (mtMRS). Ambos medios fueron esterilizados en autoclave a 121°C por 20 min (41).
La cepa fue incubada en 5 ml de medio MRS a 37 °C por 24 h. Finalmente, el cultivo activado a una concentración de 104 unidades formadoras de colonias por mililitro (UFC/ml,) se inoculó (1 % v/v) en 5 ml de medio de cultivo mtMRS que contenía la muestra de BC (2 % p/v) descrita con anterioridad. Los cultivos se incubaron en condiciones anaeróbicas a 37 °C por un periodo de 48 h (41,42).
Se tomaron alícuotas de 100 μl a las 0, 24 y 48 h de incubación, se diluyeron con 900 μl de solución fisiológica estéril siguiendo protocolos estándar de dilución en serie. Después de que las bacterias se diluyeran, se sembraron en placa en agar MRS usando el método de microgota (43). El conteo de colonias se realizó después de la incubación durante 24 horas a 37 °C en condiciones anaerobias. Los recuentos en placa se realizaron por duplicado.
Todas las determinaciones presentadas se realizaron por triplicado. Se utilizó el software estadístico Info Stat (versión para estudiantes, 2018). Se obtuvo un ANOVA de una vía con post-test de Tukey para comparaciones entre muestras a un nivel de confianza del 95%. Los resultados se presentan como la media ± desviación estándar (DE).
Los resultados mostraron que el contenido de proteína fue afectado significativamente por el contenido de cereales, germinados de soya y cáscaras de frutas (p< 0,05) (Tabla 2). Los valores de proteína oscilaron entre 10,2 y 13,6 g/100g, donde F4 y F1 presentaron el mínimo y máximo valor, respectivamente. Esto se puede explicar debido a que la cantidad de proteína de un alimento está directamente relacionada con la cantidad y calidad de proteína de los ingredientes que la componen (25). Lo anterior, puede explicar por qué las formulaciones F3, F4, y F5 presentaron el más bajo contenido de proteína. Estos resultados son similares a los reportados por Rawat y Darappa (2015) (3), en barras energéticas horneada, donde los valores más bajos de proteína y digestión se encuentran en barras con mayor cantidad de ingredientes ricos en fibra. La formulación seleccionada fue F1 que contenía pseudocereales (quinua, amaranto, chía) y germinados de soya. Esta formulación fue la que presentó el mayor contenido de proteína y fibra (13,6g /100g p.s. proteína y 13,1 g/100 g p.s. fibra cruda). El contenido de ceniza fue de 2,1 AB ± 0,09 (g/100g). y de energía de la formulación seleccionada fue de 97,6 Kcal.
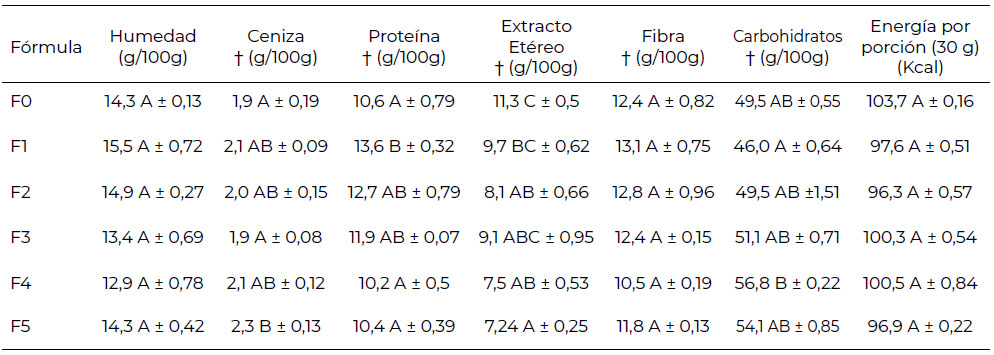
La digestibilidad in vitro de la proteína fue del 69 %. Este valor fue similar a lo reportado para germinados de soya, con un rango de valores entre 80,8 y 85,03 % (44,45) y para amaranto y quinua con valores correspondientes a 79,22 y 79,40 %, respectivamente.
La formulación F1 presentó una capacidad de hinchamiento de 2,55 ± 0,07 ml/g, valores similares a los reportados por Valencia et al. (36) quienes evaluaron concentrados de fibra dietaria y determinaron valores entre 2,3 – 3,4 g de ml /g p.s. La capacidad de hinchamiento de la formulación F1 es superior a lo reportado para la fibra de maíz, avena, trigo y arroz correspondientes a 0,65, 1,48, 1,27 y 0,54 ml/g muestra, respectivamente (46). Sin embargo, inferior a lo reportado para harina de grillo (3,9 ml/g)(47). García-Salcedo et al., (2018) (48), determinaron una capacidad de hinchamiento de la harina de chía de 11,82 mL/g, siendo significativamente alta en comparación con lo obtenido en este estudio.
La capacidad de retención de agua de la formulación F1 fue de 12,74 g/g, superior a productos como trigo, avena y manzana, que reportaron valores de 3,8, 3,9 y 4,1 g/g, respectivamente (49).
Actividad inhibitoria de la enzima convertidora de angiotensina I (ECA-I)
En la Tabla 3. se muestra el porcentaje de actividad inhibitoria de la enzima convertidora de angiotensina- I (ECA), encontrándose que para el control positivo -A1 (con inhibidor) el valor es de 0% indicando que la solución A1 favoreció la inhibición de la enzima, para el control negativo (sin inhibidor) el valor fue de 93 %, demostrando la acción de la enzima sobre péptidos sintéticos FAPGG y para la barra de cereal digerida el porcentaje fue de 39 % lo que demuestra que la BC digerida puede contener compuestos que promuevan la actividad inhibitoria de la ECA-I. Esta actividad principalmente se le atribuye a la quinoa y el amaranto, que en estudios realizados han demostrado actividad de inhibición de 23,3 y 8,8 %, respectivamente, valores altos comparados con lo reportado para cereales tradicionales como arroz y trigo (50).

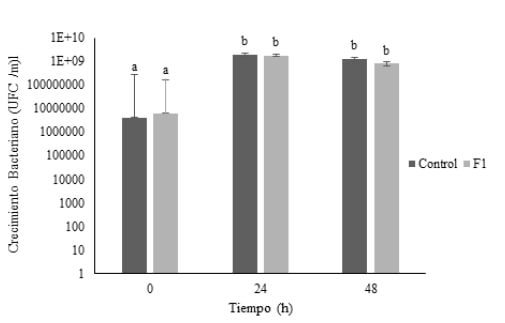
La determinación del potencial prebiótico solo se realizó a la formulación seleccionada (F1). El crecimiento de L. brevis en medio MRS suplementado con glucosa (control) y medio MRS suplementado con muestra de BC (F1), no presentó diferencias estadísticamente significativas (p> 0,05) entre los medios, para los tiempos evaluados 0, 24 y 48 horas, como se observa en la figura 2. Este resultado permite determinar que la formulación podría tener un efecto prebiótico, debido a que L. brevis es capaz de hacer uso de los componentes o ingredientes de la formulación como fuente de carbono e incrementar su población.
El contenido de proteína de F1 de 13,6 ± 0,32 g/100g, es similar a lo reportado por Márquez et al. (25) (tabla 4), quienes obtuvieron valores de proteína entre 10,65 – 15,88 %, para una barra de cereal, que combina salvado de avena, polvo de cáscara de piña y copos de quinua. Los valores más elevados correspondieron a los tratamientos con mayor contenido de copos de quinua. El uso de quinua inflada en barras alimenticias mejora el valor nutricional (contenido de proteínas) y funcional, en comparación, con el uso de productos tradicionales como el arroz u otros cereales inflados (2,25). La proteína de la quinua puede proporcionar a la barra de cereal una composición equilibrada de aminoácidos esenciales (globulinas y albúminas) similares a la composición aminoacídica de la caseína; éstas presentan alta biodisponibilidad y también contiene numerosos fitoquímicos como fitoesteroles, fenólicos, péptidos bioactivos (51).
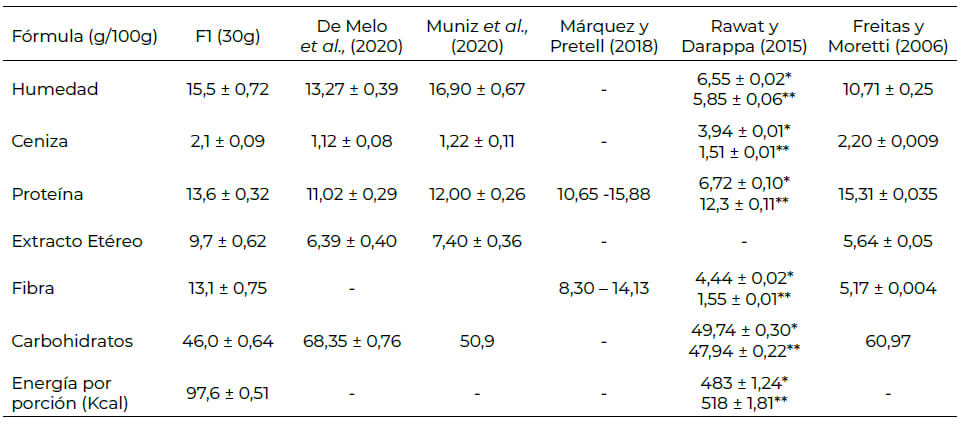
Por otra parte, Muniz et al. (12) evaluaron el contenido nutricional de barras de cereal y encontraron que todas las formulaciones enriquecidas con subproducto fermentado de Anacardium occidentale incrementaron un 12% el contenido de proteína con respecto al control (solo avena).
La incorporación de soya y sus derivados en barras de cereal, ha demostrado el incremento en el contenido de proteína. Freitas et al. (52) reportaron barras de cereal a base de proteína de soya texturizada, con contenido de 15,31% de proteína. De Melo et al. (53) reportaron valores de proteína de 11,02 %, para BC añadidas con 15 % de harina de tempeh.
En cuanto al contenido de fibra, de acuerdo con las recomendaciones de ingestión diaria de proteínas para la población mexicana, sugeridas por el Instituto Nacional de Ciencias Médicas y Nutrición “Salvador Zubirán”, la formulación F1 representa entre 13-14 % de las necesidades de proteína y de fibra el 22 % de un niño en edad escolar entre 5-10 años. Rawat et al. (3) desarrollaron una barra de cereal con una mezcla de ingredientes ricos en fibra (IRF), encontrando que la adición de IRF de 50% aumentó 9 veces el contenido de fibra en comparación con el control.
Las formulaciones de barra de cereal desarrolladas tuvieron un contenido de carbohidratos entre 46 y 56,8 g/100. Valores menores a los reportado para otras barras de cereal (entre 67,37 y 72,11 g 100 g–1) (4). Esta diferencia se debe principalmente a la presencia de glucosa de maíz y almidones, ingredientes usados comúnmente para la elaboración de barras de cereal. El valor energético estimado no presentó diferencias estadísticamente significativas entre las formulaciones desarrolladas (96,3 a 103,7 Kcal). El valor energético reportado en diferentes estudios es muy amplio (72,8 a 321,70 kcal.100 g–1), y depende de los componentes de la formulación (4,54,55).
Algunos estudios reportan contenidos de ceniza similares a los obtenidos en el presente estudio (entre 1,35 a 2,2 g/100 g) (31,52,56), pero con contenidos de fibra y proteína menores. Se ha reportado que, para barras de cereal compuestas por proteína de soya texturizada, germen de trigo tostado, avena integral, lecitina de soya, plátano deshidratado, presentan un importante contenido de fósforo (P) y calcio (Ca), con niveles compatibles con los encontrados en alimentos ricos en fósforo, y en calcio, como la leche entera (52). Debido a los componentes de la barra F1, se podría esperar que presente un contenido similar de minerales a las barras de cereal reportadas.
Este porcentaje de digestibilidad de la F1 es aceptable, si se tiene en cuenta la cantidad de proteína asimilable (proteína digestible), se encuentra entre el 70 y el 90 % (45). La digestibilidad de la proteína puede cambiar de acuerdo con los ingredientes y el procesamiento de la barra. Rawat et al. (3) indica 80,24 % de digestibilidad de proteína realizada por el método enzimático in vitro a barras energéticas horneadas.
Este parámetro indica que el alimento tiene una mayor capacidad de aumentar su volumen en un exceso de agua, por lo que podría provocar mayor saciedad y un aumento del bolo fecal. Además, valores altos de CH pueden deberse al alto contenido de fibra, que atrapan el agua formando una red. También la CH puede ser afectada positivamente por el contenido de proteínas que mejoran la retención de agua y la hinchazón posterior, traduciéndose en incremento del volumen absorbido de agua (48).
La CRA depende de la estructura de la proteína y de la presencia de carbohidratos hidrofílicos (57). La CRA de la quinua está entre 1,41 y 1,66 g/g (58). Algunas fuentes de fibra como el salvado de trigo, endospermo de semilla de tara y polvo de hojas de agave americana presentaron valores de CRA de 4,34, 47,9 y 7,6 g/g, respectivamente. Este parámetro es importante considerar en el procesamiento de alimentos, ya que determinan características que definen la calidad como volumen y textura. Es recomendable altos valores de capacidad de retención de agua para evitar pérdida de líquido e incrementar el rendimiento y rentabilidad de los productos alimentarios (59).
Estudios en pacientes hipertensos han informado que los péptidos presentes en las proteínas alimentarias son potentes fuentes naturales reductores de la presión sanguínea, razón por la cual la actividad inhibidora de la ECA generalmente se determina en hidrolizados de proteínas (60). La quinua y amaranto son los principales ingredientes de la formulación seleccionada (F1) en los cuales se han identificado diferentes péptidos que presentan actividad inhibidora de la enzima convertidora de angiotensina (ECA)(29). El amaranto contiene diferentes proteínas importantes que se componen de una extensa lista de péptidos antihipertensivos, estudios in vitro e in vivo han exhibido las propiedades antihipertensivas de estos péptidos bioactivos de semillas de amaranto de globulina 7S y 11S con diferentes proteasas (61).
Por su parte Fritz et al. (62) determinaron el porcentaje de inhibición in vitro de los aislados de proteína de amaranto mantegazzianus hidrolizados y no hidrolizados. Encontraron que los aislados de proteína no hidrolizados presentaron menores porcentajes de inhibición de la actividad ECA, frente a los hidrolizados, que tuvieron mayores porcentajes de inhibición lo que puede implicar una posible liberación local de péptidos bioactivos en el tracto gastrointestinal a través de la digestión de proteínas, aumentando el potencial inhibidor encontrado. Otros compuestos presentes en la formulación de barra de cereal desarrollada, que fueron identificados mediante HPLC, como el café oíl glucosa, han demostrado una correlación significativa en ensayos reportados de actividad anti-ECA (63).
La capacidad de metabolizar los diferentes sustratos depende de la cepa usada (64). Sin embargo, los resultados obtenidos en el presente trabajo son similares a los reportados por Vieira et al. (64), quienes evaluaron la capacidad de favorecer el crecimiento de cepas probióticas y no probióticas, utilizando los cultivos iniciadores comerciales de Lactobacillus spp., en ensayos de fermentación in vitro, en medio MRS modificado suplementado individualmente con 1% (p/v) de subproducto de mango, soya y harina de amaranto; éstos encontraron que las poblaciones de Lactobacillus no presentaron diferencias estadísticas (p> 0,05) y las cepas estudiadas mostraron un crecimiento relevante en las primeras 24 h de ensayo sin presentar diferencias estadísticas después de 48 h. No obstante, se presentaron diferencias estadísticas con el control negativo (mMRS no suplementado) en todos los tiempos evaluados.
Por su parte Koutrotsios et al. (42) evaluaron el crecimiento de aislados de las bacterias intestinales Lactobacillus acidophilus y Lactobacillus gasseri, utilizando como única fuente de carbono glucosa (control), polvo liofilizado de dos hongos comestibles/ medicinales el Pleurotus ostreatus y Ganoderma lucidum. No se encontraron diferencias significativas en los inóculos iniciales (t = 0) de cada una de las cepas bacterianas entre los sustratos analizados, para Lactobacillus el crecimiento bacteriano fue comparable con la glucosa en ambas cepas después de 24 horas de inhibición, luego de 48 horas se indujo un aumento significativo en los niveles bacterianos en comparación con la glucosa.
Los pseudocereales (amaranto, quinua, chía), germinados de soya y miel de agave poseen compuestos que pueden tener un potencial efecto prebiótico (65,66). Se considera que la miel de agave tiene un potencial efecto prebiótico, debido a su contenido de fructooligosacáridos (FOS), también conocidos como fructanos de tipo inulina, que son utilizados selectivamente y fermentados en el intestino humano (67).
Por otra parte, la fibra dietética promueve selectivamente el crecimiento y/o las actividades de los probióticos, así como la salud del huésped (68). Algunas fibras dietéticas, que están presentes en los pseudocereales tienen potencial para proporcionar efectos beneficiosos similares a los de los fructanos de tipo inulina (69).
Por su contenido nutricional los pseudocereales han sido considerados una fuente importante de fibra dietética con potencial para usarse en formulaciones de alimentos funcionales (66). Especialmente la quinua se considera fuente de fibra dietética (FD) (65). El contenido de fibra dietética total (FDT) del amaranto es de 19,5–49,3% de acuerdo con la variedad. El grano de amaranto está compuesto principalmente por xiloglucanos ramificados, la mayoría de las cadenas laterales de di y trisacáridos, así como polisacáridos, también contenía más del 25% de β- (1,3) -D-glucano insoluble en agua (65). El contenido de FDT de la chía está entre el al 37-40%, aunque algunos autores han reportado valores de hasta 59,8% de FDT. El mucílago de chía está constituido por azúcares neutros, lo que indica la presencia de diversos carbohidratos en su estructura (65).
La barra de cereal desarrollada presenta un contenido balanceado de nutrientes, mayor contenido de proteína y fibra, que las formulaciones tradicionales. Sus características tecnológicas, permiten considerar que esta formulación puede ser un alimento funcional. Al ser consumido podría aportar un contenido importante de macronutrientes. Por su capacidad de hinchamiento y retención de agua, podría generar una sensación de saciedad, así como prevenir el estreñimiento al incrementar el peso de las heces y al reducir la duración del tránsito intestinal. La formulación desarrollada tiene una adecuada digestibilidad. Podría contribuir a mejorar la salud intestinal, favoreciendo el crecimiento de bacterias prebióticas. De acuerdo con los resultados es posible que el consumo de la barra desarrollada tenga efecto positivo frente a la actividad inhibitoria de la enzima convertidora de angiotensina I (ECA-I), sin embargo, es necesario realizar otros estudios que permitan confirmar estos beneficios.
El desarrollo de productos a partir de pseudocereales y subproductos de frutas puede ayudar a promover su consumo y permite revalorar estos granos ancestrales, al igual que los subproductos del procesamiento de frutas.
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología (CONACYT) de México y al posgrado en Ciencia y Tecnología de Alimentos de la Universidad Autónoma de Coahuila. Este financiamiento se realizó mediante la concesión de una beca de posgrado al estudiante Jorge Eduardo Angulo López, con número de beca / CVU 945769 para la finalización de sus estudios de maestría.
Los autores declaran que no existe conflicto de interés.
Recibido: 22/06/2022
Aceptado: 13/02/2023