La leche materna donada es un recurso de alto valor que puede ser utilizado para la alimentación de neonatos hospitalizados y a término, por tanto, garantizar su inocuidad es imperativo. Esta revisión de literatura reúne los principales peligros de naturaleza física, química y microbiológica identificados en leche materna, con la intención de proveer una referencia que los consolide de tal forma que la información pueda ser utilizada por bancos de leche humana, gobiernos y agencias regulatorias para establecer mecanismos para su prevención y control. Se realizó una revisión de literatura entre agosto del 2021 y octubre del 2022, utilizando buscadores y descriptores específicos para peligros de transmisión alimentaria en leche materna. Se incluyeron estudios publicados en español o en inglés. Se identificaron 31 agentes biológicos patógenos incluyendo bacterias, virus y parásitos. Como peligros químicos se reportaron medicamentos, drogas, cafeína, infusiones herbales, micotoxinas, alérgenos, especias, suplementos nutricionales, contaminantes ambientales y desinfectantes. Se alerta sobre la presencia potencial de plástico y vidrio de tamaño menor a 7 mm proveniente del ambiente de extracción y recipientes. La presencia de peligros microbiológicos y químicos en leche materna puede darse por transmisión vertical, temperaturas inadecuadas durante el almacenamiento y contaminación en el proceso. La presencia de peligros físicos se relaciona con la manipulación de los implementos en etapas posteriores a la extracción. Se requiere prestar atención a los hábitos de la madre para prevenir peligros químicos, así como más investigación relacionada con micotoxinas en leche materna. Arch Latinoam Nutr 2023; 73(1): 42-59.
Palabras clave: Leche humana, enfermedad transmitida por los alimentos, inocuidad de los alimentos.
Donated breast milk is a highvalue resource which can be used to feed hospitalized neonates and full-term infants, therefore, ensuring its safety is imperative. This literature review presents the main hazards of physical, chemical and microbiological nature identified in human milk, with the intention of providing a reference that consolidates the reported hazards reported, so the information can be used by human milk banks, governments and regulatory agencies to establish prevention and control mechanisms. A literature review was carried out between August 2021 and October 2022, using search engines and specific descriptors for foodborne hazards in breast milk. Studies published in Spanish and English were considered. 31 pathogenic biological agents including bacteria, viruses and parasites were identified. Medications, drugs, caffeine, herbal infusions, mycotoxins, allergens, spices, nutritional supplements, contaminants of environmental origin and disinfectants were reported as chemical hazards. No physical hazards were identified, however the potential presence of plastic and glass smaller than 7 mm from the extraction environment or containers is alerted. Presence of microbiological and chemical hazards can be due to vertical transmission, inadequate temperature of storing, contamination during extraction, packaging, and infant feeding. Whereas presence of physical hazards is related to implements handling after extraction. Attention to hygiene and habits of the mother to prevent chemical hazards and further research related to mycotoxins in human milk is required. Arch Latinoam Nutr 2023; 73(1): 42-59.
Keywords: Human milk, foodborne disease, food safety.
https://doi.org/10.37527/2023.73.1.005
Autor para la correspondencia: Diana Víquez Barrantes, E-mail: [email protected]
La leche materna es un alimento único debido al aporte nutricional que provee al infante y al contenido de compuestos bioactivos como inmunoglobulinas, enzimas y hormonas. Brinda protección contra infecciones y participa en el desarrollo del sistema inmune, digestivo y neurológico del niño, haciéndola esencial para el infante (1-6).
Cuando la leche de la propia madre no está disponible o es contraindicada, la primera opción de alimentación debe ser leche humana inocua, proveniente de madres donadoras sanas (7). En los Bancos de Leche Humana (BLH) alrededor del mundo se recibe leche humana de donadoras aprobadas, reconocidas como sanas, y en la mayoría de los países, se pasteuriza el fluido antes de ser distribuido a los diferentes centros médicos (8-11).
La leche materna es requerida por infantes en término y prematuros. También, se han reconocido los beneficios en Unidades de Cuidados Intensivos (UCI), dado que, por su composición nutricional, la leche materna protege contra enfermedades comunes adquiridas en UCI, asociándose también con una salida temprana y una disminución de las tasas de readmisión en infantes pretérmino (12).
Para el funcionamiento de un BLH se recomienda la implementación de un sistema basado en las Buenas Prácticas de Manufactura (BPM) y el Análisis de Peligros y Control de Puntos Críticos (HACCP por sus siglas en inglés), con el propósito de asegurar la inocuidad de la leche humana donada (13- 17).
La base de un sistema HACCP es una valoración del riesgo asociado con los peligros en las distintas etapas del proceso, que contempla además acciones como definición de puntos críticos de control, monitoreo y verificación (18). El término peligro se define como “un agente biológico, químico o físico presente en el alimento que puede causar un efecto adverso para la salud” (19). Existe evidencia de que las BPM, los procedimientos estandarizados y el análisis de peligros, son necesarios en los BLH para controlar y reducir los riesgos asociados con el uso de leche materna para infantes pretérmino o con enfermedades (20). La implementación de estos sistemas en BLH generan más confianza en el procesamiento y una gestión de riesgos que permite el aseguramiento de la inocuidad (18).
El objetivo de esta revisión es documentar los posibles peligros físicos, químicos y microbiológicos a considerar para leche humana, con un especial enfasis en leche humana donada para uso en BLH, como base para el control de su inocuidad.
La revisión de literatura se realizó en el período comprendido entre agosto del 2021 y octubre del 2022. Se revisaron artículos publicados que reportaron la presencia de agentes biológicos causantes de enfermedad en leche materna o casos de pacientes con afecciones a su salud confirmadas producto de la ingesta de leche materna contaminada, contaminantes químicos, tanto por exposición de la mujer donante como por contacto directo de la leche, y cuerpos extraños que puedan estar presentes en leche materna y causar daño al consumirla.
La revisión bibliográfica se realizó utilizando el buscador académico Google Scholar y las bases de datos PubMed, Science Direct y Scopus. Las referencias seleccionadas, si bien datan de 1981 a 2022, no se delimitan a un periodo de tiempo específico sino a su vinculación con la temática. Se recopilaron un total de 159 publicaciones, de las cuales 39 se descartaron con base en los criterios establecidos de inclusión y exclusión. Del total de trabajos incluidos en la presente revisión (120), 56 correspondieron a estudios relacionados con peligros microbiológicos, 37 con peligros químicos y 7 con peligros físicos. Para la selección de los estudios, se contemplaron algunos criterios de inclusión tales como, publicaciones en idioma español o inglés y al menos 30% de las referencias publicadas en los últimos cinco años. Se priorizaron investigaciones sobre casos confirmados de brotes de enfermedad transmitida por consumo de leche contaminada con microorganismos patógenos (agentes biológicos), detección de contaminantes químicos y presencia de cuerpos extraños en leche materna contaminada.
La estrategia de búsqueda se realizó utilizando combinaciones de términos relacionados con la inocuidad de leche materna, tales como: “pathogens in breastmilk” “breastmilk safety”, “breastmilk HACCP”, “chemical hazards in human milk”, “drugs in breastmilk”, “human milk bank guidelines” “allergens in breastmilk”, “mycotoxins in breastmilk, “physical hazards in human milk”, “hard or sharp objects in breastmilk”, “choking hazard in breastmilk”, y “glass or plastic hazards in breastmilk”.
Se excluyeron las publicaciones en las que se reporta el efecto de la leche materna contra algunos agentes patógenos, como por ejemplo parásitos de origen alimentario y aquellos que no evidenciaban la presencia del agente causante de enfermedad en el fluido de interés como tal. No se consideró la probabilidad de ocurrencia ni la severidad de la presencia, resultando en la lista completa de los peligros identificados. Asimismo, no se hizo una distinción entre los peligros con mayor severidad, considerando el estado de salud ni edad del lactante, ni tampoco el uso posterior de la leche extraída por ejemplo para uso domiciliar en la alimentación de hijos propios y sanos contra el uso del fluido en unidades de cuidados intensivos neonatales en hospitales.
Se incluyeron los peligros microbiológicos y químicos que pueden ser transferidos de la madre al neonato por medio de la leche materna, lo que se conoce como transmisión vertical, por alimentación directa o posterior a la extracción de la leche, así como los peligros microbiológicos, químicos y físicos que pueden ser introducidos posterior a la extracción del fluido. Algunos peligros microbiológicos y químicos son reportados a través de casos clínicos o estudios epidemiológicos.
Con respecto a los peligros químicos, se priorizó en los medicamentos y drogas incluidos en los cuestionarios de selección de donadoras para bancos de leche humana, donde cualquier ingesta del medicamento o droga representaba una exclusión para donar.
Para peligros físicos se revisaron las recomendaciones de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA por sus siglas en inglés) para industria alimentaria debido a que en ese contexto se reconoce la importancia de la identificación de este peligro en alimentos dirigidos a poblaciones susceptibles (21). Adicionalmente, con el objetivo de identificar los tipos de peligros físicos se revisó la norma Codex Alimentarius Principios Generales de Higiene de los Alimentos CXC 1-1969.
En la Figura 1 se detallan algunos ejemplos de posibles fuentes de introducción de peligros microbiológicos, químicos y físicos durante las etapas de extracción y manejo de leche materna extraída (LME).
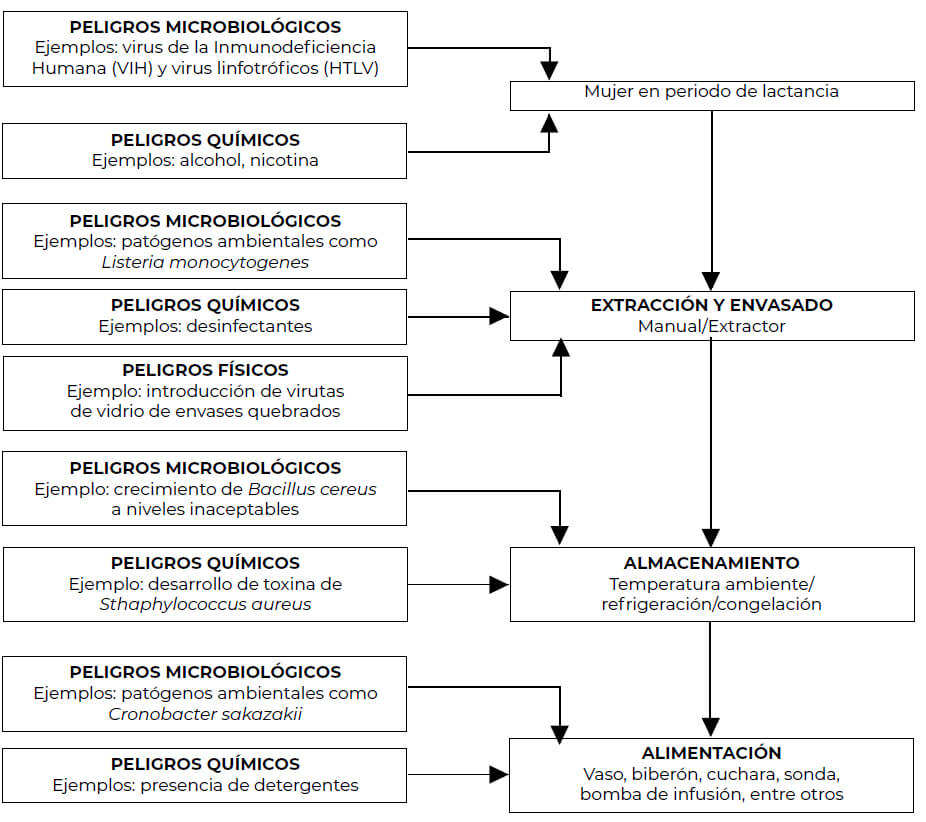
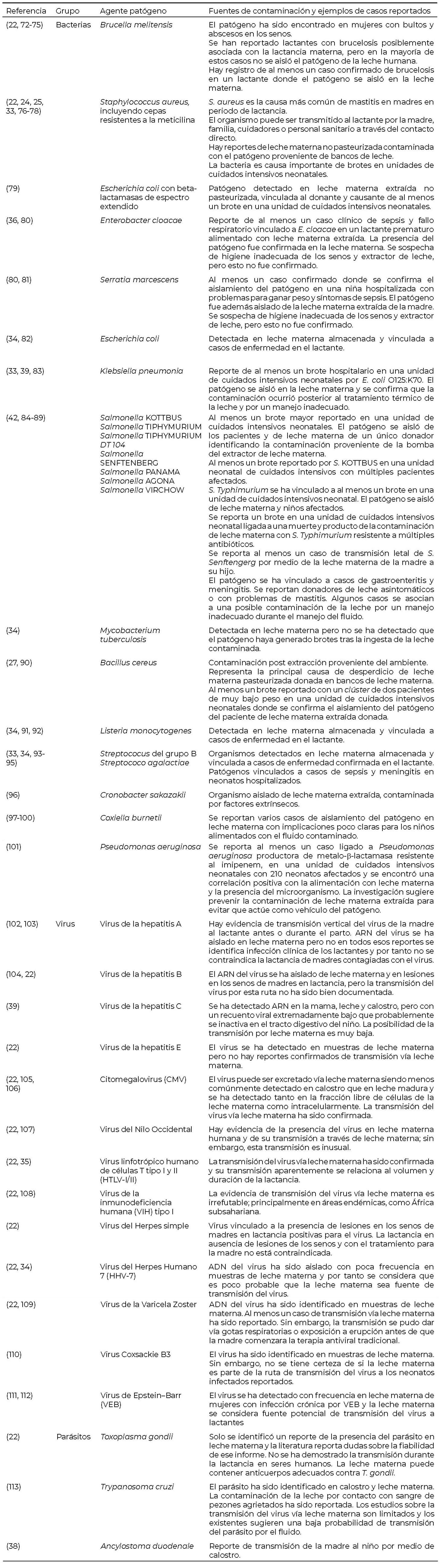
Los diversos agentes microbiológicos causantes de enfermedad, incluyendo bacterias, virus y parásitos vinculados a leche materna (por exposición de la mujer donante o por contacto directo de la leche extraída) (Tabla I). Resultan de particular atención aquellos patógenos que han causado brotes en unidades neonatales de cuidados intensivos, como por ejemplo Staphylococcus aureus (22) y Bacillus cereus (23). La presencia de S. aureus antes de la pasteurización es de particular preocupación ya que, de no controlarse las condiciones de manejo de la leche materna como el tiempo y la temperatura de almacenamiento, el microorganismo puede producir una enterotoxina resistente al calor que podría generar afecciones en los infantes, aún después de aplicar una pasteurización al fluido (24). Por su parte, las infecciones nosocomiales causadas por S. aureus resistente a la meticilina (MRSA por sus siglas en inglés) son una de las principales causas de brotes en las unidades de cuidados intensivos (25).
Bacillus cereus también representa un peligro de particular preocupación en leche materna dada su naturaleza de organismo esporulado y su capacidad de producir una enterotoxina estable al calor. Por lo tanto, la literatura enfatiza sobre la importancia de implementar controles posteriores a la pasteurización para garantizar la inocuidad de la leche materna (26). B. cereus se caracteriza por incluir cepas patógenas causantes de los síndromes emético y diarreico. Esto representa un grave riesgo de salud pública, en particular para neonatos prematuros, dado que su sistema inmunológico inmaduro y la posible exposición a procedimientos invasivos (en caso de hospitalizaciones), eleva el riesgo de infección con este patógeno (27).
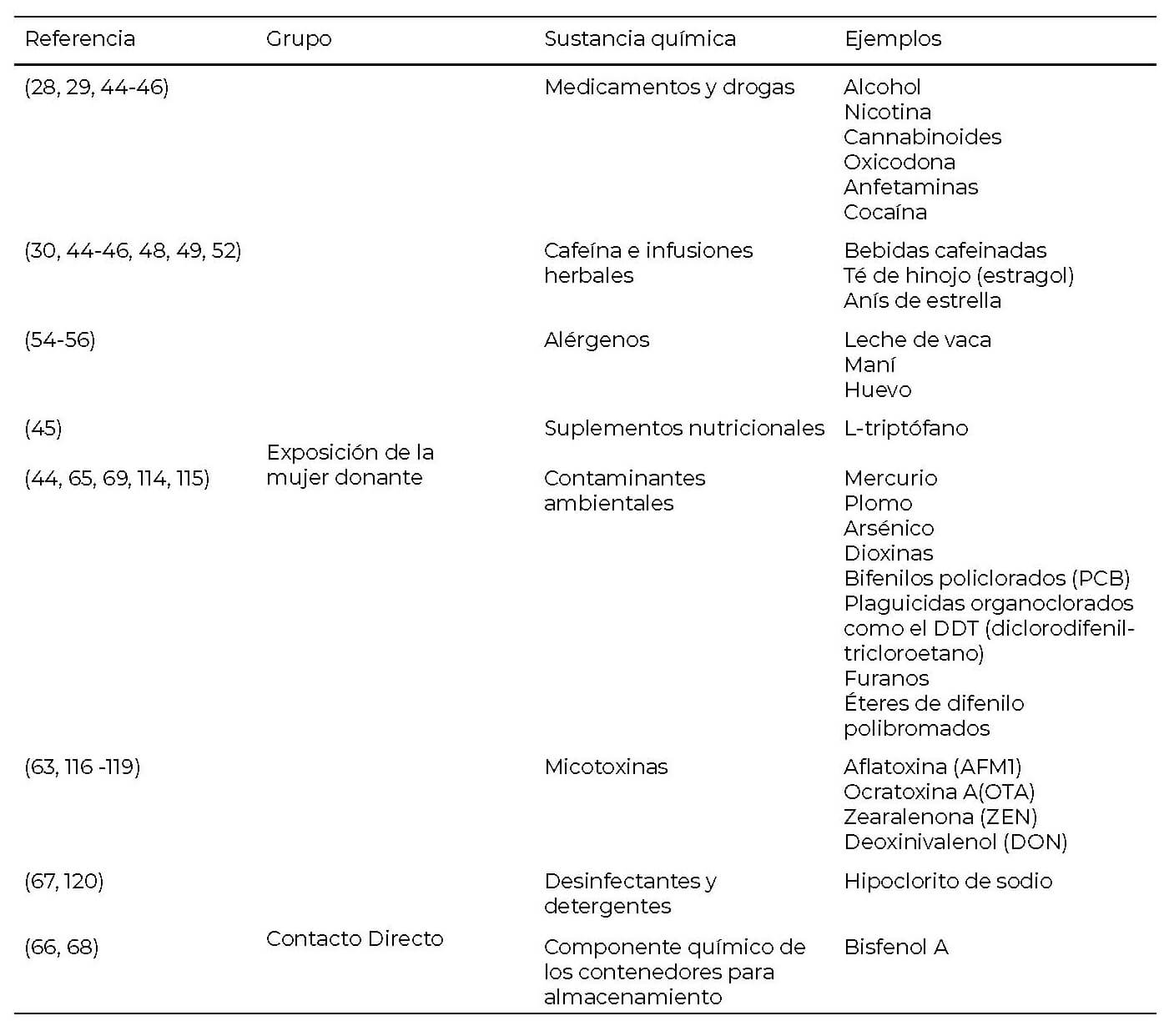
Los contaminantes químicos de interés en leche materna, por sus posibles repercusiones en el lactante, se presentan en la Tabla 1.
Estos peligros pueden clasificarse en dos grandes grupos según la vía por la que podrían llegar a la leche humana: por exposición de la mujer donante y por contacto directo de la leche extraída con algún contaminante.
Los posibles contaminantes químicos son numerosos, resultando de principal interés en los bancos de leche, el uso de medicamentos y drogas ilícitas por parte de la mujer donante debido a las posibles consecuencias en la salud del neonato al exponerse a ellos a través de la leche donada. Gran parte de estas sustancias químicas ingeridas por las mujeres en lactancia se pueden detectar en la leche, por lo que aún se sigue investigando los efectos sobre la salud a corto y largo plazo de la exposición infantil a estos (28).
Existen pocos reportes en la literatura de sustancias químicas detectadas en leche humana donada ya que los bancos normalmente no realizan estos análisis (29), sino que aplican cuestionarios antes de reclutar a las mujeres donantes y excluyen a aquellas que indican el uso de las sustancias químicas de interés.
Se ha reportado que estos cuestionarios han resultado efectivos en la detección de drogas ilícitas, aunque con cierta limitación para la detección de tabaco pasivo indirecto o de segunda mano y consumo de bebidas cafeinadas (30), lo cual explicaría la práctica de los bancos para filtrar con estos cuestionarios el ingreso de leche donada con los contaminantes químicos que les preocupan.
Dentro de los peligros químicos también se encuentran las micotoxinas y los alérgenos, capaces de migrar a la leche humana y causar daño al lactante. Ambos tipos de peligros se relacionan con el consumo de ciertos alimentos. Mientras que los peligros químicos derivados del contacto directo de la leche humana con el contaminante están asociados principalmente con las prácticas de limpieza y desinfección de los utensilios, así como el material de los contenedores utilizados para almacenar el fluido posterior a su extracción (Tabla 2).
Los organismos infecciosos pueden llegar a la leche humana extraída por secreción en el fluido, por componentes celulares o por contaminación externa del alimento durante la extracción y en etapas posteriores, producto de un manejo inadecuado (22, 33). La leche extraída directamente de la mujer contiene, con frecuencia, microorganismos comensales cutáneos, como por ejemplo estafilococos coagulasa negativos o estreptococos del grupo A, los cuales no representan ningún problema para el lactante (34). La mayoría de peligros microbiológicos identificados en leche materna raramente causan afecciones en la salud de los niños que la reciben, dada la presencia natural de anticuerpos específicos y factores antimicrobianos en el fluido (35). Es por esta razón que, pese a la posibilidad de transmisión de algunas enfermedades vía leche materna, en la gran mayoría de los casos la presencia de una enfermedad infecciosa en la madre no contraindica la lactancia. Sin embargo, hay algunos agentes patógenos específicos que requieren una consideración especial (34). La presencia de bacterias en leche materna no es inusual, pero incluso cuando se han detectado esporádicamente organismos Gram negativos patógenos en el fluido, el riesgo asociado de infección es bajo, excepto para el caso de neonatos prematuros (36). Por tanto, la selección de donadoras para bancos de leche humana en hospitales es de particular relevancia como mecanismo de prevención de enfermedades transmitidas por leche materna contaminada. Los principales peligros que pueden transmitirse de forma vertical a través de la leche materna corresponden a patógenos virales, específicamente virus de la inmunodeficiencia humana (VIH) y virus linfotrópico de células T humanas-1 (HTLV-1) (37).
Con la excepción de los parásitos que se mencionan en el Tabla 1, la transmisión de parásitos vía leche materna es poco frecuente, dado que su tamaño les impide cruzar la barrera de células endoteliales y células separadas por una matriz extracelular, para ingresar a la glándula mamaria (38).
Además de la transmisión vertical, de la madre a su hijo o de la donante al lactante, de agentes patógenos en leche humana, se deben considerar otras posibles fuentes de contaminación microbiana durante las etapas de extracción, manejo, transporte y almacenamiento del fluido (33). Este tema es de particular relevancia dada la necesidad de extracción de leche materna ya sea para la alimentación de hijos propios lactantes o donación de leche materna a bancos de leche humana destinada a pacientes que no puede ser alimentados directamente por su madre (39).
En la literatura se han reportado brotes de infección bacteriana debido a la contaminación de leche materna almacenada con bacterias patógenas tales como S. aureus, Estreptococos, Salmonella, Escherichia coli y otros organismos Gram negativos. Estos eventos se asocian con un manejo o almacenamiento incorrecto de la leche en, por ejemplo, las unidades de cuidados intensivos neonatales (40-42). Los puntos de entrada para la contaminación bacteriana de la leche extraída incluyen prácticas antihigiénicas de extracción tales como manos o extractor de leche mal lavados, así como el almacenamiento inadecuado de la leche, incluyendo temperatura o tiempos de almacenamiento incorrectos. Asimismo, para el caso de leche donada a bancos de leche humana, la presencia de patógenos se ha vinculado a procesos de pasteurización no conforme, esterilizado incorrecto de equipo de alimentación (sonda parenteral, sonda enteral, biberón o taza, entre otros) o bien por contaminación durante la fortificación de leche donada (35).
Con respecto a los peligros químicos, los medicamentos y las drogas lícitas e ilícitas, constituyen sustancias que representan un peligro en la leche materna. La Academia Americana de Pediatría (AAP por sus siglas en inglés), mantiene un listado de sustancias transferidas a la leche materna y sus posibles efectos en el lactante cuando se conocen (43). El alcohol y la nicotina no deben estar presentes en la leche humana donada (29, 44), tampoco drogas como cannabis, cocaína, anfetaminas, debido a que pueden afectar la condición médica de los neonatos ya que son contraindicados durante la lactancia por los efectos secundarios que producen (29, 45). Asimismo, la nicotina pasa rápidamente a la leche materna (46).
Drogas o fármacos que se han identificado con las que se da mayor abuso por parte de las mujeres en edad reproductiva y que por tanto son de preocupación por una potencial exposición del neonato a través de la leche materna incluyen: anfetaminas, barbitúricos, benzodiazepinas, cannabinoides, cocaína, meperidina, metadona, opiáceos, oxicodona, fenciclidina, propoxifeno, tramadol y buprenorfina (28). Los efectos adversos en el lactante por el abuso de alcohol, anfetaminas, benzodiazepinas, cocaína, heroína, LSD, metanfetamina, metilendioximetanfetamina, cannabis y fenciclidina también han sido reportados (45).
Usualmente los bancos de leche humana no realizan análisis de drogas a la leche donada, debido a la cantidad limitada del fluido, la amplia variedad de drogas que se requeriría evaluar y recursos asociados. El reporte de un banco que realizó el monitoreo indicó presencia de cotinina (un metabolito de la nicotina) en 0,3% de las muestras y oxicodona/oximofrina en 0,02% de las muestras (46). Se han encontrado cantidades altas de oxicodona en la leche materna y concentraciones terapéuticas en el plasma del lactante, por lo que agentes narcóticos como este no se recomiendan para la mujer en lactancia (45).
Es de preocupación el exceso en la ingesta de sustancias nocivas asociadas con el consumo de infusiones herbales. Por ejemplo, la infusión de hinojo (Foeniculum vulgare) tiene cantidades importantes de estragol (44), el cual se ha demostrado que es genotóxico y carcinogénico (47). El anís de estrella o anís estrellado (Illicium verum Hooker filius) es un producto también peligroso para los niños (48), pues se han identificado casos de niños, que, tras la ingesta de infusiones de anís de estrella, presentaron reacciones neurológicas adversas (49). Si se mezcla con el anís de estrella japonés (Illicium anisatum Siebold) aumenta su toxicidad (48). El anetol es un componente neurotóxico (50) abundante en el anís estrellado (48) y que puede ser secretado en la leche materna (51). Se reportan dos casos de lactantes intoxicados con síntomas de letargia al beber sus madres grandes cantidades (un promedio de 2 litros diarios) de una infusión con mezclas de hierbas que contenían hinojo y anís, atribuyéndose la intoxicación al efecto del atenol (52). Sin embargo, aún sigue siendo limitada la información sobre la seguridad de la ingesta de productos herbales durante la lactancia (53).
Excesos en el consumo de cafeína también deben ser considerados. En cuanto a los efectos en el lactante, como consecuencia a la exposición a la cafeína a través de la leche materna, se reporta irritabilidad, patrones pobres de sueño y una excreción lenta de la sustancia (43). Se ha reportado exclusión de mujeres donantes en los bancos de leche, por medio de cuestionarios, si tienen un consumo de cafeína superior a 400 mg diarios dada la fragilidad de los neonatos prematuros (46). No obstante, no hay claridad si los cuestionarios utilizados por algunos bancos de leche humana permiten detectar adecuadamente el consumo de cafeína. Un estudio encontró que 63% de las donantes tenían cafeína en su leche a pesar de haber reportado que no habían ingerido bebidas cafeinadas (30).
El efecto de la ingesta de suplementos dietéticos debe ser considerado como un peligro químico potencial. La suplementación con hierro y vitaminas de las mujeres que amamantan en general es segura, mientras que no se superen las cantidades diarias recomendadas (45). Sin embargo, la información disponible es escasa y no permite determinar si el consumo de otros suplementos dietéticos puede comprometer la inocuidad de la leche humana (45, 46). Por ejemplo, el L-triptófano se ha asociado con miositis eosinofílica (45), por lo que resulta de importancia la identificación de los tipos de suplementos dietéticos utilizados por las mujeres donantes.
Un alérgeno puede describirse como una sustancia, proteica o no proteica, capaz de inducir una alergia o hipersensibilidad específica (54). Los alérgenos presentes en la leche materna a través de la dieta de la madre pueden resultar de interés. Informes de casos clínicos indican síntomas atópicos en los lactantes por proteínas de la dieta transferidas a la leche materna (55). Se ha detectado la presencia de alérgenos en la leche humana, como maní, huevo y leche de vaca (54, 56), no obstante, excluir alérgenos de la dieta de la madre no se considera una medida preventiva efectiva ante la manifestación de reacciones alérgicas en los infantes (54). Existen diferentes hipótesis sobre el efecto de la presencia de alérgenos en la leche humana. En algunos estudios y revisiones se menciona que la exposición inicial con dosis bajas de alérgenos a través de la leche materna podría promover la tolerancia a los alérgenos en lugar de desarrollar manifestaciones alérgicas, por lo que se recomienda la exclusión de alérgenos de la dieta de la madre sólo en aquellos casos en que se ha demostrado una alergia alimentaria en el infante (54-56).
Las micotoxinas son metabolitos secundarios carcinogénicos de los hongos, las cuales pueden estar presentes en leche humana debido a la dieta de la madre y es la forma de exposición única a estos compuestos durante los primeros 6 meses de vida. Las micotoxinas encontradas en leche humana (Tabla II) se relacionan además con retrasos en el crecimiento de niños (57-62).
Las investigaciones sobre la presencia de micotoxinas en leche humana y sus efectos en la salud indican que es un peligro a considerar. Se han encontrado ingestas estimadas que superan los límites máximos tolerables de ingesta diaria (PMTDI por sus siglas en inglés) para Aflatoxina M1 en infantes debido al consumo de leche materna, siendo la dieta de la madre la principal causa, al encontrar una relación significativa con el consumo de pan (63). La preocupación en este caso, por lo tanto, sobrepasa el trabajo en BLH y se extiende a la industria alimentaria y su control en productos alimenticios (como un correcto etiquetado, implementación de planes de control de alérgenos que incluyan capacitación para prevenir el contacto cruzado).
Si bien se ha evidenciado que la exposición a aflatoxinas en Europa es despreciable, estudios demuestran que en África u Oriente Medio puede alcanzar niveles críticos (64), por lo que se debe valorar el riesgo en el contexto específico de cada BLH y su población.
Los contaminantes ambientales como mercurio, dioxinas y bifenilos policlorados (BPCs) también son consideraros peligros químicos de preocupación en leche materna pues son ingeridos en los alimentos y almacenados en el tejido graso y pueden ser secretados en la leche materna. No obstante, se requieren más estudios sobre su presencia en la leche humana donada y su posible efecto en la salud de los neonatos (44). Los contaminantes ambientales que más se han estudiado en leche humana pertenecen a un grupo denominado sustancias químicas persistentes, bioacumulativas y tóxicas (PBT por sus siglas en inglés). Los PBT incluyen varios plaguicidas organoclorados, bifenilos policlorados, dioxinas y furanos, y éteres de difenilo polibromados. Se han detectado estos químicos en la leche humana de poblaciones de todo el mundo, lo cual se asocia con la tendencia lipofílica y persistente de estas sustancias y el alto contenido de lípidos en la leche humana. Las poblaciones donde se asocian niveles más altos de las PBT en leche humana, son aquellas con consumo abundante de pescado y mamíferos marinos obtenidos localmente de aguas contaminadas (65).
Por su parte, los peligros químicos derivados por contacto directo de la leche materna están asociados con prácticas no adecuadas de limpieza, desinfección y almacenamiento del fluido. No es recomendable, por ejemplo, desinfectar los utensilios para la extracción y almacenamiento de la leche materna con sustancias químicas, por el riesgo de exposición del infante a residuos de estas sustancias (66). Además, los neonatos prematuros podrían tener efectos adversos en el desarrollo de su microbiota y en la piel, si son expuestos a residuales de desinfectantes o detergentes provenientes de los utensilios utilizados para su alimentación, sobre todo si tienen una exposición prolongada (67).
Para el almacenamiento de la leche humana, existe poca evidencia sobre la seguridad química y el efecto en la salud de los infantes por el uso de contenedores plásticos grado no alimentario (66). Los recipientes para muestra biológicas, por ejemplo, no se recomiendan para el almacenamiento de leche humana ya que no fueron diseñados para este fin y por tanto el fabricante no tiene responsabilidad legal para asegurar que su uso es químicamente seguro para los infantes (68). En el protocolo N°8 de la Academia de Medicina de Lactancia Materna (ABM por sus siglas en inglés), se recomienda evitar el uso de recipientes fabricados con bisfenol A, debido a la evidencia existente de sus efectos adversos como disruptor endocrino (66). Además, se ha detectado su presencia en la leche humana (69). Se recomienda cautela con los recipientes de bisfenol S, por potenciales efectos tóxicos, que aún no están claramente definidos en la literatura (66).
Se desconoce el daño esperado para un neonato que recibe una unidad de Leche Humana de Donante Pasteurizada (LHDP) en BLH en los que se mezcla la leche humana proveniente de diferentes donantes y lotes (46), ya que dependerá de la sustancia, la concentración de la sustancia, el peso y la salud del infante receptor. En general, es probable que el riesgo para un neonato que recibe LHDP sea menor que para uno que recibe leche materna contaminada con la misma sustancia tóxica, ya que es probable que la LHDP que reciba el neonato con el tiempo provenga de múltiples lotes (y de diferentes donantes) reduciendo así la exposición total a la sustancia. También se esperaría que la exposición a las sustancias tóxicas se redujera mediante la mezcla de varias unidades de LHDP. No obstante, es importante considerar los riesgos y no subestimarlos ante la posibilidad de dilución de la sustancia por la mezcla de lotes.
Para peligros físicos particularmente, no se logró identificar ningún caso clínico de un paciente afectado en BLH. Sin embargo, tomando como base la definición de peligro y lo que plantea el FDA para cuerpos extraños en alimentos, un tamaño menor a 7 mm puede causar daño en infantes, al ser un tamaño no detectable al ojo humano que al ser consumido puede atorarse o causar daño a órganos (70).
En un entorno hospitalario donde algunos neonatos son intubados, se podría tomar como referencia el diámetro del tubo para establecer las dimensiones de los objetos foráneos que se consideren peligros físicos, el cual va de 2,5 mm (en neonatos de menos de 1000 g, <28 semanas de edad gestacional) a 4,0 mm (en neonatos de más de 3000 g, >38 semanas de edad gestacional) (71).
Las guías que hacen referencia a peligros en leche humana, plantean la importancia de capacitar a las madres para revisar previamente los contenedores que se utilizarán y evitar usar los que se encuentren astillados o rotos, sin embargo, el riesgo en estas guías es considerado bajo o medio y se gestiona por medio de las BPM (14, 31).
La presencia de material extraño en BLH, donde se dirige la leche humana a poblaciones susceptibles, debe ser contemplada y se deben establecer medidas de control en el plan HACCP si se considera significativa (21). Se hace referencia especialmente a material duro o afilado, que pueda provocar lesiones o suponer riesgo de asfixia, como plástico, vidrio y fragmentos de metal (14, 19, 21, 31), cabe destacar que el cabello humano, las pelusas, el cabello de animales e insectos no se clasifican como peligro físico, al no ser compatible con la definición (19) y objetos extraños como piedras o joyería no se consideran peligrosos al controlarse mediante las BPM. Como se observa en la Figura 1, para este tipo de peligros la consideración directa debe estar relacionada con el tipo de envase que se usa en el BLH y el tipo de manipulación que se le da al fluido, así como las operaciones en las que puede dañarse el envase.
Se encuentra evidencia sobre la presencia de peligros microbiológicos y químicos en leche humana, pudiéndose dar transmisión vertical en ambos casos. La contaminación con peligros físicos se daría posterior a la extracción de la leche materna y se relaciona con el tipo de envase que se utiliza. Es necesario prestar atención a la alimentación de la madre, al uso de medicamentos, drogas, suplementos y al consumo de hierbas, especias y algunos alimentos al existir evidencia de su paso a la leche materna y efectos tóxicos potenciales en lactantes. Se requiere más investigación en temas relacionados con micotoxinas en leche materna en distintos países del mundo.
Este estudio fue realizado gracias al financiamiento de la Vicerrectoría de Acción Social de la Universidad de Costa Rica, mediante el proyecto número ED-3560 titulado “Evaluación de las condiciones de extracción y manejo de leche materna en Costa Rica para uso propio de la madre y su lactante y para donación a Bancos de Leche y planteamiento de estrategias tecnológicas para el aseguramiento de su calidad e inocuidad”.
Ninguno de los autores tiene conflictos de interés.
Recibido: 18/11/2022
Aceptado: 30/01/2023